今日頭條
免疫方舟CD40/4-1BB激動劑美國獲批臨床���。北京免疫方舟自主研發(fā)的CD40/4-1BB雙功能融合蛋白IMB071703獲FDA臨床許可�。IMB071703同時靶向CD40和4-1BB信號通路,并具有獨特的DC-T細胞銜接功能(DC-T cell engager)���,其活化特異性細胞毒性T細胞(specific CTL)顯著優(yōu)于傳統(tǒng)的非特異性免疫刺激劑。目前�,該新藥正在國內(nèi)開展I期臨床研究,評估用于治療復發(fā)或轉(zhuǎn)移的晚期惡性實體瘤患者的安全性與有效性���。
國內(nèi)藥訊
1.默沙東HIF-2α抑制劑擬納入優(yōu)先審評。默沙東“first-in-class” 缺氧誘導因子-2α(HIF-2α)抑制劑Belzutifan片獲CDE擬納入優(yōu)先審評���,擬定適應(yīng)癥為von Hippel-Lindau(VHL)病相關(guān)腎細胞癌(RCC)����、中樞神經(jīng)系統(tǒng)(CNS)血管母細胞瘤或胰腺神經(jīng)內(nèi)分泌腫瘤(pNET)�。在Ⅱ期臨床中,Belzutifan在VHL相關(guān)RCC患者中報告的客觀緩解率(ORR)為49%(95% CI:36����,62)���,在VHL相關(guān)CNS血管母細胞瘤患者的ORR為63%����,VHL相關(guān)pNET患者的ORR為83%���。
2.以明FIC拮抗劑獲CMML孤兒藥資格。以明生物的靶向白細胞免疫球蛋白樣受體B4(LILRB4)潛在“first-in-class”拮抗劑抗體IO-202獲FDA授予孤兒藥資格�,用于治療慢性粒單核細胞白血病(CMML)。IO-202具有Fc效應(yīng)功能���,通過抗體依賴性細胞毒性(ADCC)和抗體依賴性細胞吞噬(ADCP)作用而清除高表達LILRB4的細胞���。此前����,F(xiàn)DA已授予IO-202治療復發(fā)或難治性CMML的快速通道資格,以及用于AML的孤兒藥資格����。
3.默沙東TL1A抑制劑中國獲批臨床����。默沙東TL1A抗體MK-7240(PRA023)獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬開發(fā)治療中重度活動性潰瘍性結(jié)腸炎���。去年4月����,默沙東以108億美元收購Prometheus公司并獲得其首發(fā)管線PRA023項目���。在Ⅱ期臨床中,PRA023治療組和對照組臨床緩解率分別為26.5%和1.5%�,內(nèi)窺鏡檢查改善率分別為36.8%和6.0%,臨床響應(yīng)率分別為66.2%和22.4%����。目前,該新藥已進入Ⅲ期臨床開發(fā)����。
4.普方PTK7靶向ADC國內(nèi)獲批臨床。普方生物靶向蛋白酪氨酸激酶7(PTK7)的ADC藥物注射用PRO1107獲國家藥監(jiān)局臨床默示許可�,擬開發(fā)用于治療實體瘤患者。該新藥目前正在美國開展Ⅰ/Ⅱ期研究����,旨在評估PRO1107治療晚期實體瘤患者的安全性����、耐受性、藥代動力學(PK)和抗腫瘤活性����。2月16日,普方生物已完成1.12億美元超額B輪融資����,用于加速包括PRO1107共4款A(yù)DC管線臨床開發(fā)。
5.藥明生基獲批生產(chǎn)全球首款TIL療法���。藥明康德旗下藥明生基宣布,F(xiàn)DA批準其費城基地分析測試和生產(chǎn)Iovance公司腫瘤浸潤淋巴細胞(TIL)療法Amtagvi(lifileucel)����,該公司費城基地已成為美國首個獲得FDA批準用于支持實體瘤個體化T細胞療法商業(yè)化生產(chǎn)和放行的外部生產(chǎn)基地和第三方合同測試����、開發(fā)和生產(chǎn)組織(CTDMO)����。2月16日,F(xiàn)DA加速批準Amtagvi上市�,是全球首款TIL療法,用于治療晚期黑色素瘤���。
6.信達PD-1抑制劑聯(lián)合溶瘤病毒開展臨床�。ImmVirX公司創(chuàng)新溶瘤RNA病毒IVX037擬聯(lián)合信達生物PD-1抑制劑信迪利單抗注射液(達伯舒®)在澳大利亞開展聯(lián)合用藥Ib臨床�,評估聯(lián)合治療晚期結(jié)直腸���、卵巢囊腫和胃癌患者的抗腫瘤活性和耐受性�。Ia期研究結(jié)果顯示�,IVX037單藥瘤內(nèi)多次注射耐受良好,早期信號表明其誘導了潛在有益的炎癥細胞因子/趨化因子�,并在注射病灶中觀察到抗腫瘤活性。
國際藥訊
1.強生CD3/BCMA雙抗獲批延長注射間隔。強生BCMA/CD3雙特異性抗體Tecvayli(teclistamab)獲FDA批準補充生物制劑許可申請(sBLA)�,以降低注射頻率至每兩周1次(Q2W,1.5mg/kg)����,用于向在已實現(xiàn)≥6個月完全緩解或更好緩解的復發(fā)或難治性多發(fā)性骨髓瘤(MM)患者提供靈活的�、基于體重的給藥方案。2022年8月���,Tecvayli率先在歐盟上市���,是全球首款獲批用于RRMM的雙抗療法,也是首款BCMA靶向雙抗����。
2.輝瑞S1P調(diào)節(jié)劑獲歐盟批準上市。輝瑞口服選擇性1-磷酸鞘氨醇(S1P)受體調(diào)節(jié)劑伊曲莫德(VELSIPITY®)獲歐盟委員會(EC)批準上市���,用于治療中重度活動性潰瘍性結(jié)腸炎(UC)患者�。在Ⅲ期ELEVATE UC 52研究中���,etrasimod組第52周時患者達到32.1%(vs7.0%���,p<0.001)的臨床緩解率,完整數(shù)據(jù)已于去年3月發(fā)布于《柳葉刀》���。云頂新耀擁有etrasimod在大中華區(qū)的開發(fā)權(quán)益�。
3.再生元BCMA/CD3雙抗獲優(yōu)先審評資格���。再生元BCMA/CD3雙抗linvoseltamab的生物制品許可申請(BLA)獲FDA受理�,用于治療至少三種既往療法后疾病進展���、復發(fā)/難治性多發(fā)性骨髓瘤(MM)患者���。FDA同時授予其優(yōu)先審評資格,PDUFA日期為今年8月22日���。在I/II期LINKER-MM1試驗中����,中位隨訪為11個月時����,獨立審查委員會評估的linvoseltamab(200mg)的客觀緩解率為71%���,完全緩解率為46%。本月初�,該新藥的上市申請MAA也獲得歐盟受理�。
4.長效HIV注射療法Ⅲ期臨床積極。ViiV公司長效HIV藥物抗逆轉(zhuǎn)錄病毒療法(ART)Cabenuva(卡替拉韋+利匹韋林)治療HIV感染患者的Ⅲ期LATITUDE臨床中期結(jié)果積極�。與每日口服ART標準治療相比,每四周接受一次Cabenuva注射治療能更好地維持病毒載量的抑制�,療效優(yōu)于標準療法���。Cabenuva是全球首款獲批用于HIV感染成人患者的完整注射方案���,批準方案為每月一次或每2個月一次。
5.漸凍癥創(chuàng)新組合復方Ⅱb期研究成功����。NeuroSense公司創(chuàng)新組合配方PrimeC(環(huán)丙沙星/塞來昔布)用于治療肌萎縮側(cè)索硬化(ALS���,即漸凍癥)的Ⅱb期PARADIGM臨床試驗達到了主要和次要終點。與安慰劑相比�,PrimeC治療顯著減緩患者的疾病進展37.4%(p=0.03)�;且PrimeC治療將ALS疾病并發(fā)癥或死亡風險降低53%���。此外,患者生活質(zhì)量(包括心理和身體健康)的改善也具統(tǒng)計學意義���。該試驗的神經(jīng)絲生物標志物結(jié)果預(yù)計將在今年第一季度公布。
6.RAPT公司免疫療法臨床被叫停�。FDA暫停RAPT公司主要免疫學候選藥物zelnecirnon治療特應(yīng)性皮炎的Ⅱb期臨床試驗和用于治療哮喘的Ⅱa期�。在治療特應(yīng)性皮炎的Ⅱb期臨床中,有1例患者出現(xiàn)肝功能衰竭����。受此消息影響,RAPT股價當天暴跌73%���。目前,RAPT 正在對該病例進行徹底調(diào)查�。在Ⅰb期試驗中,zelnecirnon治療4周后患者的濕疹面積和嚴重程度指數(shù)(EASI)評分較安慰劑顯著改善(36.3%vs17.0%)���,且研究中沒有報告嚴重不良事件����。
醫(yī)藥熱點
1.劇烈運動或可降低AD相關(guān)死亡風險�。澳大利亞悉尼大學Emmanuel Stamatakis研究團隊發(fā)表于《柳葉刀·老齡健康》上的一項最新研究顯示,每周20分鐘(每天約3分鐘)的劇烈運動就有生存獲益����,每周累計進行140分鐘(每天20分鐘)劇烈運動的效果最好���,與阿爾茨海默病相關(guān)死亡風險降低21%有關(guān)���。但當每周劇烈運動時間超過140分鐘時,獲益開始減少�,在超過190分鐘后獲益將消失。
2.心臟病全國重點實驗室在上海中山醫(yī)院揭牌����。近日���,由葛均波����、陳義漢、黃荷鳳三位院士牽頭的心臟病全國重點實驗室在復旦大學附屬中山醫(yī)院正式揭牌���。該實驗室是專門從事心臟病臨床與基礎(chǔ)轉(zhuǎn)化研究的全國重點實驗室���,將在依托同濟大學附屬東方醫(yī)院、同濟大學和復旦大學附屬中山醫(yī)院的優(yōu)勢資源�,積極開展原創(chuàng)性研究����,攻克心血管領(lǐng)域的重大科學問題和技術(shù)瓶頸����,并提升我國在心血管領(lǐng)域的國際影響力。
3.北京呼吸道傳染病呈現(xiàn)流感和新冠共同流行態(tài)勢�。22日,北京市疾控中心發(fā)布節(jié)后疫情健康提示稱����,目前北京市呼吸道傳染病呈現(xiàn)流感和新冠共同流行的態(tài)勢���。流感病毒活動度近期呈現(xiàn)小幅下降趨勢����。近一周北京市哨點醫(yī)院流感樣病例中流感病毒陽性率為30.3%,較前一周31.4%略有下降���,乙型流感病毒為主要流行株�。新冠病毒活動度持續(xù)上升���,近一周哨點醫(yī)院流感樣病例中新冠病毒陽性率為21.1%,JN.1變異株為主要流行株����。
評審動態(tài)
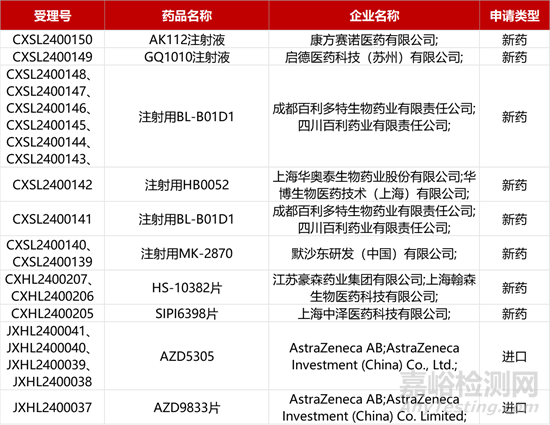
1. CDE新藥受理情況(02月22日)
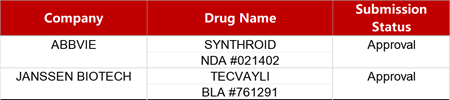
2. FDA新藥獲批情況(北美02月21日)