摘要
目的 促進(jìn)我國化學(xué)藥生產(chǎn)企業(yè)質(zhì)量管理能力提升�����。方法 通過分析 2015年至 2022年我國化學(xué)藥生產(chǎn)企業(yè)境外檢查觀察情況及檢查發(fā)現(xiàn)缺陷分布�����,總結(jié)境外檢查重點(diǎn)和高頻缺陷的類別��。結(jié)果 2015 年至 2022年,24個(gè)境外藥品監(jiān)管機(jī)構(gòu)對我國化學(xué)藥生產(chǎn)企業(yè)完成443家次境外檢查����,發(fā)現(xiàn)缺陷 4854 項(xiàng)。2015 年至 2019年���,境外藥品監(jiān)管機(jī)構(gòu)檢查家次數(shù)逐年上升��,分別為 74.81.84.82102 家次���;2020 年至 2022 年,受新型冠狀病毒感染疫情影響����,境外檢查次數(shù)明顯減少��,分別為6,6,8家次����。2015 年至 2019年��,世界衛(wèi)生組織(WHO)�、歐洲藥品質(zhì)量理事會(huì)(EDOMI)、美國食品和藥物管理局(FDA)檢查發(fā)現(xiàn)的次均缺陷數(shù)分別約為 20,20,5項(xiàng)��;嚴(yán)重缺陷主要由數(shù)據(jù)可靠性問題引起��,但發(fā)生次數(shù)占比逐年降低��。2019年�����,國家藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心共檢查觀察境外藥品監(jiān)管機(jī)構(gòu) 102 家次�,發(fā)現(xiàn)缺陷 793 項(xiàng),排序前三的高頻缺陷有質(zhì)量控制與質(zhì)量保證�、文件管理、確認(rèn)與驗(yàn)證,分別占 32.53%.14.88%.13.75%���。結(jié)論 不同境外藥品監(jiān)管機(jī)構(gòu)的檢查重點(diǎn)及高頻缺陷類別基本類似�。我國化學(xué)藥生產(chǎn)企業(yè)在質(zhì)量控制與質(zhì)量保證���、確認(rèn)與驗(yàn)證、文件管理等方面與國際水平仍存在差距���。我國藥品生產(chǎn)企業(yè)應(yīng)根據(jù)實(shí)際情況��,持續(xù)提升生產(chǎn)質(zhì)量管理水平�;我國藥品監(jiān)管機(jī)構(gòu)應(yīng)基于上述風(fēng)險(xiǎn)深入開展藥品檢查�,促進(jìn)企業(yè)質(zhì)量管理能力全面提升。
隨著我國科學(xué)技術(shù)的迅猛發(fā)展�,以及市場發(fā)展及政府配套措施的扶助引導(dǎo),醫(yī)藥工業(yè)轉(zhuǎn)型升級����,我國已形成較完善的制藥產(chǎn)業(yè)鏈和產(chǎn)業(yè)群。眾多醫(yī)藥企業(yè)正在走向國際化經(jīng)營模式�����,并具備了一定的全球競爭力�����,越來越多的境外藥品監(jiān)管機(jī)構(gòu)也來華進(jìn)行藥品檢查。20世紀(jì)90年代末,我國開始了對來華進(jìn)行藥品檢查的境外藥品監(jiān)管機(jī)構(gòu)的相應(yīng)檢查觀察工作����。2010年前后,原國家食品藥品監(jiān)督管理局藥品認(rèn)證管理中心逐漸將境外檢查觀察工作制度化����,我國藥品監(jiān)管部門也開始加速推進(jìn)藥品檢查國際化,不斷提升藥品檢查能力����。隨著境外藥品監(jiān)管機(jī)構(gòu)來華檢查的日益增加,國家藥品監(jiān)督管理局(NMPA)于2019年進(jìn)一步完善了外檢查觀察的相應(yīng)管理��。本研究中通過分析2015 年至2022年我國化學(xué)藥生產(chǎn)企業(yè)境外檢查觀察情況及檢查發(fā)現(xiàn)缺陷分布��,總結(jié)境外檢查重點(diǎn)和高頻缺陷的類別?,F(xiàn)報(bào)道如下。
一��、藥品境外檢查觀察
當(dāng)境外藥品監(jiān)管機(jī)構(gòu)對我國人用藥品進(jìn)行檢查時(shí)�,我國藥品監(jiān)督管理部門會(huì)派出具有經(jīng)驗(yàn)的藥品檢查員對境外藥品監(jiān)管機(jī)構(gòu)的檢查過程進(jìn)行見證和記錄。根據(jù)NMPA與境外藥品監(jiān)管機(jī)構(gòu)簽署的相關(guān)合作協(xié)議,境外藥品監(jiān)管機(jī)構(gòu)派員對我國企業(yè)開展檢查時(shí),通常會(huì)通知NMPA 派出觀察員進(jìn)行觀摩��。NMPA食品藥品審核查驗(yàn)中心(簡稱核查中心)具體負(fù)責(zé)境外檢查觀察的具體實(shí)施�����。當(dāng)核查中心接到NMPA境外藥品監(jiān)管機(jī)構(gòu)檢查計(jì)劃或通知后���,會(huì)選派有資質(zhì)的藥品檢查員作為境外檢查的觀察員�����。觀察員對檢查的全過程進(jìn)行觀察并客觀記錄,包括文件記錄���、現(xiàn)場情況���、提出的問題和建議等,并書寫觀察檢查報(bào)告�。
二、2015 年至 2022 年我國化學(xué)藥接受境外檢查觀察概況
2.1 總體情況
2015 年至2022年,美國食品和藥物管理局(FDA)世界衛(wèi)生組織(WHO)���、歐洲藥品質(zhì)量理事會(huì)(EDOM)德國漢堡健康及消費(fèi)者保護(hù)部(BGV)����、巴西衛(wèi)生監(jiān)督局(ANVISA)等24個(gè)境外藥品監(jiān)管機(jī)構(gòu)檢查我國化學(xué)藥生產(chǎn)企業(yè) 443 家次。
2.2 檢查次數(shù)
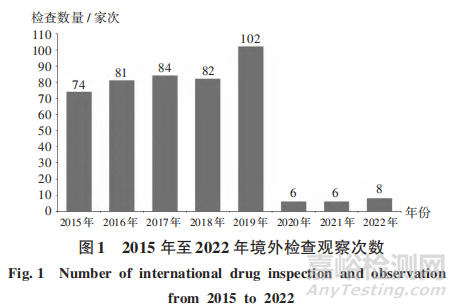
2015年至2019年���,境外藥品監(jiān)管機(jī)構(gòu)檢查數(shù)量逐年增加�����,分別為74,81,84,82,102家次���;受新型冠狀病毒感染(簡稱新冠)疫情影響,2020年至2022年��,境外檢查數(shù)量急劇減少�,分別為6,6,8家次,其中遠(yuǎn)程檢查分別為3,3,4家次。詳見圖1�����。
2.3 檢查發(fā)現(xiàn)的缺陷
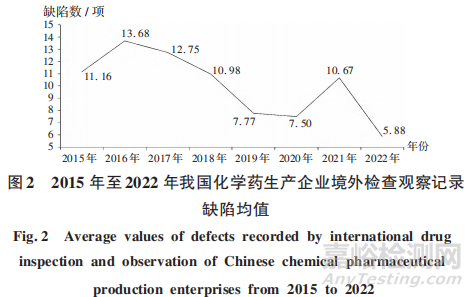
隨著《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2010年修訂,以下簡稱 GMP)的深人實(shí)施,我國藥品生產(chǎn)企業(yè)整體GMP水平不斷提高�����。2015年至2022年����,核查中心共進(jìn)行443家次境外檢查觀察����,記錄缺陷4854項(xiàng)���;境外藥品監(jiān)管機(jī)構(gòu)檢查發(fā)現(xiàn)的次均缺陷數(shù)呈下降趨勢���。詳見圖2。
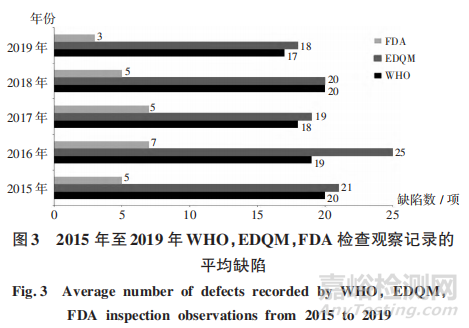
由于不同境外藥品監(jiān)管機(jī)構(gòu)的檢查員背景和專長有差異��,所發(fā)現(xiàn)缺陷數(shù)量存在差異��。2015年至2019年WHO 和 EDOM檢查發(fā)現(xiàn)的缺陷數(shù)量相對較多�����,平均每次檢查發(fā)現(xiàn)約20項(xiàng)����,且所有問題均進(jìn)行詳細(xì)描述�����;FDA檢查發(fā)現(xiàn)的缺陷數(shù)量相對較少,平均每次檢查發(fā)現(xiàn)約5項(xiàng)�����,由檢查員結(jié)合產(chǎn)品風(fēng)險(xiǎn)和發(fā)現(xiàn)缺陷進(jìn)行綜合判斷后形成最終缺陷項(xiàng)��。詳見圖3�����。
受新冠疫情影響���,2020年至2022年的境外檢查數(shù)量明顯減少��。俄羅斯聯(lián)邦藥物與規(guī)范研究院(SID& GP)波蘭藥品檢查局(CPI)采用遠(yuǎn)程檢查的方式進(jìn)行檢查FDA和 WHO 等仍進(jìn)行現(xiàn)場檢查�。2020年至2022年����,現(xiàn)場檢查10次,發(fā)現(xiàn)缺陷87項(xiàng)����;遠(yuǎn)程檢查10次,發(fā)現(xiàn)缺陷44項(xiàng)�����。
2.4 檢查發(fā)現(xiàn)的嚴(yán)重缺陷
2015年至2019年,境外檢查發(fā)現(xiàn)嚴(yán)重缺陷的次數(shù)占比逐年降低�����,發(fā)現(xiàn)的嚴(yán)重缺陷主要由數(shù)據(jù)可靠性問題引起���;2021年至2022年,均未發(fā)現(xiàn)嚴(yán)重缺陷�。詳見表1��。數(shù)據(jù)可靠性問題可簡單分為規(guī)范性因素和真實(shí)性因素兩方面�。2015年至2017年,嚴(yán)重缺陷主要是違背誠實(shí)信用原則故意編造�����、篡改數(shù)據(jù)等導(dǎo)致的數(shù)據(jù)可靠性問題��,隨著全球主要藥品監(jiān)管機(jī)構(gòu)�、國際組織和我國藥品監(jiān)管部門針對藥品數(shù)據(jù)發(fā)布的一系列指南��、法規(guī)���,我國藥品生產(chǎn)企業(yè)質(zhì)量管理體系不斷提高�����,真實(shí)性因素導(dǎo)致的數(shù)據(jù)可靠性缺陷逐漸被規(guī)范性因素導(dǎo)致的數(shù)據(jù)可靠性替代����。2018年至2022年,境外檢查發(fā)現(xiàn)的嚴(yán)重缺陷開始轉(zhuǎn)向了無菌保障�、風(fēng)險(xiǎn)評估、變更控制���、防交叉污染等多個(gè)影響產(chǎn)品質(zhì)量的關(guān)鍵因素���。
三、2019 年化學(xué)藥生產(chǎn)企業(yè)接受境外檢查觀察分析
3.1 我國核查中心檢查觀察情況
3.1.1 檢查觀察次數(shù)
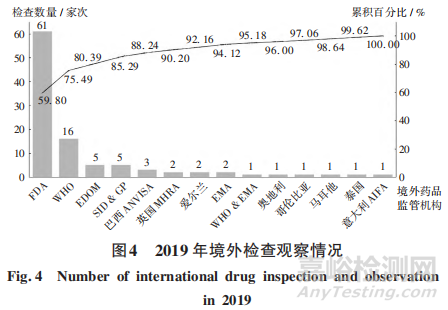
2019年���。核查中心組織開展對主要包括FDA等在內(nèi)的 13個(gè)境外藥品檢查機(jī)構(gòu)的檢查觀察102家次���,其中FDA,WHO���,EDOM 3個(gè)境外藥品檢查機(jī)構(gòu)檢查觀察82家次,約占全年檢查觀察的80.39%�����。詳見圖4�。
3.1.2 檢查觀察發(fā)現(xiàn)的缺陷
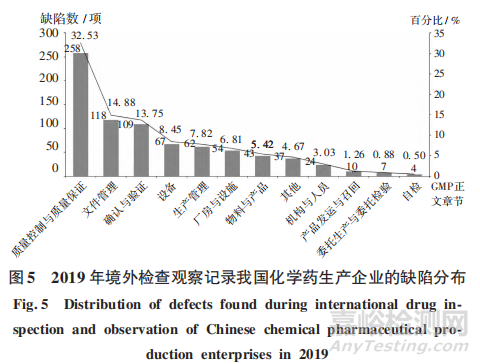
2019年,檢查觀察共記錄境外藥品檢查機(jī)構(gòu)檢查發(fā)現(xiàn)缺陷793項(xiàng)��,參照GMP正文章節(jié)對境外檢查觀察中記錄的缺陷進(jìn)行分析�����。其中��,質(zhì)量控制與質(zhì)量保證文件管理���、確認(rèn)與驗(yàn)證�����、設(shè)備���、生產(chǎn)管理5個(gè)類別的缺陷約占全部缺陷的 77.43%。詳見圖5���。
3.2 境外藥品監(jiān)管機(jī)構(gòu)檢查觀察情況
3.2.1 FDA
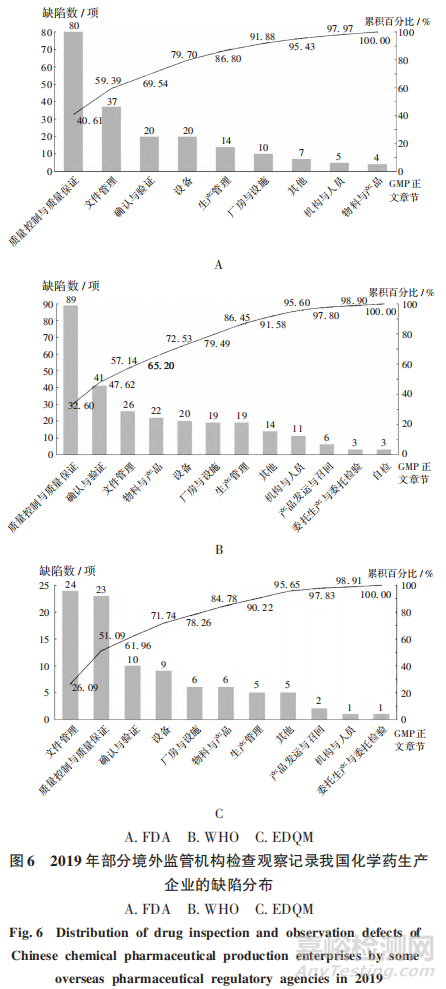
2019年���,核查中心共組織FDA對我國化學(xué)藥生產(chǎn)企業(yè)檢查觀察61家次,發(fā)現(xiàn)缺陷197項(xiàng),約占2019年全部境外藥品監(jiān)管機(jī)構(gòu)發(fā)現(xiàn)缺陷的24.84%��,平均每次檢查提出缺陷約3項(xiàng)���。參照GMP正文章節(jié)��,將FDA 檢查觀察中記錄的缺陷分類���,詳見圖6A。質(zhì)量控制與質(zhì)量保證����、文件管理、確認(rèn)與驗(yàn)證部分提出的缺陷占比分別居第1,2,3位���,占比分別為40.61%,18.78%,10.15%����,與2015 年至 2018年FDA在我國檢查發(fā)現(xiàn)的情況一致�。
1)質(zhì)量控制與質(zhì)量保證問題涉及偏差調(diào)查不充分未找到根本原因,糾正措施和預(yù)防措施(CAPA)無效變更的風(fēng)險(xiǎn)評估不完整,年度質(zhì)量回顧不全面��,投訴未啟動(dòng)調(diào)查�����,穩(wěn)定性考察項(xiàng)目的方法/標(biāo)準(zhǔn)與《美國藥典》(USP)不一致����,儀器缺少/未開啟審計(jì)追蹤,檢測儀器多人共用一個(gè)賬戶�����,取樣不具代表性�����,檢驗(yàn)的原始記錄/附圖不完全,質(zhì)量管理部門對電子數(shù)據(jù)審核缺失等��。
2)文件管理問題涉及記錄的信息不完整/缺失����,記錄的唯一性不受控,記錄未及時(shí)填寫和簽名��,關(guān)鍵的探作/數(shù)據(jù)等缺少簽名和復(fù)核,相關(guān)操作未建立規(guī)程等��。
3)確認(rèn)與驗(yàn)證問題涉及清潔驗(yàn)證不足,部分設(shè)備/器具的清潔程序未驗(yàn)證,工藝驗(yàn)證未涵蓋工藝參數(shù)范圍,設(shè)備確認(rèn)未涵蓋生產(chǎn)使用范圍等����。
3.2.2 WHO
2019年��,核查中心共組織WH0對我國化學(xué)藥生產(chǎn)企業(yè)檢查觀察16家次����,發(fā)現(xiàn)缺陷273項(xiàng),約占2019年全部境外藥品檢查機(jī)構(gòu)發(fā)現(xiàn)缺陷的34.43%,平均每次檢查提出缺陷約 17項(xiàng)�����。參照 GMP正文章節(jié)�����,對WHO 檢查觀察中記錄的缺陷分類�,詳見圖6B。質(zhì)量控制與質(zhì)量保證��、確認(rèn)與驗(yàn)證��、文件管理部分提出的缺陷分別居第1,2,3位,占比分別為32.60%,15.02%,9.52%。
1)質(zhì)量控制與質(zhì)量保證問題涉及偏差未按流程調(diào)查及 CAPA 不足���,偏差未定期回顧����,缺少審計(jì)追蹤功能或未啟用���,時(shí)區(qū)未鎖定/各檢測儀器時(shí)間存在較大差異,分析方法變更后未驗(yàn)證�����,水����、環(huán)境檢測��、投訴�、偏差等未進(jìn)行年度回顧,變更未進(jìn)行風(fēng)險(xiǎn)評估/未對變更前后進(jìn)行對比�,微生物實(shí)驗(yàn)室的標(biāo)識(shí)、人員培訓(xùn)�����、滅菌設(shè)備等管理存在不足,未進(jìn)行培養(yǎng)基適應(yīng)性試驗(yàn)等�。
2)確認(rèn)與驗(yàn)證問題涉及驗(yàn)證未考慮最差條件,未建立(再)驗(yàn)證與確認(rèn)計(jì)劃�,驗(yàn)證與確認(rèn)未進(jìn)行/部分遺漏,未進(jìn)行清潔驗(yàn)證/清潔驗(yàn)證存在清潔溶劑選擇錯(cuò)誤��,未考慮殘留及擦拭點(diǎn)未評估����,工藝驗(yàn)證不充分���,溶劑回收風(fēng)險(xiǎn)評估不足��,物料/中間體等制訂的效期未驗(yàn)證等�����。
3)文件管理問題涉及批記錄設(shè)計(jì)不全�����,批記錄未記錄偏差等異常事件����,不同文件/記錄不一致,規(guī)程與實(shí)際操作不一致���,記錄散頁不受控����,未及時(shí)記錄和復(fù)核等���。
3.2.3 EDOM
2019年����,核查中心共組織EDOM對我國化學(xué)藥生產(chǎn)企業(yè)檢查觀察5家次�,發(fā)現(xiàn)缺陷92項(xiàng),約占2019 年全部境外藥品檢查機(jī)構(gòu)發(fā)現(xiàn)缺陷的11.60%,平均每次檢查提出陷約18項(xiàng)��。參照 GMP正文章節(jié)�,對EDOM 檢查觀察中記錄的缺陷分類,詳見圖6C����。文件管理、質(zhì)量控制與質(zhì)量保證���、確認(rèn)與驗(yàn)證部分提出的缺陷分別居第1.2,3位,占比分別為26.09%,25.00%,10.87%�����。
1)文件管理問題涉及批記錄未記錄偏差等異常事件����,文件規(guī)定不全/未建立相關(guān)規(guī)程,文件規(guī)定不合理/錯(cuò)誤��,記錄設(shè)計(jì)不全/信息填寫不全��,活頁記錄不受控��,記錄編號(hào)/頁碼控制缺失��,操作人員/復(fù)核人員未簽名等���。
2)質(zhì)量控制與質(zhì)量保證問題涉及偏差調(diào)查不徹底、評估不充分,變更未進(jìn)行評估/變更未完成前已實(shí)施�,年度質(zhì)量回顧不全,水系統(tǒng)����、潔凈區(qū)環(huán)境等監(jiān)測缺乏審查和趨勢分析,新增供應(yīng)商未確認(rèn)�,取樣點(diǎn)未評估檢測的樣品不具代表性���,計(jì)算機(jī)未得到適當(dāng)控制等。
3)確認(rèn)與驗(yàn)證問題涉及工藝驗(yàn)證考慮不全�����,計(jì)算機(jī)系統(tǒng)驗(yàn)證未考慮操作系統(tǒng)的更新問題�,執(zhí)行的參數(shù)效期等沒有進(jìn)行驗(yàn)證,設(shè)備驗(yàn)證不包括附屬設(shè)施�����,滅菌驗(yàn)證溫度探頭放置位置不科學(xué)等�����。
四���、建議
通過分析近年來我國化藥品生產(chǎn)企業(yè)境外檢查觀察情況及缺陷分布�����,發(fā)現(xiàn)不同境外藥品檢查機(jī)構(gòu)雖發(fā)現(xiàn)的具體缺陷有差異�,但檢查的重點(diǎn)及發(fā)現(xiàn)高頻缺陷的類別基本類似�,表明我國化學(xué)藥生產(chǎn)企業(yè)在質(zhì)量控制和質(zhì)量保證���、確認(rèn)和驗(yàn)證、文件管理等方面仍與國際水平有一定差距����,建議藥品生產(chǎn)企業(yè)對癥下藥,全面提高質(zhì)量管理水平����。另外,基于化學(xué)藥生產(chǎn)企業(yè) GMP的實(shí)際情況����,我國藥品檢查機(jī)構(gòu)也應(yīng)將質(zhì)量控制和質(zhì)量保證、確認(rèn)和驗(yàn)證��、文件管理等作為檢查重點(diǎn)��,結(jié)合化學(xué)藥生產(chǎn)企業(yè)的具體情況���,有的放矢地進(jìn)行檢查。
質(zhì)量控制和質(zhì)量保證�����、確認(rèn)與驗(yàn)證、文件管理等是藥品檢查發(fā)現(xiàn)缺陷的“重災(zāi)區(qū)”?�,F(xiàn)階段�����,我國相當(dāng)部分的化學(xué)藥生產(chǎn)企業(yè)以符合法規(guī)為目的�����、按GMP組織生產(chǎn)活動(dòng)��,但未將 GMP 作為強(qiáng)化自身管理的有力工具���?��;瘜W(xué)藥生產(chǎn)企業(yè)應(yīng)根據(jù)自身實(shí)際,活學(xué)活用,持續(xù)提升其生產(chǎn)質(zhì)量管理水平,最終形成企業(yè)獨(dú)特的質(zhì)量文化�。
我國藥品生產(chǎn)企業(yè)GMP水平參差不齊,而檢查資源又相對有限���。我國藥品監(jiān)管機(jī)構(gòu)可在境外藥品檢查機(jī)構(gòu)監(jiān)管的基礎(chǔ)上進(jìn)行風(fēng)險(xiǎn)研判��,聚焦檢查關(guān)鍵性問題及高風(fēng)險(xiǎn)問題��。同時(shí)�,對境外藥品檢查機(jī)構(gòu)監(jiān)管發(fā)現(xiàn)的問題深人總結(jié)與分析,作為了解我國化學(xué)藥品行業(yè)生產(chǎn)質(zhì)量管理水平的重要手段����。同時(shí),與我國藥品檢查機(jī)構(gòu)進(jìn)行藥品監(jiān)管時(shí)發(fā)現(xiàn)的問題進(jìn)行對比分析�����,深入了解藥品的行業(yè)現(xiàn)狀和檢查現(xiàn)狀,做到基于風(fēng)險(xiǎn)的藥品檢查����。
參考文獻(xiàn)
[1]黃寶斌,許明哲,白東亭,等.WHO藥品預(yù)認(rèn)證項(xiàng)目為我國藥品生產(chǎn)企業(yè)的國際化開辟道路[J.中國醫(yī)藥工業(yè)雜志,2014,45(7):697-702.
[2]查玉琴,付映林,王 杰,等.制藥工業(yè)的現(xiàn)狀和發(fā)展趨勢分析[J].廣州化工,2020,48(6):14-16.
[3]王金庫,劉 華.化學(xué)制藥企業(yè)實(shí)施國際化經(jīng)營的策略探索門��,產(chǎn)業(yè)與科技論壇,2017,16(3):237-238.
[4] LIN XH, HU H, LU Y, et al. The comprehensive influence offirm- level factors on drug product internationalization ofChinese pharmaceutical firms [j]. Journal of Chinese Pharma-ceutical Sciences,2018,27(3):209-214.
[5]陸仕華,韋瑩瑩,李 杉,等.藥品 GMP跟蹤檢查與認(rèn)證檢查缺陷對比[J].中國醫(yī)藥工業(yè)雜志,2019,50(1):118-121.
[6]顏若曦,曹 軼�����。藥品生產(chǎn)企業(yè)數(shù)據(jù)可靠性缺陷分析[J]中國藥物警戒,2018.15(1):20-23.
[7]國家食品藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心.國家食品藥品監(jiān)督管理局關(guān)于發(fā)布《2017年度藥品檢查報(bào)告》的公告(2018年第32號(hào))[A/0L].(2018-06-05)[2023-03-03].http:// www. cfdi.org.cn/resource/ news/ 10430.btol.
[8]顏若曦,曹 軼,董江萍.FDA對我國藥品生產(chǎn)企業(yè)檢查分析[J].中國新藥雜志,2020,29(15):1697-1701.
[9]胡位歆,和金周.國內(nèi)外制藥企業(yè)質(zhì)量管理成熟度現(xiàn)狀及對我國藥品生產(chǎn)監(jiān)管的啟示[J].中國醫(yī)藥導(dǎo)刊,2022,24(8):740-745.
[10]孫 濤,余 泓,秦昆明.制藥企業(yè)《藥品生產(chǎn)質(zhì)量管理規(guī)范》體系與企業(yè)文化協(xié)同發(fā)展研究[J���,中國藥業(yè),2022.31(15):20-23.
[11]羅 瀟.藥品檢查員隊(duì)伍職業(yè)化建設(shè)研究 -基于H省藥品檢查工作及隊(duì)伍現(xiàn)狀實(shí)證分析[D.鄭州:鄭州大學(xué),2022
[12]王 丹,歐陽楠,陳 穎.省級職業(yè)化藥品檢查員隊(duì)伍構(gòu)建現(xiàn)狀分析[J].中國藥業(yè),2021,30(2):11-14.
[13]楊璐瑤,楊 悅。美國FDA基于風(fēng)險(xiǎn)的藥品檢查計(jì)劃的研究與借鑒[J].中國新藥雜志,2020,29(22):2535-2540
[14]黎依嫻,沈 波,陳佩毅,等.基于風(fēng)險(xiǎn)的藥品上市后變更現(xiàn)場檢查要點(diǎn)[J.今日藥學(xué),2022,32(8):638-640.