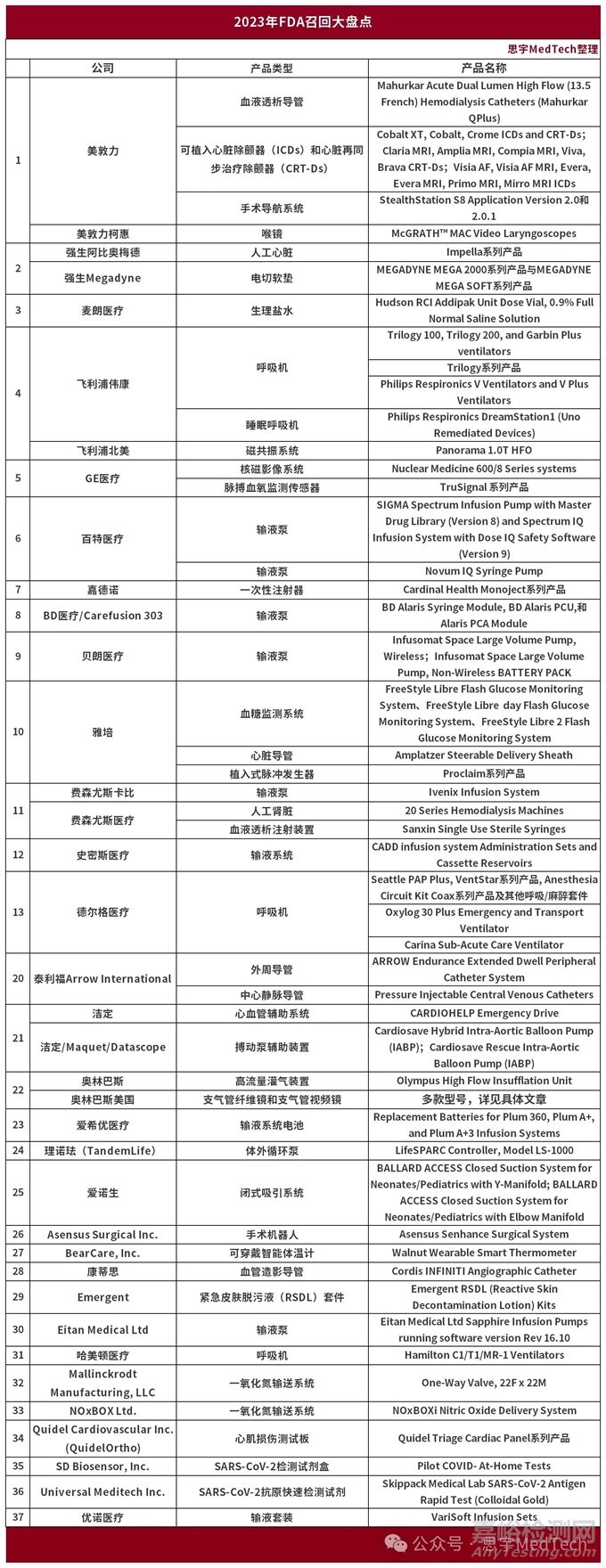
在2023年FDA發(fā)布的61篇召回通告中����,涉及到37家品牌的51款產(chǎn)品�。由于有些同類產(chǎn)品發(fā)了多篇通告���、也有一篇通告中多個(gè)產(chǎn)品����,按照公司整理了產(chǎn)品如下表�����。
并查詢和分析了每個(gè)產(chǎn)品的主要缺陷����,見本文第三部分��。
什么是FDA召回����?
FDA是負(fù)責(zé)保護(hù)公眾健康的聯(lián)邦機(jī)構(gòu),它通過監(jiān)管食品、藥品、醫(yī)療器械、化妝品等來執(zhí)行這一職責(zé)����。當(dāng)這些產(chǎn)品存在潛在的安全問題或不符合法規(guī)標(biāo)準(zhǔn)時(shí),F(xiàn)DA可以采取召回措施來保護(hù)消費(fèi)者����。
FDA根據(jù)對人體可能造成的傷害程度�����,將醫(yī)療器械召回分為三個(gè)等級:
I級召回:這是最嚴(yán)重的召回類型,用于那些可能會導(dǎo)致嚴(yán)重健康問題或死亡的情況��。
II級召回:用于那些可能導(dǎo)致暫時(shí)性或醫(yī)療上可逆的健康問題�,或者在嚴(yán)重性方面存在遠(yuǎn)程可能性的情況。
III級召回:用于那些不太可能對健康造成不良影響的產(chǎn)品。
事實(shí)上,大部分召回是廠商自愿進(jìn)行的�。廠商需要提供召回的原因、受影響產(chǎn)品的詳細(xì)信息�����、召回措施的具體步驟以及為防止再次發(fā)生問題而采取的糾正措施����。FDA會監(jiān)督召回過程����,確保公眾得到適當(dāng)?shù)谋Wo(hù),并在必要時(shí)提供有關(guān)召回的信息和指導(dǎo)。
召回的完整流程通常包括以下幾個(gè)步驟:
問題識別:廠商或FDA通過質(zhì)量控制檢測、消費(fèi)者報(bào)告����、醫(yī)療事件報(bào)告等途徑發(fā)現(xiàn)產(chǎn)品存在潛在的安全問題或不符合法規(guī)標(biāo)準(zhǔn)����。
風(fēng)險(xiǎn)評估:廠商需要對發(fā)現(xiàn)的問題進(jìn)行評估��,確定召回的必要性和緊迫性�����。這包括評估產(chǎn)品缺陷對公眾健康的潛在風(fēng)險(xiǎn)。
通知FDA:一旦決定進(jìn)行召回����,廠商必須立即通知FDA���,并提供召回計(jì)劃�����。這個(gè)計(jì)劃應(yīng)該包括召回的原因�����、受影響產(chǎn)品的詳細(xì)信息、召回的范圍����、召回執(zhí)行的具體步驟以及預(yù)期的時(shí)間表��。
公共通知:廠商通常需要發(fā)布公告�����,通知分銷商��、零售商和消費(fèi)者召回的信息�。這可以通過發(fā)送信件��、發(fā)布網(wǎng)站公告或使用媒體發(fā)布等方式進(jìn)行。
產(chǎn)品回收和糾正措施:廠商需要收回受影響的產(chǎn)品��,并根據(jù)情況采取適當(dāng)?shù)募m正措施��,例如修復(fù)����、替換或退款��。
狀態(tài)報(bào)告:在召回過程中,廠商需要定期向FDA報(bào)告召回的進(jìn)展情況��,包括已收回產(chǎn)品的數(shù)量和采取的糾正措施���。
召回終止:當(dāng)FDA認(rèn)為召回行動(dòng)已經(jīng)成功移除市場上的所有受影響產(chǎn)品��,并且不再存在對公眾健康的風(fēng)險(xiǎn)時(shí),召回可以被終止���。
后續(xù)行動(dòng):廠商可能需要采取額外的措施,例如改進(jìn)生產(chǎn)流程��、加強(qiáng)質(zhì)量控制或重新設(shè)計(jì)產(chǎn)品����,以防止未來發(fā)生類似的問題����。
完整的說����,F(xiàn)DA召回分為主動(dòng)(自愿)和被動(dòng)(強(qiáng)制)兩類���。
主動(dòng)召回(自愿召回):這是最常見的召回類型�,通常由生產(chǎn)廠商自行發(fā)起�。廠商可能因?yàn)榘l(fā)現(xiàn)產(chǎn)品存在缺陷��、不符合FDA標(biāo)準(zhǔn)或可能對消費(fèi)者健康構(gòu)成風(fēng)險(xiǎn)而決定自愿召回產(chǎn)品。主動(dòng)召回需要廠商通知FDA��,并按照FDA的要求執(zhí)行召回計(jì)劃�����。這種召回方式旨在迅速從市場上移除或糾正有問題的產(chǎn)品�����,以保護(hù)公眾健康����。
被動(dòng)召回(強(qiáng)制召回):在極少數(shù)情況下�����,如果生產(chǎn)廠商未能自愿召回存在健康風(fēng)險(xiǎn)的產(chǎn)品����,F(xiàn)DA可以發(fā)出召回令,強(qiáng)制廠商召回產(chǎn)品����。這通常發(fā)生在產(chǎn)品被確定對人類健康構(gòu)成嚴(yán)重且緊迫的風(fēng)險(xiǎn)時(shí)�����。根據(jù)21 CFR 810,F(xiàn)DA擁有在必要時(shí)強(qiáng)制召回醫(yī)療設(shè)備的權(quán)力。強(qiáng)制召回通常是在與廠商協(xié)商后�����,且認(rèn)為產(chǎn)品有可能導(dǎo)致嚴(yán)重的不良健康后果或死亡時(shí)發(fā)起�����。
在實(shí)際操作中�,F(xiàn)DA通常鼓勵(lì)并傾向于與廠商合作�����,實(shí)施主動(dòng)召回。只有在極少數(shù)情況下���,當(dāng)自愿召回?zé)o法實(shí)施或廠商未能采取適當(dāng)行動(dòng)時(shí),F(xiàn)DA才會使用其強(qiáng)制召回的權(quán)力����。
那么���,廠商有可能隱瞞需要召回產(chǎn)品的事實(shí)么?
在某些情況下,廠商可能會試圖隱瞞問題以避免召回���,但這是非法的,并且會導(dǎo)致嚴(yán)重的法律后果��。FDA有一系列監(jiān)督和執(zhí)法工具����,包括檢查、警告信和法律行動(dòng)�,以確保廠商遵守規(guī)定并采取適當(dāng)?shù)募m正措施�。如果公眾或醫(yī)療衛(wèi)生專業(yè)人員發(fā)現(xiàn)產(chǎn)品存在問題��,他們也可以向FDA報(bào)告�����,這有助于FDA及時(shí)了解和處理潛在的安全問題���。
2023年召回整體情況分析
相對于2022年的60個(gè)召回通告����,2023年的61個(gè)基本持平。
從產(chǎn)品類型看來��,包括:
設(shè)備類:體外循環(huán)泵、血液透析導(dǎo)管�、輸液系統(tǒng)����、核磁影像系統(tǒng)、呼吸機(jī)�、閉式吸引系統(tǒng)���、血糖監(jiān)測系統(tǒng)��、外周導(dǎo)管、電切軟墊�����、人工心臟�����、可穿戴智能體溫計(jì)、輸液泵����、呼吸機(jī)套件����、SARS-CoV-2檢測試劑盒����、植入式心臟除顫器、心臟導(dǎo)管���、脈搏血氧監(jiān)測傳感器、人工腎臟��、高流量灌氣裝置�����、中心靜脈導(dǎo)管����、喉鏡���、搏動(dòng)泵輔助裝置�����、一氧化氮輸送系統(tǒng)�����、植入式脈沖發(fā)生器��、生理鹽水��、手術(shù)機(jī)器人、心血管輔助系統(tǒng)���、手術(shù)導(dǎo)航系統(tǒng)、支氣管顯微鏡和支氣管視頻鏡����、磁共振系統(tǒng)等��。
檢測試劑:包括SARS-CoV-2抗原快速檢測試劑等����。
其他:包括緊急皮膚脫污液套件等��。
從召回原因看來,也是多種多樣:
設(shè)備故障:包括軟件故障����、控制器故障、樞紐缺陷��、管道梗阻�����、球螺桿故障、硅泡沫分離��、Manifold開裂�����、非正確使用和非適配器問題����、排液管泄漏�����、電容器泄漏����、電源管理PCBA不符合標(biāo)準(zhǔn)等�����。
安全風(fēng)險(xiǎn):包括包裝泄漏導(dǎo)致效力降低���、可能致嚴(yán)重傷害/死亡��、未經(jīng)FDA授權(quán)�、可能存在準(zhǔn)確性問題��、使用可能導(dǎo)致健康風(fēng)險(xiǎn)�、過熱、火花或火災(zāi)風(fēng)險(xiǎn)�����、分配錯(cuò)誤或重復(fù)序列號�����、制造缺陷導(dǎo)致提前關(guān)機(jī)���、膠合連接制造錯(cuò)誤、液體溶液可能被細(xì)菌污染����、過熱和化學(xué)物質(zhì)泄漏引起皮膚刺激、灼傷�����、導(dǎo)管可能分離或泄漏��、使用時(shí)可能導(dǎo)致兒科和成人患者燒傷、因電池耗盡可能導(dǎo)致停止通氣�����、歧管止回閥錯(cuò)位可能導(dǎo)致失效�、troponin水平顯示不準(zhǔn)確���、SCP功能不當(dāng)激活����、使用該設(shè)備進(jìn)行程序可能增加患者引入空氣泡(空氣栓塞)的風(fēng)險(xiǎn)��、使用說明書未充分說明預(yù)防措施�����、可能在心臟除顫時(shí)降低發(fā)送到心臟的能量�、升級后虛假警報(bào)可能導(dǎo)致治療中斷�����、因環(huán)境污染導(dǎo)致空氣通道阻塞、因空氣通道污染導(dǎo)致兒科患者潛在致癌物質(zhì)接觸�����、與推車對接錯(cuò)誤���、氣囊受損、過熱時(shí)設(shè)備停止治療����、PCBA通信故障����、無法正確打開可能導(dǎo)致通風(fēng)中斷�、患者可能無法退出MRI模式���、存在流回或漏出問題等。
從召回級別看來����,多數(shù)屬于FDA最高級別的I類召回。
從召回時(shí)間周期看來��,2023年11月和12月是召回事件高發(fā)月份�����,涉及了多家公司的產(chǎn)品���。 多個(gè)召回事件在同一時(shí)期發(fā)生可能指向某一制造或監(jiān)管方面的共性問題�����。
2023年召回全部產(chǎn)品回顧
以下為2023年度FDA的召回產(chǎn)品和召回原因(基本按公告更新時(shí)間排序):
1 Emergent
產(chǎn)品類型:緊急皮膚脫污液(RSDL)套件
召回產(chǎn)品名稱:Emergent RSDL (Reactive Skin Decontamination Lotion) Kits
召回原因:包裝泄漏導(dǎo)致效力降低���,可能致嚴(yán)重傷害/死亡�����。
2 理諾琺(TandemLife)
產(chǎn)品類型:體外循環(huán)泵
召回產(chǎn)品名稱:LifeSPARC Controller, Model LS-1000
召回原因:控制器軟件故障����,可能導(dǎo)致關(guān)鍵故障���,無法靜音的警報(bào)。
3 美敦力
產(chǎn)品類型:血液透析導(dǎo)管
召回產(chǎn)品名稱:Mahurkar Acute Dual Lumen High Flow (13.5 French) Hemodialysis Catheters (Mahurkar QPlus)
召回原因:導(dǎo)管存在樞紐缺陷����,可能導(dǎo)致泄漏���、血液混合,影響透析效果�����,甚至引發(fā)出血或需手術(shù)更換�����。
4 史密斯醫(yī)療
產(chǎn)品類型:輸液系統(tǒng)
召回產(chǎn)品名稱:CADD infusion system Administration Sets and Cassette Reservoirs
召回原因:管道梗阻導(dǎo)致輸液不足,虛假NDA警報(bào)阻止泵使用����,可能導(dǎo)致患者傷害或死亡。
5 Universal Meditech Inc.
產(chǎn)品類型:SARS-CoV-2抗原快速檢測試劑
召回產(chǎn)品名稱:Skippack Medical Lab SARS-CoV-2 Antigen Rapid Test (Colloidal Gold)
召回原因:未經(jīng)FDA授權(quán)����,可能存在準(zhǔn)確性問題�����,使用可能導(dǎo)致健康風(fēng)險(xiǎn)��。
6 GE醫(yī)療
產(chǎn)品類型:核磁影像系統(tǒng)
召回產(chǎn)品名稱:Nuclear Medicine 600/800 Series systems
召回原因:球螺桿故障和缺少安全鍵可能導(dǎo)致探測器墜落,潛在傷害或死亡����。
7 飛利浦偉康
產(chǎn)品類型:呼吸機(jī)
召回產(chǎn)品名稱:Trilogy 100, Trilogy 200, and Garbin Plus ventilators
召回原因:硅泡沫分離可能導(dǎo)致氣道阻塞�����,呼吸困難�����,潛在危及生命;PE-PUR泡沫殘留可能導(dǎo)致健康風(fēng)險(xiǎn)。
8 Avanos Medical Inc.
產(chǎn)品類型:閉式吸引系統(tǒng)
召回產(chǎn)品名稱:BALLARD ACCESS Closed Suction System for Neonates/Pediatrics with Y-Manifold; BALLARD ACCESS Closed Suction System for Neonates/Pediatrics with Elbow Manifold
召回原因:Manifold開裂可能導(dǎo)致通氣不足���,對兒童和新生兒的患者構(gòu)成嚴(yán)重風(fēng)險(xiǎn)。
9 雅培
產(chǎn)品類型:血糖監(jiān)測系統(tǒng)
召回產(chǎn)品名稱:FreeStyle Libre Flash Glucose Monitoring System��、FreeStyle Libre 14 day Flash Glucose Monitoring System���、FreeStyle Libre 2 Flash Glucose Monitoring System
召回原因:非正確使用和非Abbott適配器可能導(dǎo)致過熱、火花或火災(zāi)�,存在嚴(yán)重傷害或死亡風(fēng)險(xiǎn)。
10 飛利浦偉康
產(chǎn)品類型:睡眠呼吸機(jī)
召回產(chǎn)品名稱:Philips Respironics DreamStation1 (Uno Remediated Devices)
召回原因:部分設(shè)備分配錯(cuò)誤或重復(fù)序列號����,可能導(dǎo)致錯(cuò)誤治療或治療失敗����,存在健康危險(xiǎn)��。
11 費(fèi)森尤斯卡比
產(chǎn)品類型:輸液泵
召回產(chǎn)品名稱:Ivenix Infusion System
召回原因:泄漏可能導(dǎo)致電氣系統(tǒng)故障��,治療中斷�����,患者可能受到嚴(yán)重傷害或死亡�。
12 愛希優(yōu)醫(yī)療
產(chǎn)品類型:輸液系統(tǒng)電池
召回產(chǎn)品名稱:Replacement Batteries for Plum 360, Plum A+, and Plum A+3 Infusion Systems
召回原因:制造缺陷導(dǎo)致提前關(guān)機(jī),可能危及患者生命����。
13 德爾格醫(yī)療
產(chǎn)品類型:呼吸機(jī)套件
召回產(chǎn)品名稱:Seattle PAP Plus, VentStar系列產(chǎn)品, Anesthesia Circuit Kit Coax系列產(chǎn)品及其他呼吸/麻醉套件
召回原因:膠合連接制造錯(cuò)誤可能導(dǎo)致呼吸回路中斷,可能危及患者生命�。
14 SD Biosensor, Inc.
產(chǎn)品類型:SARS-CoV-2檢測試劑盒
召回產(chǎn)品名稱:Pilot COVID-19 At-Home Tests
召回原因:液體溶液可能被細(xì)菌污染����,可能導(dǎo)致感染、測試性能問題和錯(cuò)誤結(jié)果�����。
15 強(qiáng)生 阿比奧梅徳
產(chǎn)品類型:人工心臟
召回產(chǎn)品名稱:Impella 5.5 with SmartAssist
召回原因:排液管泄漏可能導(dǎo)致治療中斷,危及患者生命����。
16 BearCare, Inc.
產(chǎn)品類型:可穿戴智能體溫計(jì)
召回產(chǎn)品名稱:Walnut Wearable Smart Thermometer
召回原因:過熱和化學(xué)物質(zhì)泄漏引起皮膚刺激、灼傷���,可能導(dǎo)致嚴(yán)重傷害或死亡。
17 泰利福����,及其子公司Arrow International
產(chǎn)品類型:外周導(dǎo)管
召回產(chǎn)品名稱:ARROW Endurance Extended Dwell Peripheral Catheter System
召回原因:導(dǎo)管可能分離或泄漏����,可能導(dǎo)致嚴(yán)重傷害���,包括血管阻塞����、血流不足�、血栓形成�、心血管事件或死亡。
18 強(qiáng)生Megadyne
產(chǎn)品類型:電切軟墊
召回產(chǎn)品名稱:MEGADYNE MEGA 2000系列產(chǎn)品與MEGADYNE MEGA SOFT系列產(chǎn)品
召回原因:使用時(shí)可能導(dǎo)致兒科和成人患者燒傷�����。
19 德爾格醫(yī)療
產(chǎn)品類型:呼吸機(jī)
召回產(chǎn)品名稱:Oxylog 3000 Plus Emergency and Transport Ventilator
召回原因:因電池耗盡可能導(dǎo)致停止通氣����,存在嚴(yán)重傷害或死亡的風(fēng)險(xiǎn)�����。
20 NOxBOX Ltd.
產(chǎn)品類型:一氧化氮輸送系統(tǒng)
召回產(chǎn)品名稱:NOxBOXi Nitric Oxide Delivery System
召回原因:歧管止回閥錯(cuò)位可能導(dǎo)致失效�����,可能造成氣體泄漏和治療中斷,對患有先天性心臟病的患者構(gòu)成嚴(yán)重風(fēng)險(xiǎn)����,可能導(dǎo)致嚴(yán)重傷害或死亡�。
21 Quidel Cardiovascular Inc. (QuidelOrtho)
產(chǎn)品類型:心肌損傷測試板
召回產(chǎn)品名稱:Quidel Triage Cardiac Panel系列產(chǎn)品
召回原因:因troponin水平顯示不準(zhǔn)確�����,可能導(dǎo)致對心肌梗死的漏診,對患者構(gòu)成嚴(yán)重風(fēng)險(xiǎn)���,可能導(dǎo)致嚴(yán)重傷害或死亡。
22 美敦力
產(chǎn)品類型:可植入心臟除顫器(ICDs)和心臟再同步治療除顫器(CRT-Ds)
召回產(chǎn)品名稱:Cobalt XT, Cobalt, Crome ICDs and CRT-Ds���;Claria MRI, Amplia MRI, Compia MRI, Viva, Brava CRT-Ds;Visia AF, Visia AF MRI, Evera, Evera MRI, Primo MRI, Mirro MRI ICDs
召回原因:SCP功能不當(dāng)激活可能導(dǎo)致低能量輸出或無能量輸出��,可能無法有效治療心律失常���,危及生命����。
23 雅培
產(chǎn)品類型:心臟導(dǎo)管
召回產(chǎn)品名稱:Amplatzer Steerable Delivery Sheath
召回原因:使用該設(shè)備進(jìn)行程序可能增加患者引入空氣泡(空氣栓塞)的風(fēng)險(xiǎn)����。
24 強(qiáng)生阿比奧梅德
產(chǎn)品類型:人工心臟
召回產(chǎn)品名稱:Impella系列產(chǎn)品
召回原因:使用說明書未充分說明在治療已接受經(jīng)皮主動(dòng)脈瓣置換(TAVR)的患者時(shí)應(yīng)采取的預(yù)防措施�����;Impella電機(jī)外殼可能與TAVR的支架發(fā)生接觸,可能損壞或摧毀電機(jī)的葉輪�。
25 GE醫(yī)療
產(chǎn)品類型:脈搏血氧監(jiān)測傳感器
召回產(chǎn)品名稱:TruSignal 系列產(chǎn)品
召回原因:可能在心臟除顫時(shí)降低發(fā)送到心臟的能量����;受影響的傳感器還可能使患者暴露于其他電流來源���,或者可能提供不準(zhǔn)確的SpO2測量結(jié)果��。
26 百特醫(yī)療
產(chǎn)品類型:輸液泵
召回產(chǎn)品名稱:SIGMA Spectrum Infusion Pump with Master Drug Library (Version 8) and Spectrum IQ Infusion System with Dose IQ Safety Software (Version 9)
召回原因:升級后虛假警報(bào)可能導(dǎo)致治療中斷���,威脅患者安全����。
27 飛利浦偉康
產(chǎn)品類型:呼吸機(jī)
召回產(chǎn)品名稱:Trilogy系列產(chǎn)品
召回原因:因環(huán)境污染導(dǎo)致空氣通道阻塞��,可能導(dǎo)致患者無法獲得足夠氧氣,引發(fā)嚴(yán)重健康問題����。
28 德爾格醫(yī)療
產(chǎn)品類型:呼吸機(jī)
召回產(chǎn)品名稱:Carina Sub-Acute Care Ventilator
召回原因:因空氣通道污染導(dǎo)致兒科患者潛在致癌物質(zhì)接觸,可能導(dǎo)致嚴(yán)重健康問題�����。
29 潔定/Maquet/Datascope
產(chǎn)品類型:搏動(dòng)泵輔助裝置
召回產(chǎn)品名稱:Cardiosave Hybrid Intra-Aortic Balloon Pump (IABP);Cardiosave Rescue Intra-Aortic Balloon Pump (IABP)
召回原因:與推車對接錯(cuò)誤;氣囊受損��,可能導(dǎo)致泵關(guān)機(jī)����、氦氣釋放��、患者失血�����、生物危害�����;因Autofill故障警報(bào)����;過熱時(shí)����,設(shè)備停止治療���;可能因PCBA失效導(dǎo)致電力管理問題;PCBA通信故障����;部分單位的連接顯示和底座的卷纜可能失敗
30 Mallinckrodt Manufacturing, LLC
產(chǎn)品類型:一氧化氮輸送系統(tǒng)
召回產(chǎn)品名稱:One-Way Valve, 22F x 22M
召回原因:無法正確打開�����,可能導(dǎo)致通風(fēng)中斷
31 雅培
產(chǎn)品類型:植入式脈沖發(fā)生器
召回產(chǎn)品名稱:Proclaim系列產(chǎn)品
召回原因:患者可能無法退出MRI模式��,需要Clinician Programmer進(jìn)行初始編程�����,可能導(dǎo)致治療中斷����。
32 麥朗醫(yī)療
產(chǎn)品類型:生理鹽水
召回產(chǎn)品名稱:Hudson RCI Addipak Unit Dose Vial, 0.9% Full Normal Saline Solution
召回原因:非無菌。使用可能導(dǎo)致呼吸問題�����、感染及危及生命的后果。
33 哈美頓醫(yī)療
產(chǎn)品類型:呼吸機(jī)
召回產(chǎn)品名稱:Hamilton C1/T1/MR-1 Ventilators
召回原因:電容器泄漏電解液�����,可能導(dǎo)致呼吸機(jī)切換到"Ambient State"�;因軟件問題可能導(dǎo)致設(shè)備停止工作,潛在造成嚴(yán)重后果或死亡���。
34 飛利浦偉康
產(chǎn)品類型:呼吸機(jī)
召回產(chǎn)品名稱:Philips Respironics V60 Ventilators and V60 Plus Ventilators
召回原因:電源管理PCBA不符合標(biāo)準(zhǔn)����,使用可能導(dǎo)致電源故障和嚴(yán)重健康風(fēng)險(xiǎn)��。
35 費(fèi)森尤斯醫(yī)療
產(chǎn)品類型:人工腎臟
召回產(chǎn)品名稱:2008 Series Hemodialysis Machines
召回原因:可能滲漏多氯聯(lián)苯酸����,長期使用可能導(dǎo)致內(nèi)分泌、神經(jīng)和皮膚問題�����。
36 奧林巴斯
產(chǎn)品類型:高流量灌氣裝置
召回產(chǎn)品名稱:Olympus High Flow Insufflation Unit
召回原因:可能導(dǎo)致過度充氣���,引發(fā)氣體栓塞���、心律失常等嚴(yán)重健康問題����。
37 泰利福和其子公司Arrow International
產(chǎn)品類型:中心靜脈導(dǎo)管
召回產(chǎn)品名稱:Pressure Injectable Central Venous Catheters
召回原因:因標(biāo)簽錯(cuò)誤涉及氯己定,可能導(dǎo)致過敏反應(yīng)�,甚至死亡��。
38 美敦力柯惠
產(chǎn)品類型:喉鏡
召回產(chǎn)品名稱:McGRATH™ MAC Video Laryngoscopes
召回原因:防止缺陷被盜設(shè)備流入市場�����,以避免可能導(dǎo)致呼吸支持不足和死亡的風(fēng)險(xiǎn)��。
39 嘉德諾
產(chǎn)品類型:一次性注射器
召回產(chǎn)品名稱:Cardinal Health Monoject系列產(chǎn)品
召回原因:防止與注射泵一起使用可能導(dǎo)致性能問題。
40 百特醫(yī)療
產(chǎn)品類型:輸液泵
召回產(chǎn)品名稱:Novum IQ Syringe Pump
召回原因:由于軟件錯(cuò)誤導(dǎo)致阻塞后錯(cuò)誤指示輸液已完成�。
41 費(fèi)森尤斯醫(yī)療
產(chǎn)品類型:血液透析注射裝置
召回產(chǎn)品名稱:Sanxin Single Use Sterile Syringes
召回原因:存在流回或漏出問題����,可能導(dǎo)致血流感染���、失血、肝素錯(cuò)誤劑量等嚴(yán)重健康風(fēng)險(xiǎn)�。
42 Asensus Surgical Inc.
產(chǎn)品類型:手術(shù)機(jī)器人
召回產(chǎn)品名稱:Asensus Senhance Surgical System
召回原因:因設(shè)備故障導(dǎo)致輔助手術(shù)設(shè)備意外移動(dòng)。
43 貝朗醫(yī)療
產(chǎn)品類型:輸液泵
召回產(chǎn)品名稱:Infusomat Space Large Volume Pump, Wireless��;Infusomat Space Large Volume Pump, Non-Wireless BATTERY PACK
召回原因:因故障阻塞警報(bào)�����,可能導(dǎo)致高風(fēng)險(xiǎn)藥物輸送中斷
44 優(yōu)諾醫(yī)療
產(chǎn)品類型:輸液套裝
召回產(chǎn)品名稱:VariSoft Infusion Sets
召回原因:因連接器脫落風(fēng)險(xiǎn)�,可能導(dǎo)致胰島素輸送中斷��。
45 Eitan Medical Ltd
產(chǎn)品類型:輸液泵
召回產(chǎn)品名稱:Eitan Medical Ltd Sapphire Infusion Pumps running software version Rev 16.10
召回原因:軟件版本Rev 16.10問題召回,可能導(dǎo)致未檢測到管道中的空氣��,引發(fā)血管阻塞及不良健康事件��。
46 BD醫(yī)療/Carefusion 303
產(chǎn)品類型:輸液泵
召回產(chǎn)品名稱:BD Alaris Syringe Module, BD Alaris PCU,和 Alaris PCA Module
召回原因:與Cardinal Health Monoject注射器存在兼容性問題�����。此問題可能導(dǎo)致泵操作錯(cuò)誤�����,輸液不準(zhǔn)確�����,延遲管堵警報(bào)等潛在問題����。
47 康蒂思
產(chǎn)品類型:血管造影導(dǎo)管
召回產(chǎn)品名稱:Cordis INFINITI Angiographic Catheter
召回原因:未經(jīng)適當(dāng)滅菌的情況下,可能導(dǎo)致感染�����、敗血癥和死亡。
48 潔定
產(chǎn)品類型:心血管輔助系統(tǒng)
召回產(chǎn)品名稱:CARDIOHELP Emergency Drive
召回原因:可能卡住或操作困難而召回�����。使用時(shí)可能導(dǎo)致患者失去足夠支持,包括缺血��、缺氧、中風(fēng)或死亡��。
49 美敦力導(dǎo)航
產(chǎn)品類型:手術(shù)導(dǎo)航系統(tǒng)
召回產(chǎn)品名稱:StealthStation S8 Application Version 2.0和2.0.1
召回原因:可能導(dǎo)致手術(shù)計(jì)劃數(shù)據(jù)位置偏移�,不在手術(shù)區(qū)域。
50 奧林巴斯美國
產(chǎn)品類型:纖維支氣管鏡和視頻支氣管鏡
召回產(chǎn)品名稱:奧林巴斯纖維支氣管鏡和視頻支氣管視頻鏡
召回原因:存在燒傷或起火風(fēng),可能導(dǎo)致燒傷�����、呼吸困難�、甚至死亡���。
51 飛利浦北美
產(chǎn)品類型:磁共振系統(tǒng)
召回產(chǎn)品名稱:Panorama 1.0T HFO
召回原因:因氦氣過量壓力建立在quench過程中可能導(dǎo)致爆炸���。
如何減少召回可能性�、提升產(chǎn)品質(zhì)量和安全���?
這個(gè)話題太大�,區(qū)區(qū)幾百字說不清楚;不同企業(yè)和產(chǎn)品也各有各的挑戰(zhàn)��,這里只是簡單列列����。
但質(zhì)量����,真的很重要很重要��。有的醫(yī)療器械企業(yè)為了拿證快����,可能會放棄或忽略過程。而質(zhì)量體系和過程�,是輸出一個(gè)更優(yōu)產(chǎn)品必備的;也都是年年月月的血的教訓(xùn)總結(jié)出來的����,更是基業(yè)長青的基石���。
設(shè)計(jì)階段的策略:
采用系統(tǒng)工程方法:在設(shè)計(jì)階段�,采用系統(tǒng)工程方法可以幫助識別和管理復(fù)雜的系統(tǒng)需求和相互依賴性���。例如����,使用質(zhì)量功能展開(QFD)可以幫助將顧客需求轉(zhuǎn)化為具體的設(shè)計(jì)要求�����。
實(shí)施嚴(yán)格的設(shè)計(jì)控制:根據(jù)質(zhì)量系統(tǒng)法規(guī),實(shí)施嚴(yán)格的設(shè)計(jì)控制流程��,包括設(shè)計(jì)輸入�、輸出����、驗(yàn)證和確認(rèn)等步驟�����。例如,設(shè)計(jì)輸入應(yīng)該明確地描述產(chǎn)品的預(yù)期用途和性能要求���。
進(jìn)行風(fēng)險(xiǎn)管理:使用質(zhì)量標(biāo)準(zhǔn)進(jìn)行風(fēng)險(xiǎn)管理��,識別�、評估和控制設(shè)計(jì)階段的風(fēng)險(xiǎn)����。例如����,通過故障模式和影響分析(FMEA)可以識別潛在的故障模式和它們對產(chǎn)品性能的影響�����。
生產(chǎn)過程中的策略:
加強(qiáng)過程控制:采用統(tǒng)計(jì)過程控制(SPC)和過程能力分析(CPK)等方法,監(jiān)控和控制生產(chǎn)過程中的關(guān)鍵參數(shù)�����。例如�,通過實(shí)時(shí)監(jiān)控注塑成型過程的溫度和壓力�����,確保零件的一致性和質(zhì)量。
實(shí)施定期設(shè)備維護(hù):制定和執(zhí)行設(shè)備維護(hù)計(jì)劃�����,以防止設(shè)備故障導(dǎo)致的生產(chǎn)問題����。例如����,定期校準(zhǔn)測量儀器�,確保測量的準(zhǔn)確性。
強(qiáng)化員工培訓(xùn):對生產(chǎn)線員工進(jìn)行定期培訓(xùn)�,確保他們了解操作標(biāo)準(zhǔn)和質(zhì)量要求�����。例如��,對操作注塑機(jī)的員工進(jìn)行特定的技能培訓(xùn)�����,以提高生產(chǎn)效率和質(zhì)量�。
臨床前測試和后市場監(jiān)測:
進(jìn)行臨床前測試:在產(chǎn)品上市前�����,進(jìn)行嚴(yán)格的臨床前測試,包括生物相容性測試�、電氣安全測試和機(jī)械強(qiáng)度測試等��。例如����,對植入式心臟起搏器進(jìn)行電氣安全測試,確保其在人體內(nèi)的安全性能�����。
實(shí)施后市場監(jiān)測:通過積極的后市場監(jiān)測計(jì)劃�,收集和分析產(chǎn)品在市場上的性能數(shù)據(jù)���。例如�,通過醫(yī)療器械報(bào)告(MDR)系統(tǒng)收集關(guān)于產(chǎn)品不良事件的報(bào)告����,并采取相應(yīng)的糾正措施�。
在醫(yī)療器械企業(yè)運(yùn)營過程中����,力爭做到持續(xù)改進(jìn)��。
建立質(zhì)量管理體系:根據(jù)國際標(biāo)準(zhǔn),如ISO 13485建立和維護(hù)一個(gè)全面的質(zhì)量管理體系(QMS)���。這包括制定質(zhì)量政策�����、目標(biāo)�����、程序和記錄����,以及定期審查和更新這些元素以反映持續(xù)改進(jìn)的成果��。
采用精益生產(chǎn)方法:實(shí)施精益生產(chǎn)方法��,如5S(整理��、整頓���、清掃�����、清潔���、素養(yǎng))、持續(xù)流動(dòng)�����、拉動(dòng)生產(chǎn)和價(jià)值流分析����,以消除浪費(fèi)��、提高效率和增強(qiáng)產(chǎn)品質(zhì)量。
實(shí)施六西格瑪方法:采用六西格瑪方法來識別和消除缺陷���,通過DMAIC(定義����、測量����、分析、改進(jìn)���、控制)過程系統(tǒng)地改進(jìn)過程和產(chǎn)品性能��。
鼓勵(lì)員工參與:鼓勵(lì)員工參與改進(jìn)活動(dòng),如質(zhì)量圈和建議計(jì)劃�,以利用他們的知識和經(jīng)驗(yàn)來識別改進(jìn)機(jī)會�����。
進(jìn)行根本原因分析:當(dāng)發(fā)生問題時(shí),進(jìn)行根本原因分析(RCA)以確定問題的真正原因��,并采取糾正和預(yù)防措施以防止問題再次發(fā)生。
實(shí)施變更管理:對任何影響產(chǎn)品質(zhì)量的變更實(shí)施嚴(yán)格的變更管理程序��,確保變更得到適當(dāng)評估�、批準(zhǔn)和記錄�����,并且所有相關(guān)人員都得到通知和培訓(xùn)。
定期進(jìn)行內(nèi)部和外部審核:定期進(jìn)行內(nèi)部審核以評估QMS的有效性��,并采取必要的糾正措施�����。同時(shí),接受外部審核����,如監(jiān)管機(jī)構(gòu)的檢查和第三方認(rèn)證機(jī)構(gòu)的審核�����,以獲得客觀的反饋和驗(yàn)證�����。
利用技術(shù)和數(shù)據(jù)分析:利用先進(jìn)技術(shù)和數(shù)據(jù)分析工具來監(jiān)控過程和產(chǎn)品性能,識別趨勢和異常�����,以及支持?jǐn)?shù)據(jù)驅(qū)動(dòng)的決策�����。
展望
今天寫的召回話題有點(diǎn)沉重����。
但“敗局”,也意味著新的希望��。
在探索醫(yī)療器械安全性的旅程中���,廠商不僅面臨挑戰(zhàn)��,也擁有無限的機(jī)遇。每一次的召回事件�����,每一個(gè)改進(jìn)的步驟���,都是邁向更加安全、更加健康未來的堅(jiān)實(shí)腳印。
這不是一條孤獨(dú)的道路�����。
因?yàn)槊恳晃谎邪l(fā)和生產(chǎn)人員的努力,每一位監(jiān)管機(jī)構(gòu)的嚴(yán)格把關(guān)���,以及每一位消費(fèi)者的關(guān)注和反饋����,都在為這個(gè)目標(biāo)添磚加瓦��。(也因?yàn)檎倩氐膹S商很多……別人家的召回也是自己的市場機(jī)會……)
請以積極的心態(tài)�����,迎接每一個(gè)改進(jìn)的機(jī)會�����。當(dāng)前不懈的努力和持續(xù)的創(chuàng)新��,是為新一代打造出更加安全、更加可靠的醫(yī)療器械�,為當(dāng)前和未來的全人類的健康和福祉貢獻(xiàn)自己的力量!