今日頭條
安徽海森引進(jìn)長效PCSK9i報(bào)IND����。海森生物與LIB Therapeutics聯(lián)合開發(fā)的1類生物藥lerodalcibep的臨床試驗(yàn)申請獲CDE受理���。lerodalcibep是一款第三代長效PCSK9抑制劑�,海森生物擁有該新藥在大中華區(qū)的開發(fā)和商業(yè)化獨(dú)家專有權(quán)����。去年年底����,LIB公司宣布已完成Lerodalcibep(LIB003)用于降低心血管疾病(CVD)患者或無CVD但CVD風(fēng)險(xiǎn)極高患者低密度脂蛋白膽固醇(LDL-C) 的兩項(xiàng)III期試驗(yàn)(LIBerate-CVD和LIBerate-HR),預(yù)計(jì)今年上半年向FDA和歐盟EMA提交上市申請����。
國內(nèi)藥訊
1.替雷利珠單抗三項(xiàng)適應(yīng)癥獲支持上市���。歐洲藥品管理局(EMA)人用藥品委員會(CHMP)推薦批準(zhǔn)百濟(jì)神州PD-1抑制劑替雷利珠單抗上市,聯(lián)合紫杉醇和卡鉑或注射用紫杉醇(白蛋白結(jié)合型)和卡鉑一線治療局部晚期或轉(zhuǎn)移性鱗狀非小細(xì)胞肺癌(NSCLC)����;聯(lián)合培美曲塞和鉑類化療用于治療PD-L1表達(dá)≥50%且無EGFR和ALK陽性突變�、局部晚期或轉(zhuǎn)移性非鱗狀NSCLC����;以及單藥用于治療含鉑藥物治療后進(jìn)展����、局部晚期或轉(zhuǎn)移性NSCLC。
2.恒瑞PARP1抑制劑啟動(dòng)卵巢癌臨床����。恒瑞醫(yī)藥自研PARP1抑制劑HRS-1167登記啟動(dòng)一項(xiàng)Ⅰb/Ⅱ期臨床,擬評估聯(lián)合貝伐珠單抗治療復(fù)發(fā)性卵巢癌的安全性與有效性�。該項(xiàng)研究由中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院吳令英博士和湖南省腫瘤醫(yī)院王靜博士共同牽頭開展����。目前,該新藥正在國內(nèi)開展兩項(xiàng)I期臨床���,分別評估單藥以及與利福平聯(lián)用治療實(shí)體瘤患者的潛力。默克擁有HRS-1167在中國大陸外的全球權(quán)利����。
3.普眾發(fā)現(xiàn)HER3靶向ADC獲批臨床����。普眾發(fā)現(xiàn)1類生物制品注射用AMT-562獲國家藥監(jiān)局臨床許可�,擬開發(fā)用于治療晚期實(shí)體瘤���。AMT-562是一款靶向HER3的新型抗體偶聯(lián)藥物(ADC),正在澳大利亞開展一項(xiàng)針對晚期實(shí)體瘤的Ⅰ期臨床研究����。在臨床前研究中,AMT-562單藥或聯(lián)合用藥�,在HER3低表達(dá)患者來源異種移植物/類器官模型(包括消化系統(tǒng)和肺腫瘤)中均顯示積極的抗腫瘤反應(yīng)�。
4.藥捷安康NLRP3抑制劑臨床前研究積極���。藥捷安康宣布其針對炎癥小體(NLRP3)抑制劑候選化合物TT-02332已啟動(dòng)臨床申報(bào)前開發(fā)(IND-Enabling Studies)���。TT-02332通過抑制NLRP3活性����,有潛力治療神經(jīng)退化性疾病(包括帕金森癥����、阿茲海默癥等)����、逆轉(zhuǎn)肥胖并降低心血管風(fēng)險(xiǎn)����。在臨床前研究中,TT-02332已在多種疾病動(dòng)物模型中顯示出了良好的藥效�,并確定明確的靶點(diǎn)結(jié)合及藥代動(dòng)力學(xué)/藥效學(xué)(PK/PD)的關(guān)聯(lián)性����。
5.和鉑與Boostimmune達(dá)成ADC開發(fā)合作�。和鉑醫(yī)藥旗下諾納生物與Boostimmune簽訂合作協(xié)議,利用諾納生物專有的Harbour Mice® H2L2抗體平臺�,合作開發(fā)針對創(chuàng)新靶點(diǎn)的抗體偶聯(lián)藥物�。Harbour Mice®平臺可生成雙重、雙輕鏈(H2L2)和僅重鏈(HCAb)形式的全人源單克隆抗體;基于HCAb抗體開發(fā)的免疫細(xì)胞銜接器(HBICE®)能夠?qū)崿F(xiàn)傳統(tǒng)藥物聯(lián)合療法無法達(dá)到的抗腫瘤療效�。
6.鯤石融資加速開發(fā)第三代CAR-M療法�。鯤石生物宣布完成Pre-A輪數(shù)千萬元人民幣融資,以用于支持其先導(dǎo)候選藥物RR-M01的IND申報(bào)����。RR-M01是一款靶向HER2第三代嵌合抗原受體巨噬細(xì)胞藥物(CAR-M)�,在原有CAR的基礎(chǔ)上串聯(lián)了巨噬細(xì)胞自體增殖活化所必需的細(xì)胞因子���,以提高CAR-M在體內(nèi)存活持久性�,并進(jìn)一步增強(qiáng)巨噬細(xì)胞的吞噬�、殺傷腫瘤及抗原遞呈能力。該新藥擬開發(fā)復(fù)發(fā)/難治性實(shí)體瘤�。
國際藥訊
1.GSK新型口服抗生素淋病III期臨床成功����。葛蘭素史克三氮雜苊烯類II型拓?fù)洚悩?gòu)酶抑制劑gepotidacin治療無并發(fā)癥泌尿生殖系統(tǒng)淋病的III期EAGLE-1研究達(dá)到了主要終點(diǎn)�。與頭孢曲松+阿奇霉素方案相比,gepotidacin治療患者3-7天后的微生物學(xué)應(yīng)答效果達(dá)到非劣效性標(biāo)準(zhǔn)�,詳細(xì)結(jié)果將在醫(yī)學(xué)會議上公布。去年4月����,該新藥治療非復(fù)雜性尿路感染(uUTI)的兩項(xiàng)關(guān)鍵III期研究(EAGLE-2和EAGLE-3)也取得了積極數(shù)據(jù)����。
2.羅氏IgE抗體Ⅲ期研究見刊NEJM。羅氏IgE抗體Xolair(omalizumab)用于減少成人和1歲以上兒童因意外暴露于一種或多種食物而引發(fā)的過敏反應(yīng)的Ⅲ期臨床OUtMATCH積極結(jié)果公布于《新英格蘭醫(yī)學(xué)雜志》上����。16-20周期間�,與安慰劑相比,Xolair治療有更多患者耐受≥600mg的花生蛋白(68%vs5%�,p<0.0001)�、耐受≥1000mg牛奶蛋白(66%vs11%;p<0.0001)���,且患者無中重度過敏癥狀;此外���,Xolair與安慰劑的不良反應(yīng)發(fā)生率相似����。
3.BI雙重激動(dòng)劑治療MASH的II期臨床成功�。勃林格殷格翰與Zealand開發(fā)的GLP-1/GCG雙重激動(dòng)劑BI 456906(Survodutide)在治療代謝功能障礙相關(guān)脂肪性肝炎(MASH)的II期臨床研究中�,達(dá)到其主要終點(diǎn)以及關(guān)鍵次要終點(diǎn)。與安慰劑相比���,survodutide治療48周后,實(shí)現(xiàn)MASH組織學(xué)改善且纖維化沒有惡化的患者比例更高(83%vs18.2%�,p<0.0001),全部數(shù)據(jù)將于學(xué)術(shù)會議上公布。目前����,多項(xiàng)III期臨床也正在評估該新藥治療超重或肥胖患者的潛力���。
4.賽諾菲BTK抑制劑蕁麻疹Ⅱ期臨床積極���。賽諾菲BTK抑制劑rilzabrutinib在治療中重度慢性自發(fā)性蕁麻疹(CSU)的Ⅱ期臨床RILECSU中達(dá)到了主要終點(diǎn)�。治療12周時(shí),與基線相比,患者每周瘙癢嚴(yán)重程度評分(ISS7)顯著降低(最小二乘平均值[LSM]分別為-9.58vs-6.31����;P=0.0181)���;每周蕁麻疹活動(dòng)評分(UAS7)顯著降低(LSM分別為-17.95vs-11.20�;p=0.0116)���;每周蕁麻疹嚴(yán)重程度評分(HSS7)評分顯著降低(LSM為-8.31vs-4.89;p<0.0100)����。此外����,臨床中未出現(xiàn)BTK抑制劑相關(guān)的血細(xì)胞減少、出血或心房顫動(dòng)事件���。
5.TScan公司TCR細(xì)胞療法早期臨床積極。TScan公司TCR-T細(xì)胞療法TSC-100和TSC-101在用于治療急性髓系白血病(AML)���、骨髓增生異常綜合征(MDS)或急性淋巴細(xì)胞白血?��。ˋLL)患者在造血干細(xì)胞移植(HCT)后消滅殘余血液癌細(xì)胞和預(yù)防疾病復(fù)發(fā)的Ⅰ期臨床試驗(yàn)中獲得了積極結(jié)果。接受TSC-100或TSC-101治療的8例患者均未復(fù)發(fā)�;其中,1例高風(fēng)險(xiǎn)TP53變異型MDS患者在接受TSC-101治療后����,無復(fù)發(fā)已超過1年����。
6.美國上市失敗導(dǎo)致AZ退回羅沙司他����。琺博進(jìn)宣布已與阿斯利康終止口服HIF-PH抑制劑羅沙司他的合作協(xié)議�,重新獲得該新藥在美國及其他地區(qū)的所有權(quán)利(除了中國和韓國)�。2018年12月,羅沙司他在中國獲得全球首批���,目前已獲批用于非透析依賴(NDD)和透析依賴(DD)的腎性貧血治療�。兩家公司就羅沙司他在中國地區(qū)的合作協(xié)議仍有效���。在美國����,基于HIF-PHI類藥物的安全性問題�,F(xiàn)DA相繼拒絕羅沙司他���、伐達(dá)度司他的上市申請���。
醫(yī)藥熱點(diǎn)
1.中國科學(xué)家研發(fā)出新一代艾滋病疫苗���。近日���,香港大學(xué)醫(yī)學(xué)院宣布���,開發(fā)的艾滋病疫苗pRhPD1-p27取得重大突破���,在無需抗病毒藥物治療的情況下,實(shí)現(xiàn)了超過6年艾滋病預(yù)防及病毒控制�。pRhPD1-p27是一類PD-1增強(qiáng)型DNA艾滋病疫苗,與傳統(tǒng)疫苗相比����,它具有更強(qiáng)的免疫原性和針對病毒感染的保護(hù)功效。動(dòng)物試驗(yàn)顯示����,接種疫苗的猴子在被高劑量艾滋病毒攻擊后���,首先出現(xiàn)了病毒血癥峰值����,隨后病毒載量下降到持續(xù)不可檢出的水平�。
2.河北醫(yī)大二院設(shè)置新院區(qū)�。2月26日,河北省衛(wèi)健委網(wǎng)站發(fā)布最新公示:經(jīng)對河北醫(yī)科大學(xué)第二醫(yī)院提交的設(shè)置申請資料進(jìn)行研究論證����,擬同意設(shè)置河北醫(yī)科大學(xué)第二醫(yī)院鹿泉院區(qū)���。該項(xiàng)目選址:石家莊市鹿泉區(qū)槐安西路501號;擬設(shè)置床位數(shù)(牙椅數(shù))為1400張(7臺)���。河北醫(yī)科大學(xué)第二醫(yī)院是一所集醫(yī)療�、教學(xué)�、科研���、預(yù)防�、保健����、康復(fù)����、急救為一體的三級甲等綜合醫(yī)院,醫(yī)院創(chuàng)建于1918年�,現(xiàn)有院本部、東院區(qū)����、北院區(qū)3個(gè)院區(qū)運(yùn)行,正定院區(qū)正在建設(shè)中����。
3.韓政府:辭職醫(yī)生29日前返崗將不追責(zé)。據(jù)韓聯(lián)社2月26日報(bào)道�,韓國行政安全部長官李祥敏26日敦促參與集體行動(dòng)的實(shí)習(xí)和住院醫(yī)生正視當(dāng)前情況的嚴(yán)重性����,呼吁他們盡早返回崗位,并承諾醫(yī)生們?nèi)绻茉诒驹?span style="color:#ff0000;">29日之前返崗����,政府將不追究責(zé)任����。李祥敏表示,政府將推出“診療支援人力示范項(xiàng)目”���,以維持醫(yī)院治病的職能,同時(shí)期待該舉措能進(jìn)一步明確護(hù)士們在一線工作中的職責(zé)范圍���,履行政府此前提出的建立護(hù)士保護(hù)體系的承諾���。
評審動(dòng)態(tài)
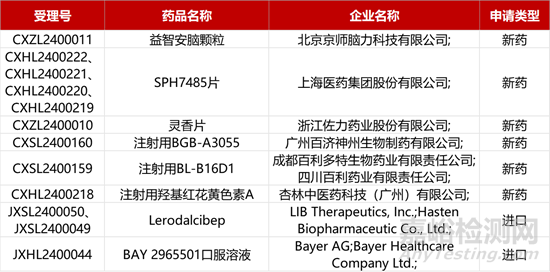
1. CDE新藥受理情況(02月27日)
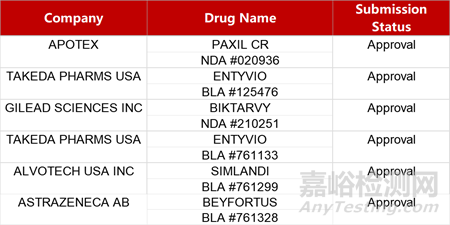
2. FDA新藥獲批情況(北美02月26日)