您是否想過(guò)如何確定涉及醫(yī)療器械的clinical investigation的監(jiān)管途徑����?
讓我們以已經(jīng)獲得 CE 認(rèn)證的器械為例���。
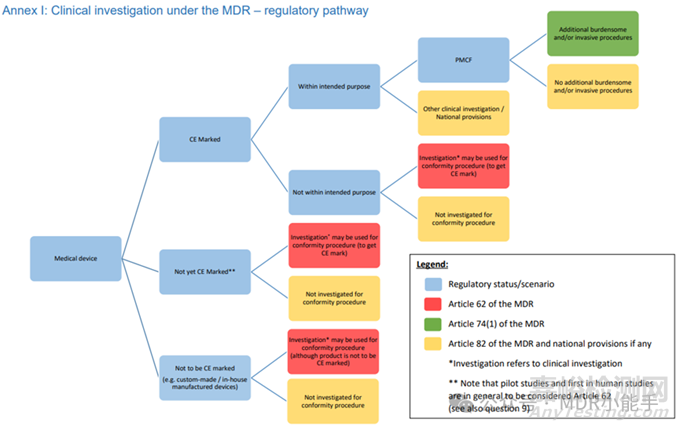
涉及CE認(rèn)證醫(yī)療器械clinical investigation的監(jiān)管途徑可能很復(fù)雜���。關(guān)鍵因素是器械的預(yù)期用途。將器械的original intended use與研究中的應(yīng)用相一致至關(guān)重要�。這種一致性是監(jiān)管要求,也是clinical investigation planning的一個(gè)戰(zhàn)略方面�����。
監(jiān)管框架的路線(xiàn)圖始于醫(yī)療器械協(xié)調(diào)小組文件 MDCG 2021-6 Rev. 1,尤其是附件 I(見(jiàn)下圖)����。
該文件中的問(wèn)題 12 尤其具有啟發(fā)性�����,它指導(dǎo)您評(píng)估與clinical investigation相關(guān)的預(yù)期用途�����。
這一點(diǎn)在上市后臨床跟蹤(PMCF)活動(dòng)中變得更加重要。
對(duì)于可能會(huì)增加侵入性或繁瑣程序的研究�����,復(fù)雜性會(huì)增加����。
MDR第 74(1)條要求在這種情況下通知相關(guān)歐盟成員國(guó)����。
確定這些程序的侵入性或繁瑣程度是一個(gè)關(guān)鍵步驟����,通常需要咨詢(xún)歐盟相關(guān)臨床機(jī)構(gòu)��。
如果您的研究不屬于第 74(1)條規(guī)定的范圍�,或者器械的使用超出了規(guī)定的用途��,那么每種情況都需要采取量身定制的監(jiān)管方法。
在這種情況下��,MDR 的具體條款和歐盟國(guó)家法規(guī)將成為您的指導(dǎo)原則。