相信負(fù)責(zé)原輔包登記申報的小伙伴們,平時遇到最多的不是新產(chǎn)品的首次登記����,而是現(xiàn)有產(chǎn)品的登記變更。導(dǎo)致登記變更的情況很多����,尤其是登記產(chǎn)品種類比較多的公司,比如隨著穩(wěn)定性數(shù)據(jù)積累到一定程度�,有效期變更的工作便可進(jìn)行;由于生產(chǎn)規(guī)模的擴(kuò)大����,需要增加車間或者轉(zhuǎn)移新廠房,相應(yīng)的變更也需要提上日程����;由于五年一次的藥典升版,相應(yīng)的藥典標(biāo)準(zhǔn)若有變化��,則對應(yīng)的輔料質(zhì)量標(biāo)準(zhǔn)也許隨之變更��,于是變更質(zhì)量標(biāo)準(zhǔn)的登記工作也得進(jìn)行……變更的種類五花八門��,變更的難易程度也是參差不齊��,有的很簡單����,有的卻要大費(fèi)周折。更為尷尬的是��,目前針對原輔包登記變更并沒有官方的指導(dǎo)原則����,以致很多時候都是參考一些相近的變更指導(dǎo)原則,再結(jié)合各自的知識和經(jīng)驗�,評估確定變更的級別以及可能需要做得工作。由此可知����,原輔包登記變革工作頻繁而又比較依賴于經(jīng)驗的積累�。
在這篇文章中����,我將結(jié)合自己的工作經(jīng)驗,分享一個藥用輔料登記變更的案例����,變更內(nèi)容包括有效期延長、質(zhì)量標(biāo)準(zhǔn)升級����、基本信息變化,同時補(bǔ)充全套登記資料��,希望能給從事藥用輔料登記注冊的小伙伴們一些幫助����。
一、案例基本情況概要
某藥用輔料����,已有在國外上市藥品中使用的歷史,且被中國藥典、日本藥典收錄��,因此可歸屬于2.4類中國藥典已收載的輔料�。
該藥用輔料來源于植物����,而非動物源或人源;擬登記給藥途徑為口服給藥����,而非注射劑、眼用制劑�、吸入制劑,因此可歸屬于低風(fēng)險藥用輔料��。
本品為早期通過技術(shù)審評����,在沒有頒發(fā)批準(zhǔn)證明文件的情況下自動轉(zhuǎn)A的品種。雖然實(shí)際生產(chǎn)過程中發(fā)生了不少變化����,但多年來始終沒人進(jìn)行信息維護(hù)。
由于為期4年的穩(wěn)定性試驗已經(jīng)完成����,所以計劃延長有效期至3年進(jìn)行銷售����,于是便有了這次變更的任務(wù)�。
二、情況梳理
經(jīng)過梳理和溝通����,進(jìn)一步了解了目前的情況以及需要進(jìn)行的工作,梳理如下:
1)4年的穩(wěn)定性研究已完成����,數(shù)據(jù)齊全,提交穩(wěn)定性數(shù)據(jù)后����,并以此進(jìn)行有效期延長,數(shù)據(jù)鏈完整�,資料齊全,風(fēng)險不大�。
2)本品2019年自動轉(zhuǎn)A,但未按要求提交基于56號文附件一要求的全套登記資料�,因此登記號下是空無資料的,導(dǎo)致后續(xù)的變更沒有根基�,需要先將全套資料補(bǔ)齊����。如何補(bǔ)齊資料����,是否可以和變更同步進(jìn)行,是個需要考慮和評估的問題�。
3)2019年至今,中國藥典由2015版升級未2020版�,導(dǎo)致之前批準(zhǔn)的質(zhì)量標(biāo)準(zhǔn)不再滿足現(xiàn)今的要求�,需要進(jìn)行質(zhì)量標(biāo)準(zhǔn)的升版。
4)由于市政原因�,公司所在地址信息發(fā)生了變化,相應(yīng)的營業(yè)執(zhí)照中的地址信息與現(xiàn)有登記信息中的地址信息不一致����,需要通過基礎(chǔ)信息變更,使兩者保持一致�。
5)由于產(chǎn)能擴(kuò)大,新增一個車間進(jìn)行生產(chǎn)����,希望能將新車間增加到登記資料中。
6)由于銷售需要��,新增了一些規(guī)格,希望能將新規(guī)格增加到登記資料中����。
三、風(fēng)險分析及策略擬定
經(jīng)過上述信息梳理�,我認(rèn)為所有變更的前提是先補(bǔ)齊符合56號文附件一要求的全套登記資料,而變更的具體內(nèi)容包括:
1)基于穩(wěn)定性數(shù)據(jù)��,延長有效期�;
2)基于中國藥典2020版,變更質(zhì)量標(biāo)準(zhǔn)����;
3)基于最新的資質(zhì)資料,變更基礎(chǔ)信息����;
4)變更生產(chǎn)產(chǎn)地,增加車間�;
5)變更規(guī)格,增加新規(guī)格�。
于是開始思考以下問題:
1)補(bǔ)齊全套登記資料是否可以和變更合并進(jìn)行?
2)這么多的變更是否可以分次進(jìn)行����,以免變更太多太大�,影響登記狀態(tài)��?
3)這是變更如何分級����,具體需要做哪些工作?
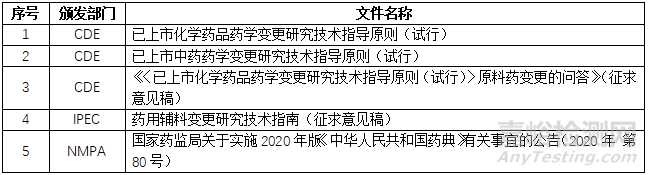
4)需要參考哪些法規(guī)或指導(dǎo)原則����?
為此,我首先找來了以下相關(guān)的指導(dǎo)原則:
同時在CDE網(wǎng)站上提交了一個一般性技術(shù)問題咨詢��,最終擬定策略如下:
1)基于咨詢結(jié)果�,可以將變更與補(bǔ)交登記資料合并提供��,預(yù)計決定這兩個合并推進(jìn)�。
2)變更太多,為了不影響A狀態(tài)�,因此決定分次進(jìn)行變更。優(yōu)先進(jìn)行有效期延長和質(zhì)量標(biāo)準(zhǔn)提升的變更��,順便帶上基礎(chǔ)信息變更����,原因在于前者是最緊急任務(wù)��,后者是補(bǔ)交登記資料中需要的內(nèi)容�。針對穩(wěn)定性數(shù)據(jù)未按照中國藥典2020版要求檢驗的情況����,取留樣采用按注冊標(biāo)準(zhǔn)和中國藥典2020版標(biāo)準(zhǔn)分別檢驗進(jìn)行對比說明。其次再考慮生產(chǎn)場地變更和規(guī)格變更�,原因在于需補(bǔ)充的研究內(nèi)容較多,耗時較長�。
針對首先要進(jìn)行的 “有效期延長+質(zhì)量標(biāo)準(zhǔn)升級+基礎(chǔ)信息修訂”的變更登記,判定其變更分級為中級��,原因如下:
1)首先�,沒有針對藥用輔料自身變更分級的指導(dǎo)原則,相當(dāng)于沒有硬性要求��,可以基于對產(chǎn)品本身��,對由其制備而成的藥品制劑��,對最終服用藥品制劑的患者的風(fēng)險進(jìn)行考慮分級����。
2)有效期延長是基于切實(shí)的穩(wěn)定性數(shù)據(jù),科學(xué)合理而且信息充實(shí)��。
3)質(zhì)量標(biāo)準(zhǔn)基于中國藥典升版屬于官方要求的變更,而且中國藥典作為法定標(biāo)準(zhǔn)��,具有其權(quán)威性和普適性����,因此只要產(chǎn)品滿足其要求,質(zhì)量風(fēng)險可控�。
4)申請人基本信息變更,屬于非技術(shù)性變更����,不會對產(chǎn)品質(zhì)量帶來風(fēng)險。
具體需要進(jìn)行的工作內(nèi)容如下:
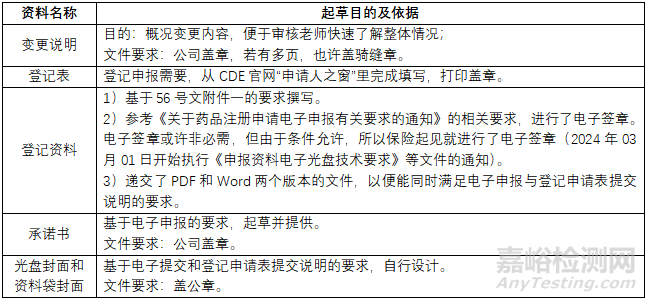
1)寫一份變更說明��,將上述變更的內(nèi)容予以概況說明�,便于審核老師快速了解整體情況;
2)按56號文附件一的要求����,撰寫全套登記資料�;
3)收集穩(wěn)定性數(shù)據(jù)及圖譜,作為登記資料穩(wěn)定性部分的內(nèi)容��;
4)對比原批準(zhǔn)的注冊標(biāo)準(zhǔn)及中國藥典2020版��,并基于以下要求擬定新的質(zhì)量標(biāo)準(zhǔn);
5) 選擇留樣�,采用原注冊標(biāo)準(zhǔn)和新擬定的標(biāo)準(zhǔn)進(jìn)行對比檢驗,作為產(chǎn)品不僅能夠滿足新擬定質(zhì)量標(biāo)準(zhǔn)��,而且長期放置(PS:留樣的放置條件與長期穩(wěn)定性試驗條件類似�,但放置時間更長。)仍能滿足新擬定的質(zhì)量標(biāo)準(zhǔn)��,從而進(jìn)一步支持有效期延長����。
四、執(zhí)行過程
策略清晰�,工作內(nèi)容明確,執(zhí)行起來就比較順暢��,整個過程完成的文件資料匯總?cè)缦拢?/span>
五����、經(jīng)驗總結(jié)
關(guān)于此次登記登記的經(jīng)驗總結(jié)如下:
1)變更的情況繁多、程度不同��,信息評估和策略擬定至關(guān)重要����,而其重點(diǎn)不僅僅在于對藥用輔料本身的影響��,還包括對制劑以及患者的影響�。一些看著對輔料本身影響挺大的變更����,可能對制劑或患者而言影響不大,因此可不用將其作為重大變更對待��。
2)由于歷史原因����,未提交符合現(xiàn)行要求的登記資料的企業(yè),可將登記變更與補(bǔ)交登記資料一并進(jìn)行��,可以不用分次進(jìn)行�。
3)變更內(nèi)容很多時,可以不用一次性全部變更����,可根據(jù)各自的情況分次變更。
4)寧多不缺�,對于拿不準(zhǔn)的地方����,寧可多提供些��,不要少提供����,比如在對文件格式要求不清楚的時候��,同時提交了PDF和Word版本的資料��。