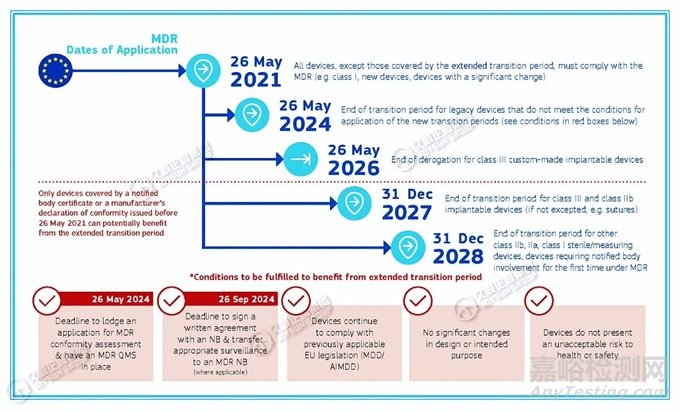
時(shí)間僅剩3個(gè)月! 2024年5月26日前�����,遺留器械應(yīng)當(dāng)提交MDR符合性評(píng)估申請(qǐng)并建立質(zhì)量管理體系,否則無(wú)法享受過(guò)渡期延長(zhǎng)�。
MDR法規(guī)過(guò)渡期延長(zhǎng)的時(shí)間要求
歐盟《MDR過(guò)渡期時(shí)間表》提出:2024年5月26日�����,不滿(mǎn)足新過(guò)渡期應(yīng)用條件的遺留器械的過(guò)渡期結(jié)束�����;
從過(guò)渡期延長(zhǎng)中受益所需滿(mǎn)足的條件有:
· 2024年5月26日:提交MDR符合性評(píng)估申請(qǐng)并建立MDR質(zhì)量管理體系的截止日期�;
· 2024年9月26日:與公告機(jī)構(gòu)簽署書(shū)面協(xié)議并將適當(dāng)?shù)谋O(jiān)督轉(zhuǎn)移至MDR公告機(jī)構(gòu)(如適用)的截止日期���;
· 器械繼續(xù)遵守先前適用的歐盟法規(guī)(MDD/ AIMDD)��;
· 設(shè)計(jì)或預(yù)期目的無(wú)重大變化�����;
· 器械不會(huì)對(duì)健康或安全構(gòu)成不可接受的風(fēng)險(xiǎn)���。
遺留器械的定義
· 在2021年5月26日前�����,MDD指令下的I類(lèi)醫(yī)療器械已擬訂符合性聲明�,MDR法規(guī)下其符合性評(píng)估程序需要公告機(jī)構(gòu)參與的;
· 在2021年5月26日前����,按照MDD指令或AIMDD指令已取得CE標(biāo)志。
MDR法規(guī)對(duì)質(zhì)量管理體系的要求
按照MDR要求���,制造商需要基于MDR要求建立�����、運(yùn)行并保持質(zhì)量管理體系����。
2024年5月26日前,所有遺留器械的質(zhì)量體系建設(shè)必須符合MDR下EN ISO 13485:2016。
針對(duì)遺留器械���,MDR法規(guī)新增許多質(zhì)量體系要求:包括上市后監(jiān)督���、市場(chǎng)監(jiān)督����、警戒系統(tǒng)、經(jīng)濟(jì)運(yùn)營(yíng)商和器械登記等���,對(duì)此制造商最晚不遲于2024年5月26日已建立質(zhì)量管理體系�。