隨著一致性評價(jià)工作的全面展開,相關(guān)技術(shù)指導(dǎo)原則和質(zhì)量標(biāo)準(zhǔn)的不斷完善���,制藥行業(yè)快速發(fā)展,業(yè)內(nèi)對藥品質(zhì)量的研究也更為深入和全面����。替米沙坦片作為仿制降壓藥,在過去十幾年����,歷經(jīng)不斷的質(zhì)量研究和提升,從溶出度符合限度����、溶出曲線與原研制劑相似�,發(fā)展到生物等效����,這是質(zhì)的飛躍。也側(cè)面反映了我國醫(yī)藥行業(yè)的進(jìn)步和國產(chǎn)藥的質(zhì)量提升����。
替米沙坦是特異性血管緊張素Ⅱ受體(AT1 型 ) 拮抗劑,含有雙苯并咪唑的芳香烴基團(tuán)���,因此具有較強(qiáng)的脂溶性和組織穿透性����。它是血漿半衰期(Half-life)較長的血管緊張素受體阻斷劑����,抑制效應(yīng)長達(dá) 24 小時(shí),能夠保證其較長時(shí)間地停留在作用部位�,保持活性,達(dá)到降低血壓的目的����。替米沙坦片是由德國勃林格殷格翰(Boehringer Ingelheim)公司研制開發(fā),1998 年在美國上市���,于 2002年由 CFDA(國家食品藥品監(jiān)督管理總局)批準(zhǔn)進(jìn)入中國市場�。其商品名為 Micardis����,規(guī)格為 20 mg���、40 mg 和80 mg���,基于其“強(qiáng)效�、長效(半衰期24 小時(shí))�、安全” [1] 的特點(diǎn)���,增強(qiáng)高血壓患者治療的耐受性����。替米沙坦上市后受到了臨床醫(yī)生及廣大患者的普遍肯定和接受����。之后不斷被國內(nèi)企業(yè)仿制����,國內(nèi)現(xiàn)存替米沙坦片有效批準(zhǔn)文號已有 50 余個(gè)�。
中國藥企仿制初期,由于不同企業(yè)的研發(fā)能力���、生產(chǎn)水平存在差異,不同廠家仿制的替米沙坦片在藥物成分�、藥品療效���、藥物價(jià)格等方面����,均存在較大差異�。在國家藥典標(biāo)準(zhǔn)和相關(guān)指導(dǎo)原則的不斷更新及相關(guān)部門的監(jiān)管下����,生產(chǎn)企業(yè)逐漸成長�,產(chǎn)品質(zhì)量不斷提升,相關(guān)的檢測手段和評判標(biāo)準(zhǔn)也在不斷完善。
2008 年���,根據(jù)一篇對替米沙坦制劑溶出度研究的文獻(xiàn) [2] 報(bào)道,其針對不同廠家的替米沙坦片進(jìn)行溶出度測定���,以水為溶出介質(zhì),得到的最低溶出度為 13%����、最高溶出度為 92%���。這說明當(dāng)時(shí)不同廠家的替米沙坦片質(zhì)量確實(shí)存在差異�。
2012 年���,羅密等人又以不同廠家的國產(chǎn)替米沙坦片為研究對象 [3]����,與進(jìn)口替米沙坦片一同測定溶出曲線����。并通過評估國產(chǎn)片與進(jìn)口片的溶出曲線相似性����,對比質(zhì)量情況。結(jié)果顯示�,f1和 f2 均出現(xiàn)低于標(biāo)準(zhǔn)值的數(shù)據(jù)�,證明國產(chǎn)片與進(jìn)口片的溶出曲線不相似,質(zhì)量存在差異�。
隨著更多分析設(shè)備的出現(xiàn),檢測手段更加多元化�。有學(xué)者通過熱重分析法(TG)�、差示掃描量熱法(DSC)[4]���、粉末 X 射線衍射實(shí)驗(yàn),對不同處方和工藝的替米沙坦片進(jìn)行了初步判斷�。
Micardis 作為原研制劑,根據(jù)專利 [5] 可知其主要制備工藝為噴霧制粒���,且在制備中替米沙坦以一種非結(jié)晶形式存在。而早期國內(nèi)的大部分工藝都是濕法制粒����。與原研相比,制備工藝差異大�,原料晶型研究不充分���,制藥企業(yè)研究水分參差不齊���,是長時(shí)間以來造成國產(chǎn)制劑與原研制劑質(zhì)量差異的因素之一���。
2015 年�,《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》由國務(wù)院印發(fā)�,預(yù)示審評工作正式提上日程����。隨著一致性評價(jià)工作的推進(jìn),各大生產(chǎn)企業(yè)將更多的資源投入到產(chǎn)品一致性研究中�,在產(chǎn)品質(zhì)量提升的道路上勇往直前�。研究的內(nèi)容也更為全面和深入,涉及原料藥的晶型研究���、雜質(zhì)研究�、輔料研究、包材研究���、制劑處方解析���、關(guān)鍵工藝參數(shù)研究、質(zhì)量控制和標(biāo)準(zhǔn)制定�、溶出曲線和穩(wěn)定性研究及生物等效性研究等。這為制藥企業(yè)提供了完整的研究思路和方向����。
至 2023 年 9 月,根據(jù)國家藥品監(jiān)督管理局藥品審評中心(CDE)官網(wǎng)信息���,已有 15 條關(guān)于替米沙坦片的受理號通過一致性評價(jià)���,還有部分生產(chǎn)企業(yè)在一致性評價(jià)審評的路上??梢妼τ谙麡O審評的企業(yè)���,只有被淘汰的命運(yùn)。
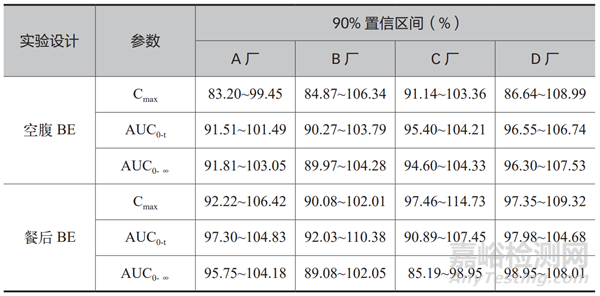
藥學(xué)等效,不一定生物等效���。希望采用一致性評價(jià)的方式可以提高藥品質(zhì)量����,希望仿制制劑能夠?qū)崿F(xiàn)在藥學(xué)等效的基礎(chǔ)上���,服用相同劑量,與原研制劑在活性成分的吸收程度和速度上�,具有相同的安全性和有效性,無明顯的統(tǒng)計(jì)學(xué)差異���,達(dá)到生物等效�。在已通過 CDE 的信息中筆者獲取到:各生產(chǎn)企業(yè)經(jīng)過充分的藥學(xué)研究和工藝研究�,在 BE(生物等效性)實(shí)驗(yàn)中���,基于單次實(shí)驗(yàn) 32 例 ~50 例受試者參與的基礎(chǔ)上����,采用“單中心、隨機(jī)���、開放����、三周期���、三序列、部分重復(fù)交叉試驗(yàn)設(shè)計(jì)空腹和餐后試驗(yàn)”的實(shí)驗(yàn)設(shè)計(jì)方案����,或增加“四周期、雙制劑”的研究����,或采取大規(guī)格制劑的 BE 豁免小規(guī)格制劑的實(shí)驗(yàn)設(shè)計(jì)策略;等效標(biāo)準(zhǔn)設(shè)置為受試制劑和原研制劑藥代動(dòng)力學(xué)參數(shù)(Cmax�����、AUC0-t�����、AUC0-∞)經(jīng)對數(shù)轉(zhuǎn)換后的幾何平均值比值的 90%置信區(qū)間在 80.00% ~ 125.00% 范圍內(nèi) [6]��。
表1 展示了從 CDE 公開信息中��,抽取的幾家生產(chǎn)企業(yè)關(guān)于替米沙坦片40 mg 產(chǎn)品的 BE 數(shù)據(jù)��。由表中數(shù)據(jù)可以看出��,通過一致性評價(jià)的國產(chǎn)替米沙坦片�����,空腹 BE 和餐后 BE 均與原研制劑達(dá)到生物等效。一致性評價(jià)工作��,對替米沙坦片的質(zhì)量提升是顯著的,它為各制藥企業(yè)樹立了產(chǎn)品研究的標(biāo)桿和目標(biāo)���,也是規(guī)范制藥行業(yè)的標(biāo)尺。國內(nèi)制藥企業(yè)不應(yīng)僅僅追求溶出曲線層面的藥學(xué)等效,更應(yīng)追求生物等效��,并且不斷完善藥物警戒�����、不良反應(yīng)監(jiān)測等工作���,最終為廣大患者提供可靠且可信的�����,質(zhì)量不亞于進(jìn)口藥品的國產(chǎn)產(chǎn)品��。
表1 4家生產(chǎn)企業(yè)40mg替米沙坦片的 BE 數(shù)據(jù)
據(jù)了解,我國有 5000 多家藥廠�����,其中有很大部分都是仿制藥企業(yè) [7]���,是名副其實(shí)的仿制藥大國�����。由點(diǎn)及面���,替米沙坦片僅是我國藥品體系中的一個(gè)小個(gè)體,還有更多的企業(yè)在面臨其他藥品的一致性評價(jià)挑戰(zhàn)�����。因此��,一致性評價(jià)工作更是一次制藥行業(yè)的革命��。希望在一致性評價(jià)的環(huán)境中,我國仿制藥的水平可以得到提升,國家標(biāo)準(zhǔn)可以完善�����,制藥行業(yè)能夠更加有序發(fā)展��,國產(chǎn)制劑可以更有競爭力��,也讓更多的患者相信國產(chǎn)好藥���,認(rèn)可國產(chǎn)藥品,享受更多的實(shí)惠��。
參考文獻(xiàn)
[1] 國家衛(wèi)生計(jì)生委合理用藥專家委員會(huì)���,中國醫(yī)師協(xié)會(huì)高血壓專業(yè)委員會(huì). 高血壓合理用藥指南 [J/OL].中國醫(yī)學(xué)前沿雜志(電子版)��,2015�����,7(06): 22-64.
[2] 鄭艷彬���,印杰���,陸威.不同廠家替米沙坦片的溶出度比較 [J].藥學(xué)服務(wù)與研究�����,2008 (05):386-387.
[3] 羅密���,Bora Lichande,陳芬燕�����,張畢奎 . 不同廠家替米沙坦片在四種溶出介質(zhì)中溶出曲線比較:2012年中國藥學(xué)大會(huì)暨第十二屆中國藥師周論文集[C].北京:中國藥學(xué)會(huì)���,2012:1-9.
[4] 李忠紅���,張玫,樊夏雷�����,等 . 采用熱分析法對替米沙坦口服固體制劑處方工藝的分析 [J].中國藥品標(biāo)準(zhǔn)���,2014���,15(03):171-179.
[5] 貝林格爾英格海姆砝瑪兩合公司.一種制備基本上非結(jié)晶形式的替米沙 坦 的 方 法:CN200810214445.4[P].2002-01-16.
[6] 趙云海 . 馬來酸阿伐曲泊帕在中國健康人體內(nèi)藥代動(dòng)力學(xué)和基因組學(xué)研究 [D] 鄭州:鄭州大學(xué)��,2022.
[7] 張靜 . 從仿制藥到原研藥��,我們距離醫(yī)藥強(qiáng)國還有多遠(yuǎn)?[J]. 中國品牌,2018(09):60-61.
本文作者黃波���,天津華津制藥有限公司,僅供交流學(xué)習(xí)��。