導(dǎo)語:臨床評價可謂設(shè)計確認(rèn)過程中的重要環(huán)節(jié)��,也是貫穿醫(yī)療器械全生命周期的以確認(rèn)醫(yī)療器械在其適用范圍下的安全性�、臨床性能和/或有效性的持續(xù)進(jìn)行的活動��,同時也是影響醫(yī)療器械開發(fā)成本的重要一環(huán)�,因此如何正確選擇臨床評價路徑對于器械研發(fā)人至關(guān)重要����。本文著重介紹臨床評價與設(shè)計開發(fā)的關(guān)系及在各階段的任務(wù)����、臨床評價流程及路徑��、醫(yī)療器械臨床評價路徑選擇以及臨床評價涉及到的法規(guī),以為諸君在研發(fā)過程中提供點滴參考����。
第一部分 臨床評價與設(shè)計開發(fā)的關(guān)系
臨床評價選擇的重要性無容置疑�,那么我們在設(shè)計開發(fā)的各個階段應(yīng)該做些什么呢����?
立項和策劃階段:應(yīng)明確產(chǎn)品的目標(biāo)市場,對產(chǎn)品分類�、注冊單元��、注冊路徑��、上市前臨床路徑進(jìn)行策劃,輸出“注冊/臨床路徑”��。
設(shè)計輸入階段:根據(jù)產(chǎn)品注冊與臨床策劃時確定的產(chǎn)品目標(biāo)市場和產(chǎn)品分類��,識別該產(chǎn)品應(yīng)遵循和部分遵循的規(guī)定產(chǎn)品技術(shù)要求和規(guī)定產(chǎn)品實現(xiàn)過程要求的法規(guī)和標(biāo)準(zhǔn)��。比如�,是否存在相應(yīng)的臨床評價注冊指導(dǎo)原則或同品種臨床評價注冊審查指導(dǎo)等����。若采用同品種對比��,則應(yīng)對選擇的對比器械進(jìn)行設(shè)計輸入。
設(shè)計輸出階段:當(dāng)產(chǎn)品為免臨床目錄內(nèi)產(chǎn)品或通過同品種比對豁免臨床試驗時��,應(yīng)進(jìn)行產(chǎn)品與對比產(chǎn)品性能對比評價�。該評價應(yīng)至少包括:目的�、檢驗設(shè)備要求、樣品信息����、對比項目及檢驗方法����、測試結(jié)果����、結(jié)果分析等����。該評價應(yīng)在設(shè)計輸出評審?fù)瓿汕巴瓿伞.a(chǎn)品與對比產(chǎn)品性能對比評價結(jié)果是產(chǎn)品性能及指標(biāo)制定依據(jù)的輸入來源。
當(dāng)進(jìn)行創(chuàng)新產(chǎn)品時��,在設(shè)計定型階段必要時進(jìn)行早期小樣本臨床����。前期撰寫的文章醫(yī)療器械研發(fā)能否開展小樣本臨床試驗中FDA發(fā)布的《Investigational Device Exemptions (IDEs) for Early Feasibility Medical Device Clinical Studies,Including Certain First in Human (FIH) Studies》(簡稱EFS)介紹到:早期可行性研究允許對器械進(jìn)行早期臨床評估��,以提供原理和初步證據(jù)臨床安全數(shù)據(jù)��。這些研究對于臨床早期器械開發(fā)經(jīng)驗是必要的,因為非臨床測試方法不可用或不足以提供推進(jìn)開發(fā)過程所需的信息����。
設(shè)計驗證階段:對于采用同品種等同性臨床評價的����,動物試驗往往也是對于技術(shù)特征等同性的證據(jù)之一��。同時若采用臨床試驗,則該階段應(yīng)進(jìn)行相應(yīng)的臨床試驗策劃�,如選定機構(gòu)�、臨床試驗方案等等。
設(shè)計確認(rèn)階段:這一部分在淺談設(shè)計確認(rèn)開展及輸出物要求(無源醫(yī)療器械詳細(xì)攻略)進(jìn)行了詳細(xì)的介紹�,這里簡單概括如下:
A 臨床試驗策劃需要開展臨床試驗的產(chǎn)品��,應(yīng)輸出臨床試驗決策����。本階段應(yīng)進(jìn)行臨床試驗策劃����,策劃活動包括臨床試驗審批/備案資料準(zhǔn)備����、倫理資料清單及提交資料、臨床試驗機構(gòu)的篩選等����,倫理批件應(yīng)在臨床試驗入組前獲得�。需要進(jìn)行臨床試驗審批的器械詳見《需進(jìn)行臨床試驗審批的第三類醫(yī)療器械目錄》(2020年修訂版)(公眾號內(nèi)回復(fù) 臨床審批可獲得)����。
對于需要臨床試驗的產(chǎn)品,應(yīng)制定臨床試驗方案以滿足設(shè)計確認(rèn)的要求��。適用時����,本階段應(yīng)輸出臨床試驗的設(shè)計依據(jù)��。臨床試驗方案的設(shè)計應(yīng)遵循食品藥品監(jiān)管總局2018年第6號通告《醫(yī)療器械臨床試驗設(shè)計指導(dǎo)原則》的要求��。完成設(shè)計確認(rèn)活動�,更新設(shè)計確認(rèn)追溯表,應(yīng)包含設(shè)計確認(rèn)的結(jié)果、結(jié)論��,并記錄任何必要的措施。
B 臨床試驗樣品
適用時����,應(yīng)出具臨床試驗用樣品生產(chǎn)方案��,且應(yīng)經(jīng)評審,通過后方可進(jìn)行(由于臨床試驗費用是比較高的��,因此建議對于臨床樣品的生產(chǎn)方案進(jìn)行評審)�。需要開展臨床試驗的產(chǎn)品�,本階段依據(jù)設(shè)計定型評審后文件版本進(jìn)行制造��,保留完整的生產(chǎn)和檢驗可追溯性記錄。臨床試驗樣品應(yīng)保留完整的出入庫記錄����、去向表��。
用于臨床的應(yīng)保留儲運記錄、回收記錄[醫(yī)療器械注冊質(zhì)量管理體系核查指南(2022年第50號)規(guī)定申請人應(yīng)保存臨床試驗產(chǎn)品的分發(fā)����、儲運、回收/退回等記錄]��。臨床首批樣品入庫前完成臨床首批樣品入庫前體系自查��,輸出核查報告,完成不符合項整改�。由于臨床時期存在一定的時間空檔,此時可以利用臨床試驗的時間空檔整改不符合項�,便于后期一旦獲得臨床報告后即可提交注冊��。
C 臨床評價
需要開展臨床試驗的產(chǎn)品:本階段應(yīng)根據(jù)臨床試驗方案實施臨床試驗以滿足設(shè)計確認(rèn)的要求��,應(yīng)輸出臨床試驗報告和統(tǒng)計分析報告����。在注冊提交前應(yīng)輸出臨床評價報告,具體應(yīng)遵循《國家藥監(jiān)局發(fā)布的醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則(2021年第73號)》醫(yī)療器械注冊申報臨床評價報告技術(shù)指導(dǎo)原則的要求。
無需臨床試驗的產(chǎn)品:詳見免于臨床評價醫(yī)療器械目錄的通告(2023年第33號)(回復(fù) 免臨床 可獲得)��,本階段應(yīng)輸出產(chǎn)品對比說明��。具體應(yīng)遵循《國家藥監(jiān)局發(fā)布的醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則(2021年第73號)》列入免于臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)指導(dǎo)原則要求(公眾號內(nèi) 回復(fù) 免臨床 可獲得)進(jìn)行。
同品種等同性論證的產(chǎn)品:對于需要進(jìn)行臨床評價的第二類�、第三類醫(yī)療器械����,若通過等同器械的臨床數(shù)據(jù)進(jìn)行臨床評價�,需要進(jìn)行等同性論證并輸出報告�,具體可參照《醫(yī)療器械臨床評價等同性論證技術(shù)指導(dǎo)原則》(公眾號內(nèi) 回復(fù) 等同性 可獲得)進(jìn)行����。
第二部分 臨床評價過程及路徑
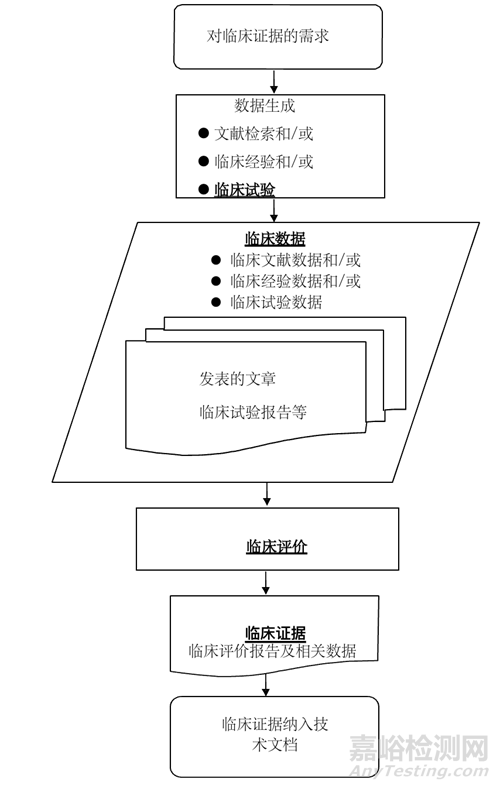
在《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》中介紹過臨床評價的流程�,如下圖所示:
臨床評價的結(jié)果為臨床評價報告����,是對臨床數(shù)據(jù)及其質(zhì)量進(jìn)行詳細(xì)闡述��,論證臨床數(shù)據(jù)如何證明產(chǎn)品對安全和性能基本原則的符合性。臨床評價需持續(xù)開展�,產(chǎn)品上市后注冊申請人需對產(chǎn)品安全性�、臨床性能和/或有效性信息進(jìn)行常規(guī)監(jiān)測�,并根據(jù)更新的信息�,進(jìn)行風(fēng)險受益再評估����。臨床評價的輸入主要是來源于臨床試驗報告��、臨床文獻(xiàn)和臨床經(jīng)驗的臨床數(shù)據(jù)。根據(jù)產(chǎn)品特征����、適用范圍��、注冊申請人宣稱�、警示及注意事項的充分性、臨床使用經(jīng)驗的不同��,論證產(chǎn)品對安全和性能基本原則符合性需要的臨床數(shù)據(jù)和證據(jù)亦不相同����。臨床評價旨在證明與患者受益相比����,產(chǎn)品使用相關(guān)的風(fēng)險可接受����,且能較高程度地保護(hù)患者健康及安全。因此臨床評價需與風(fēng)險管理文件相互參照��。
醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則
根據(jù)國家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則等5項技術(shù)指導(dǎo)原則的通告(2021年第73號)我們可以得知��,臨床評價的路徑主要包括:免臨床評價(簡稱免臨床)�、臨床試驗和同品種等同性論證(簡稱同品種)三種路徑����。
第三部分 臨床評價路徑選擇
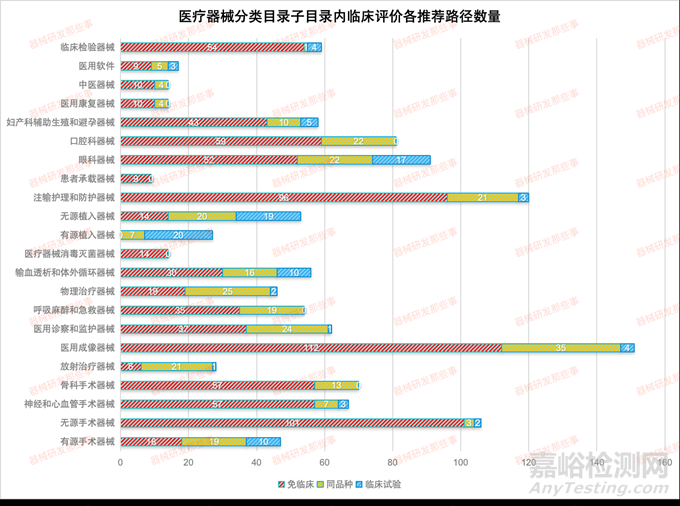
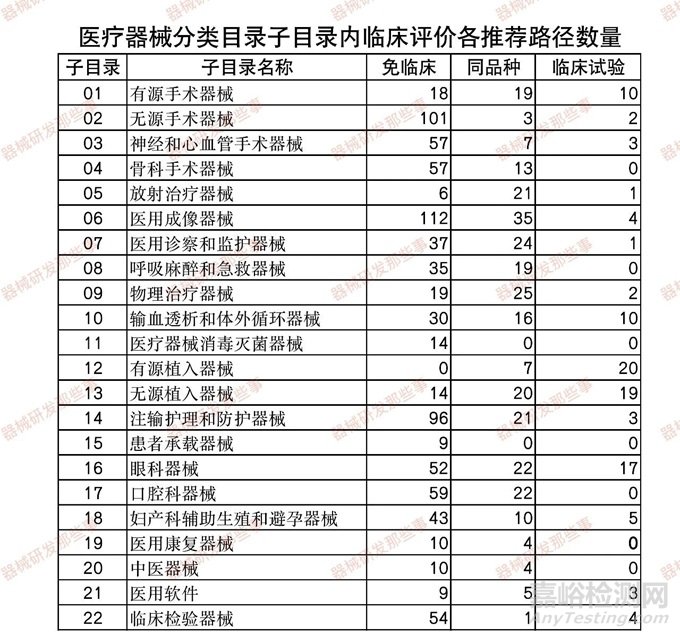
根據(jù)CMDE發(fā)布的《醫(yī)療器械分類目錄》子目錄01-22相關(guān)產(chǎn)品臨床評價推薦路徑的通告(2022年第20、24和30號) 相關(guān)內(nèi)容����,統(tǒng)計了在各個子目錄下的產(chǎn)品對應(yīng)推薦的臨床評價路徑的數(shù)量(免臨床評價-簡稱免臨床��、臨床試驗和同品種)�,如下表和下圖所示����。
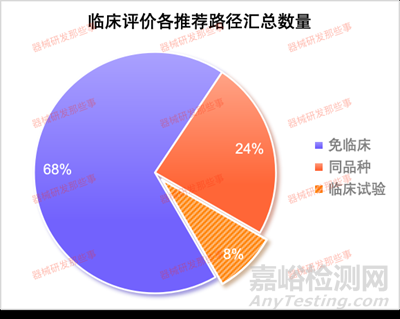
從圖中可以看出��,涉及到臨床試驗的子目錄相關(guān)產(chǎn)品占比8%�,免臨床評價的占比68%����,同品種對比的占比24%。其中涉及臨床試驗的主要集中在12有源植入器械����、13無源植入器械和16眼科器械以及01有源手術(shù)器械�。
第四部分 臨床評價涉及的法規(guī)
《醫(yī)療器械監(jiān)督管理條例》(2020年12月21日)
《醫(yī)療器械注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第47號)
《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》(國家藥品監(jiān)督管理局國家衛(wèi)生健康委員會2022年28號公告)
國家藥監(jiān)局關(guān)于實施《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》有關(guān)事項的臨床文獻(xiàn)數(shù)據(jù)通告(國家藥品監(jiān)督管理局通告2022年第21號)
《醫(yī)療器械臨床試驗設(shè)計指導(dǎo)原則》(2018年第6號)
《接受醫(yī)療器械境外臨床試驗數(shù)據(jù)指導(dǎo)原則》(2018年第13號)
《真實世界數(shù)據(jù)用于醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則(試行)》
(2020年第77號)《醫(yī)療器械拓展性臨床試驗管理規(guī)定(試行)》(公告2020年第41號)
《需進(jìn)行臨床試驗審批的第三類醫(yī)療器械目錄》(2020年修訂版�,通告2020年第61號)
《免于臨床評價醫(yī)療器械目錄》的通告(2021年第71號)
《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》(2021年第73號通告)
《決策是否開展醫(yī)療器械臨床試驗技術(shù)指導(dǎo)原則》(2021年第73號通告)
《醫(yī)療器械臨床評價等同性論證技術(shù)指導(dǎo)原則》(2021年第73號通告)
《醫(yī)療器械注冊申報臨床評價報告技術(shù)指導(dǎo)原則》(2021年第73號通告)
《列入免于臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)導(dǎo)原則》(2021年第73號通告)
《醫(yī)療器械臨床試驗數(shù)據(jù)遞交要求注冊審查指導(dǎo)原則》(2021年第91號)
《醫(yī)療器械真實世界研究設(shè)計和統(tǒng)計分析注冊審查指導(dǎo)原則》(2024年第3號)
結(jié)束語:臨床評價在設(shè)計開發(fā)過程中重要性無容置疑,本文詳細(xì)介紹了臨床評價與設(shè)計開發(fā)的關(guān)系以及各階段應(yīng)進(jìn)行的與之相關(guān)的事項��、臨床評價路徑及流程��、臨床評價推薦路徑以及涉及到法規(guī)��。