1���、研究背景
與胃腸外途徑相比�����,口服提供了一個(gè)安全、快速和簡(jiǎn)便的給藥過(guò)程�,并使患者更加舒適和依從。由于存在穩(wěn)定性���、劑量一致性和與賦形劑共同配制能力方面的優(yōu)勢(shì)�,口服固體藥物已成為主要制劑�,始終占美國(guó)FDA批準(zhǔn)新藥的50%���。然而�,某些患者難以吞咽固體�。50%以上兒童無(wú)法吞下標(biāo)準(zhǔn)尺寸的藥丸或膠囊�����。吞咽障礙或吞咽困難的患者同樣會(huì)與固體藥物形式斗爭(zhēng)。在成人中���,吞咽困難的患病率可高達(dá)16%�,超37%的人吞咽困難�����。這可能導(dǎo)致患者跳過(guò)或修改(如壓碎)他們的藥物,從而可導(dǎo)致藥代動(dòng)力學(xué)特征的改變和死亡�。雖然液體制劑更容易攝入���,但它們?nèi)狈x形劑定位治療的能力�,也不能起到控釋裝置的作用,這對(duì)口服生物藥物提出了挑戰(zhàn)�。
2、研究成果
近日�����,美國(guó)麻省理工學(xué)院Giovanni Traverso團(tuán)隊(duì)報(bào)道了一種新策略,以實(shí)現(xiàn)可飲用的液體原位形成堅(jiān)韌(LIFT)水凝膠的藥物制劑�,彌補(bǔ)了固體和液體劑型的優(yōu)勢(shì)���。通過(guò)依次攝入鈣和二硫醇交聯(lián)劑的交聯(lián)劑溶液���,然后是藻酸鹽和四臂聚(乙二醇)-馬來(lái)酰亞胺的含藥物聚合物溶液,LIFT水凝膠直接在胃中形成�����。研究表明�,LIFT水凝膠在活大鼠和豬的胃中牢固地形成�,具有機(jī)械韌性、生物相容性�����,24h后安全清除能力�����。LIFT水凝膠以可控的方式提供與未包封藥物相當(dāng)?shù)目偹幬飫┝?��,并保護(hù)包封的治療酶和細(xì)菌免受胃酸介導(dǎo)的失活�?����?傊?,LIFT水凝膠可以擴(kuò)大吞咽困難患者獲得先進(jìn)治療的途徑���。
相關(guān)研究工作以“Drinkable in situ-forming tough hydrogels for gastrointestinal therapeutics”為題發(fā)表在國(guó)際頂級(jí)期刊《Nature Materials》上。
3�����、研究?jī)?nèi)容
1、LIFT水凝膠的設(shè)計(jì)與表征
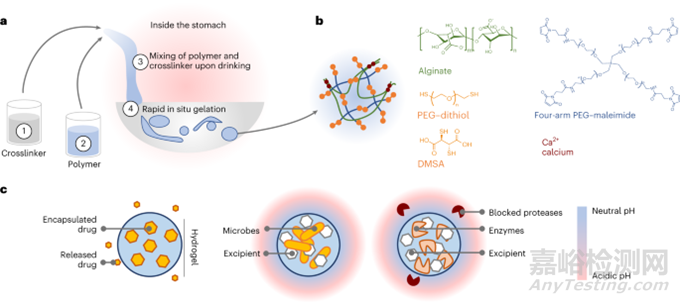
由于停留時(shí)間相對(duì)較短(<30min)和胃液的復(fù)雜性�����,研究者開發(fā)了能夠快速而有力地交聯(lián)兩個(gè)互穿聚合物網(wǎng)絡(luò)的交聯(lián)化學(xué)物質(zhì)�。最終確定方案:(1)攝入包含CaCl2和DMSA或PEG-二硫醇的交聯(lián)劑溶液�����;(2)然后���,攝入包含藻酸鹽和四臂PEG-馬來(lái)酰亞胺的聚合物溶液�;(3)在胃中混合�,聚合物溶液經(jīng)歷聚合物網(wǎng)絡(luò)的交聯(lián)和凝膠化;(4)形成LIFT水凝膠(圖1a�����、b)���。
圖1. LIFT水凝膠概述
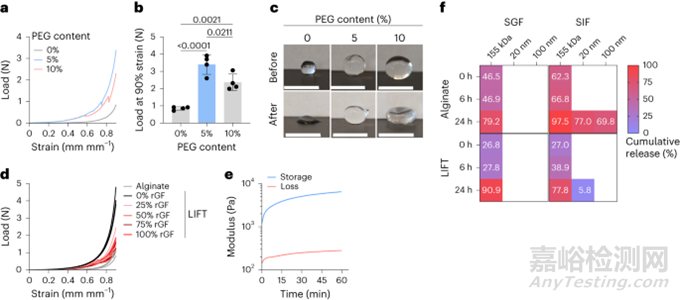
通過(guò)壓縮測(cè)試對(duì)所得水凝膠進(jìn)行了機(jī)械表征���。與藻酸鹽水凝膠相比,LIFT水凝膠承受的負(fù)載明顯更大(圖2a���,b)�����。在90%應(yīng)變后�,LIFT水凝膠大部分保持球形�,而藻酸鹽水凝膠保持永久變形(圖2c)。通過(guò)循環(huán)壓縮測(cè)試對(duì)LIFT水凝膠進(jìn)行了進(jìn)一步的機(jī)械表征。LIFT水凝膠可以維持90%應(yīng)變的至少五個(gè)循環(huán)���,但藻酸鹽水凝膠在一個(gè)循環(huán)后仍保持永久變形�,無(wú)法維持隨后的應(yīng)變�。為了測(cè)試LIFT水凝膠在體內(nèi)形成的能力,在水中以各種稀釋度在新鮮豬胃液中形成水凝膠�����。圖2d顯示�����,雖然胃液削弱了LIFT水凝膠的機(jī)械性能���,但這些水凝膠比在理想條件下形成的藻酸鹽水凝膠在機(jī)械上更堅(jiān)韌?��?傊?����,這些數(shù)據(jù)表明�,LIFT水凝膠即使在胃液中也能快速形成,所得水凝膠具有機(jī)械韌性�,DMSA和PEG-二硫醇交聯(lián)劑都能交聯(lián)共價(jià)PEG網(wǎng)絡(luò),且水凝膠組分具有生物相容性�。
圖2. LIFT水凝膠的體外表征
2、LIFT水凝膠在大型動(dòng)物中的表征
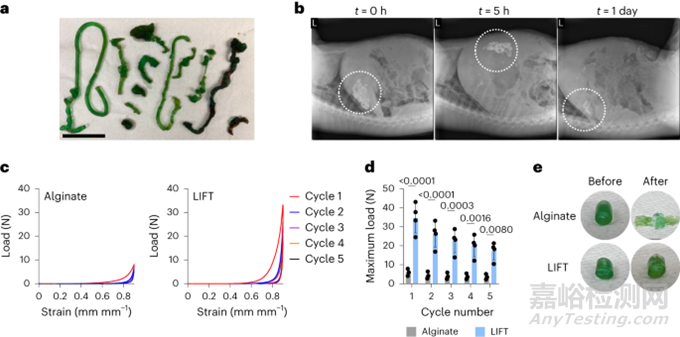
在體內(nèi)測(cè)試LIFT水凝膠的形成���、動(dòng)力學(xué)和安全性�����。由于豬的胃腸道大小與人類相似�����,選擇豬模型���。通過(guò)內(nèi)窺鏡,將交聯(lián)劑和聚合物溶液注入豬胃中���,并觀察到5-8h后水凝膠結(jié)構(gòu)�。無(wú)論給藥順序如何���,水凝膠都會(huì)在胃里形成�。先交聯(lián)劑,后聚合物溶液�,胃內(nèi)可重復(fù)形成面條狀水凝膠;順序相反�����,則產(chǎn)生了更大但不太連續(xù)的塊狀水凝膠(圖3a)�。因此,選擇先給藥交聯(lián)劑�����,再給藥聚合物溶液�,在體內(nèi)形成LIFT水凝膠�。然后通過(guò)X射線成像研究LIFT水凝膠的體內(nèi)傳輸時(shí)間。一般來(lái)說(shuō)�,LIFT水凝膠給藥后在胃內(nèi)停留24h(圖3b);相比之下�,禁食和進(jìn)食狀態(tài)下0.4-1.4h從豬胃中排空液體。給藥后48h�,未觀察到肝或腎功能變化。這些數(shù)據(jù)支持LIFT水凝膠及其成分被安全清除���,不會(huì)造成阻塞�����,也不會(huì)造成毒性�����。在胃腔中形成后�,通過(guò)循環(huán)壓縮測(cè)試表征LIFT水凝膠的機(jī)械性能。圖3c-e 顯示�����,LIFT水凝膠更堅(jiān)韌�,能夠維持至少五個(gè)90%的循環(huán)菌株,而藻酸鹽水凝膠在一個(gè)循環(huán)后保持平坦�。這些強(qiáng)調(diào)了LIFT水凝膠在人體胃腸道口服給藥后在胃中牢固形成的能力。
圖3. LIFT水凝膠的體內(nèi)表征
3�����、LIFT水凝膠調(diào)節(jié)小分子釋放
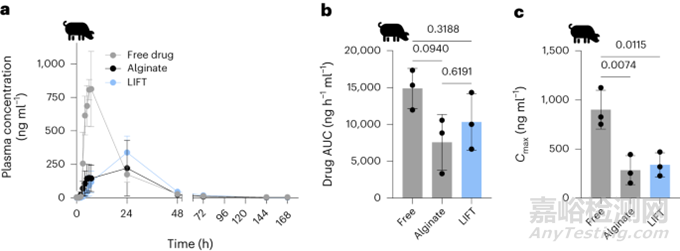
在確定LIFT水凝膠可以在體內(nèi)形成后�����,又評(píng)估了它們封裝和調(diào)節(jié)小分子釋放的能力�。選擇流明三烯作為模型小分子藥物���,將形成藥物懸浮液,后被封裝在水凝膠內(nèi)�����。游離流明三烯的血漿濃度峰值在給藥后5-7h�����,水凝膠(藻酸鹽和LIFT)制劑的血漿藥物濃度峰值為~24h(圖4a)�。游離藥物、藻酸鹽和LIFT水凝膠的釋放藥物的曲線下面積(AUC)分別為14873.5±2719.2, 7568.4±3780.6和10337.5±3849.7ng?h-1?ml-1���,并且沒有統(tǒng)計(jì)學(xué)差異(圖4b)���。雖然藥物AUCs沒有差異���,但最大藥物濃度(Cmax)明顯更高�����,游離藥物(901.2±197.1ng?h-1?ml-1)���、藻酸鹽(283.8±147.3ng?h-1?ml-1)���、LIFT水凝膠(338.7±122.6ng?h-1?ml-1)(圖4c)。這些數(shù)據(jù)證明LIFT水凝膠在較低血漿濃度下提供與游離藥物相當(dāng)?shù)目倓┝克幬锏哪芰?��,可以降低藥物毒性?/span>
圖4. 各種口服流明三烯制劑的藥代動(dòng)力學(xué)
4�、LIFT水凝膠保護(hù)治療酶活性
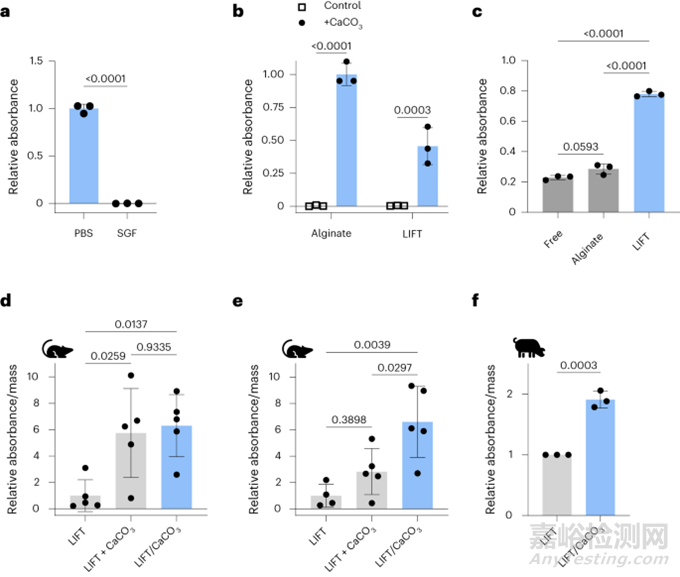
接下來(lái)�,評(píng)估了LIFT水凝膠口服遞送酶的能力,選擇β-半乳糖苷酶(乳糖酶)�。與磷酸鹽緩沖鹽水(PBS)相比,在SGF中孵育時(shí)乳糖酶活性顯著降低(圖5a)�����;然后將乳糖酶與CaCO3一起包封在藻酸鹽或LIFT水凝膠中作為賦形劑以中和酸性胃液���。當(dāng)用SGF攻擊時(shí)���,含有CaCO3的水凝膠保持了乳糖酶活性(圖5b),強(qiáng)調(diào)了LIFT水凝膠與酶的兼容性�。除了酸性胃液外,胃腸道中還富含可以降解酶的蛋白酶�����。與游離乳糖酶或藻酸鹽水凝膠中包埋乳糖酶相比,LIFT水凝膠表現(xiàn)出最大的乳糖酶活性保護(hù)作用(圖5c)�。因此,除了共包封CaCO3外�����, LIFT水凝膠可能對(duì)蛋白酶表現(xiàn)出額外的屏障�。
然后測(cè)試LIFT水凝膠在體內(nèi)保護(hù)乳糖酶活性的能力。與在豬中進(jìn)行的研究類似�����,首先給大鼠灌胃服用交聯(lián)劑溶液���,然后立即服用含有乳糖酶的聚合物溶液(含或不含CaCO3)�;值得注意的是���,雖然1h后分離和共包封CaCO3都保護(hù)乳糖酶活性(圖5d)���,2h后僅共包封CaCO3保護(hù)乳糖酶(圖5e)�����。在體內(nèi)6h孵育(圖5f),豬模型中也觀察到了共包封CaCO3的LIFT水凝膠的保護(hù)作用研究者在大鼠體內(nèi)和體外進(jìn)一步驗(yàn)證了LIFT與其他酶的更廣泛兼容性�。
圖5. LIFT水凝膠共包封CaCO3保護(hù)口服后乳糖酶活性
5、LIFT水凝膠保護(hù)治療細(xì)菌的生存能力
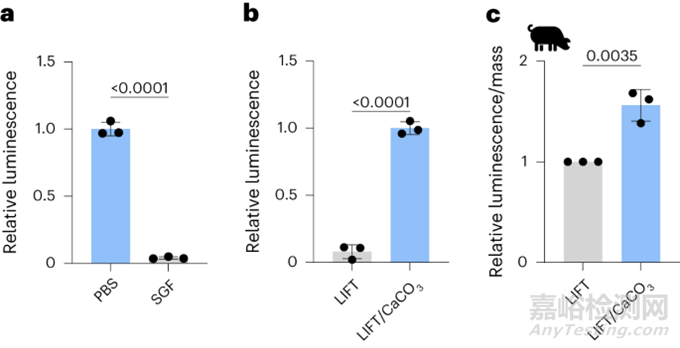
研究者使用發(fā)光ATP定量測(cè)定法以考察細(xì)菌(乳酸桿菌)的生存能力�����。乳酸桿菌在短時(shí)間暴露于SGF pH=1.77后表現(xiàn)出生存能力下降(圖6a)�����,當(dāng)與CaCO3共封裝在LIFT中時(shí)���,這種情況得到了緩解(圖6b)�。在豬胃內(nèi)給藥6-7h后�����,與對(duì)照相比���,在LIFT內(nèi)與CaCO3共包封的乳酸桿菌表現(xiàn)出更大的活力(圖6c)���。用大腸桿菌Nissle 1917(EcN)進(jìn)行了類似的實(shí)驗(yàn)���,但沒有表現(xiàn)出統(tǒng)計(jì)學(xué)意義。EcN和乳酸桿菌之間的差異可能是由于后者對(duì)與胃酸相關(guān)的pH范圍更敏感�。因此,當(dāng)體內(nèi)負(fù)載CaCO3時(shí)�����,LIFT水凝膠能夠支持細(xì)菌活力并防止酸侵蝕�����。
圖6. LIFT水凝膠共包封CaCO3保護(hù)細(xì)菌活性
4�����、結(jié)論與展望
吞咽障礙和吞咽困難是目前口服藥物給藥的主要障礙�。這項(xiàng)研究開發(fā)了一種可飲用配方,稱為L(zhǎng)IFT水凝膠���,能夠在胃中混合后從液體轉(zhuǎn)變?yōu)楣腆w���。LIFT水凝膠具有增強(qiáng)胃滯留�、對(duì)胃腸道蛋白酶的保護(hù)���、機(jī)械韌性、控制藥物釋放的能力�,以及敏感療法與賦形劑的共包封等優(yōu)勢(shì)。為了實(shí)現(xiàn)LIFT水凝膠�,使用了FDA批準(zhǔn)的或GRAS材料,采用藻酸鹽和四臂PEG-馬來(lái)酰亞胺作水凝膠網(wǎng)絡(luò)�����,以及CaCl2和二甲基亞砜或PEG-二硫醇作交聯(lián)劑�����。聚合物溶液保持為液體�����,直到與胃內(nèi)的交聯(lián)劑接觸�,觸發(fā)從液體到堅(jiān)韌水凝膠的轉(zhuǎn)變。
研究者證明�,在離體豬胃液以及豬和大鼠胃中,容易發(fā)生兩種聚合物網(wǎng)絡(luò)的交聯(lián)�����,這強(qiáng)調(diào)了交聯(lián)化學(xué)的穩(wěn)健性。雖然馬來(lái)酰亞胺硫醇反應(yīng)很快�����,但藻酸鹽的加入增強(qiáng)了LIFT水凝膠的機(jī)械性能���。此外���,它在鈣中的直接交聯(lián)起到了“支架”的作用,有助于較慢形成硫醚鍵的保持和交聯(lián)�����。研究者表明���,LIFT水凝膠通過(guò)延遲和降低最大藥物血漿濃度來(lái)改變藥代動(dòng)力學(xué)�����,同時(shí)實(shí)現(xiàn)與游離藥物相當(dāng)?shù)乃幬顰UC�。這一點(diǎn)很重要���,因?yàn)楦咚幬餄舛葧?huì)導(dǎo)致不良副作用并影響治療耐受性�����,并且適用于療效由AUC而非血液濃度決定的藥物(如四環(huán)素類藥物)���。
通過(guò)克服"瓶中造船"問(wèn)題,LIFT水凝膠可以擴(kuò)大吞咽固體困難患者獲得先進(jìn)療法的途徑���,并彌補(bǔ)固體和液體藥物制劑的優(yōu)勢(shì)�。研究者設(shè)想�,LIFT水凝膠及其柔性化學(xué)物質(zhì)可能是一種有用的策略,在胃藥物調(diào)節(jié)和遞送�����、減肥和膠囊生物制品的保護(hù)方面有著廣泛的應(yīng)用�。
文獻(xiàn)鏈接:https://www.nature.com/articles/s41563-024-01811-5