本文介紹了偏差處理在制藥行業(yè)應(yīng)用過(guò)程中的一些重點(diǎn)和難點(diǎn)事項(xiàng)。偏差處理流程一般包括偏差的發(fā)現(xiàn)與報(bào)告���、偏差分類���、偏差的根本原因調(diào)查、建立糾正措施與預(yù)防措施����。對(duì)此,本文推薦了一個(gè)選擇偏差調(diào)查主導(dǎo)部門(mén)的決策樹(shù)����,并推薦了一種偏差根本原因分析的四步法,指出當(dāng)發(fā)生重復(fù)偏差時(shí)重點(diǎn)應(yīng)調(diào)查為什么偏差會(huì)重復(fù)發(fā)生�。制藥企業(yè)預(yù)提高糾正措施與預(yù)防措施的有效性,需少采用被動(dòng)防錯(cuò)手段���,多采用主動(dòng)防錯(cuò)手段���。提升偏差處理成熟度是每個(gè)制藥企業(yè)提升的方向,這需要整個(gè)企業(yè)全體員工一起努力,提升企業(yè)質(zhì)量文化���,設(shè)置與偏差處理相關(guān)的績(jī)效指標(biāo)���,促進(jìn)企業(yè)持續(xù)發(fā)展。
偏差處理是《藥品生產(chǎn)質(zhì)量管理規(guī)范》(GMP)中強(qiáng)制要求藥品生產(chǎn)企業(yè)建立的管理流程����,該規(guī)范中強(qiáng)調(diào):各部門(mén)負(fù)責(zé)人應(yīng)當(dāng)確保所有人員正確執(zhí)行生產(chǎn)工藝、質(zhì)量標(biāo)準(zhǔn)���、檢驗(yàn)方法和操作規(guī)程���,防止偏差的產(chǎn)生 [1]。所以�,做好偏差處理的第一步應(yīng)是預(yù)防發(fā)生偏差,第二步才是發(fā)生偏差之后的處理���。當(dāng)前�,制藥行業(yè)在預(yù)防偏差發(fā)生方面做的工作普遍不充分�,對(duì)此,本文從偏差管理流程�、提高預(yù)防偏差管理水平、提升偏差管理成熟度角度進(jìn)行了闡述�,為行業(yè)提供了參考。
此外�,對(duì)于制藥企業(yè)來(lái)講,雖然在各個(gè)運(yùn)行的模塊出現(xiàn)偏差是不可避免的����,但是偏差處理的特別價(jià)值在于如何通過(guò)偏差調(diào)查出根本原因并且制定充分有效的預(yù)防措施,避免類似問(wèn)題再次發(fā)生�,進(jìn)而避免對(duì)企業(yè)將來(lái)的利益造成重復(fù)性的損害,這是從制藥企業(yè)管理利益方面出發(fā)對(duì)偏差的價(jià)值挖掘���。
1���、偏差處理流程
1.1偏差概述
偏差是指與批準(zhǔn)的指令或規(guī)定的標(biāo)準(zhǔn)的任何偏離 [2]。廣義的偏差包含偏差���、投訴���、退貨、檢驗(yàn)結(jié)果超標(biāo)及各種異常情況�;狹義的偏差單指偏離批準(zhǔn)的指令或規(guī)定的標(biāo)準(zhǔn)的情況,與投訴�、退貨����、檢驗(yàn)結(jié)果超標(biāo)及各種異常情況并列�,這些情況雖都屬于發(fā)生了偏離,但因這些情況都有其特性�,為方便管理,為其制定了專門(mén)的管理流程�。
透過(guò)偏差的定義,可以看出偏差處理的本質(zhì)在于處理那些企業(yè)有要求但是沒(méi)有達(dá)到要求的事件的風(fēng)險(xiǎn)�,這些問(wèn)題往往是突發(fā)的、非預(yù)期的�,需要調(diào)查分析原因和潛在風(fēng)險(xiǎn)。從風(fēng)險(xiǎn)控制角度以及對(duì)于企業(yè)自身管理來(lái)講�,為了能夠更加合理地處理這些不可預(yù)期的風(fēng)險(xiǎn),應(yīng)該將那些違背約定俗成的����、或者不可言喻的自然狀態(tài)的突發(fā)事件也列為偏差的行列,即使這些在企業(yè)的 SOP(標(biāo)準(zhǔn)操作規(guī)程)中沒(méi)有明確規(guī)定���,比如能源的突然中斷(停電����、停蒸汽等)�、設(shè)備故障�、某一個(gè)高級(jí)別的報(bào)警等����,或者其他 SOP 中預(yù)定了需要到何種程度需要啟動(dòng)偏差的情況�。
1.2偏差的發(fā)現(xiàn)與報(bào)告
發(fā)現(xiàn)偏差后應(yīng)將偏差報(bào)告給部門(mén)主管,按照制藥行業(yè)內(nèi)的通用做法����,此步驟有個(gè)報(bào)告時(shí)限的要求,行業(yè)內(nèi)通用的做法是要求 24 小時(shí)內(nèi)報(bào)告���,此 24 小時(shí)報(bào)告應(yīng)這樣理解:發(fā)現(xiàn)偏差后應(yīng)盡快口頭報(bào)告�,并在 24 小時(shí)內(nèi)將紙質(zhì)偏差報(bào)告給 QA(偏差管理員)����。
偏差報(bào)告的內(nèi)容包括偏差情況描述(偏差發(fā)生的時(shí)間、地點(diǎn)����、起因����、過(guò)程或發(fā)生的現(xiàn)象���、導(dǎo)致的結(jié)果等相關(guān)聯(lián)的信息)����,初步分析后得出的可能原因�,現(xiàn)場(chǎng)應(yīng)急措施,如果是產(chǎn)品或物料相關(guān)的偏差����,需指明品名、規(guī)格�、批號(hào)、數(shù)量等�。一個(gè)好的偏差報(bào)告描述至少應(yīng)包括 5W1H[3] :
When did something happen? 什么時(shí)候發(fā)生或發(fā)現(xiàn)的?
Where did it happen? 在什么地方發(fā)生的���?
Who was involved? 涉及的人員���?
What happened? 發(fā)生了什么事情����?
Why was it a deviation? 為什么它是偏差�?影響了什么?
How did it occur? 如何發(fā)生的���?
對(duì)于偏差的描述是否充分,有一個(gè)非常容易執(zhí)行的判斷標(biāo)準(zhǔn):將偏差描述拿給另外一個(gè)不了解此偏差背景的人審核�,如果他能夠輕松地看懂當(dāng)前的問(wèn)題,并且沒(méi)有針對(duì)描述提出額外的問(wèn)題���,這就是寫(xiě)好了���;如果審核人需要問(wèn)一系列的問(wèn)題才能夠了解清楚背景,這些提出的問(wèn)題就是偏差描述需要補(bǔ)充的內(nèi)容����。
1.3偏差分類
對(duì)于將偏差分為幾類,沒(méi)有法規(guī)的強(qiáng)制要求���,行業(yè)內(nèi)的通用做法是依據(jù)對(duì)產(chǎn)品質(zhì)量潛在影響的程度將偏差分為三類:重大偏差���、主要偏差����、次要偏差。筆者基于自身經(jīng)驗(yàn)�,建議在偏差管理流程中安排兩次偏差分類:
第一次:偏差管理員在收到偏差報(bào)告后進(jìn)行,基于偏差管理員的知識(shí)儲(chǔ)備和經(jīng)驗(yàn)����,依據(jù)偏差對(duì)產(chǎn)品質(zhì)量的影響程度進(jìn)行初步分類。
第二次:在偏差根本原因調(diào)查完成后進(jìn)行���,基于對(duì)偏差根本原因確定的范圍和偏差實(shí)際影響產(chǎn)品質(zhì)量的程度來(lái)確定偏差分類。此次分類作為偏差的最終分類����,因?yàn)榇藭r(shí)通過(guò)調(diào)查已將偏差影響的范圍和影響程度確定清楚了,偏差分類更準(zhǔn)確����。
第一次的偏差級(jí)別劃分主要是為了根據(jù)偏差的現(xiàn)狀���、已知的原因和風(fēng)險(xiǎn)判斷需要在偏差處理中投入的資源,比如需要參與調(diào)查的部門(mén)���、人員����、時(shí)間���、調(diào)查的深入和廣度等����。同時(shí)考慮在首次分級(jí)時(shí)����,已知的信息比較少,一般遵從“寧高勿低”的原則����,也就是如果不能準(zhǔn)確判定偏差是主要偏差還是次要偏差,就要判定為主要偏差�。
而第二次的偏差級(jí)別劃分就相對(duì)準(zhǔn)確�,因?yàn)榻?jīng)過(guò)了充分的調(diào)查和評(píng)估�,有充足的數(shù)據(jù)對(duì)級(jí)別劃分進(jìn)行支持,考慮上文提及的原則���,一般情況下第二次的分級(jí)不會(huì)高于第一次分級(jí)���,如果出現(xiàn)了第二次分級(jí)高于第一次分級(jí)的情況,這可能意味著需要對(duì)前面投入的調(diào)查和評(píng)估資源進(jìn)行重新評(píng)估�,需要確認(rèn)偏差調(diào)查是否存在不全面或者不充分的情況。
將偏差分類的管理方法�,本質(zhì)上是一種基于風(fēng)險(xiǎn)的管理方法。一個(gè)偏差����,如果被分類為次要偏差,一般不會(huì)對(duì)產(chǎn)品的質(zhì)量產(chǎn)生影響����,故可以將此類偏差的審批級(jí)別規(guī)定得低一些���,如:質(zhì)量保證經(jīng)理����;如果被分類為重大偏差或主要偏差,則要由質(zhì)量負(fù)責(zé)人進(jìn)行最終審批����。這樣可以讓質(zhì)量負(fù)責(zé)人集中精力去管理風(fēng)險(xiǎn)相對(duì)較高的重大偏差和主要偏差,提高整個(gè)公司的偏差管理效率�。
如果是受托生產(chǎn)企業(yè)發(fā)生了偏差,也建議基于不同偏差分類來(lái)與委托方協(xié)商共同管理好偏差的方法�,表1 提供了一種可以參考的方法。
表1 與委托方協(xié)商共同管理偏差的方式
1.4偏差的根本原因調(diào)查
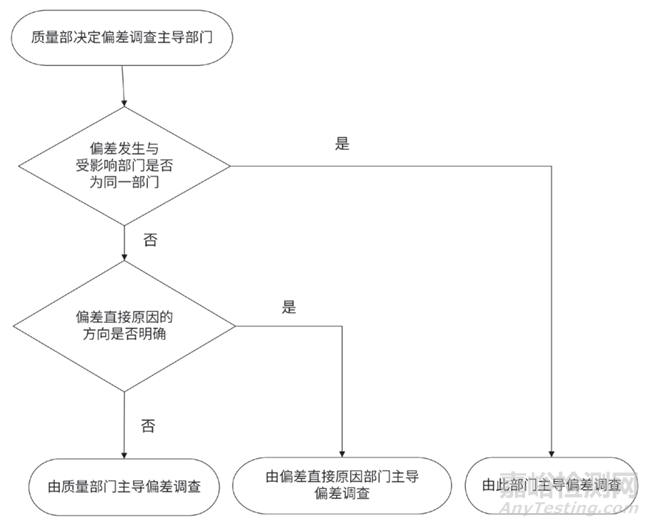
開(kāi)展偏差調(diào)查之前����,應(yīng)先選擇由哪個(gè)部門(mén)來(lái)主導(dǎo)偏差調(diào)查,當(dāng)前行業(yè)內(nèi)存在兩種不恰當(dāng)?shù)淖龇ǎ海?)所有偏差由偏差報(bào)告部門(mén)主導(dǎo)偏差調(diào)查����;(2)所有偏差均由質(zhì)量部門(mén)主導(dǎo)偏差調(diào)查。
選擇偏差調(diào)查主導(dǎo)部門(mén)的標(biāo)準(zhǔn)應(yīng)是哪個(gè)部門(mén)有利于偏差調(diào)查清楚就安排讓哪個(gè)部門(mén)來(lái)主導(dǎo)偏差調(diào)查����,這本質(zhì)上是一種知識(shí)管理,一定要讓了解此偏差相關(guān)知識(shí)的人參與到偏差調(diào)查過(guò)程中來(lái)�,例如:已經(jīng)明確偏差是由設(shè)備故障導(dǎo)致的���,因此應(yīng)該安排對(duì)此設(shè)備很了解的部門(mén)或人員來(lái)主導(dǎo)此偏差調(diào)查���,也就是安排承載了此設(shè)備相關(guān)知識(shí)的人來(lái)主導(dǎo)此偏差調(diào)查���。筆者推薦一個(gè)決策樹(shù)來(lái)協(xié)助選擇偏差調(diào)查主導(dǎo)部門(mén),如圖1 所示����。
圖1 偏差調(diào)查主導(dǎo)部門(mén)決策樹(shù)
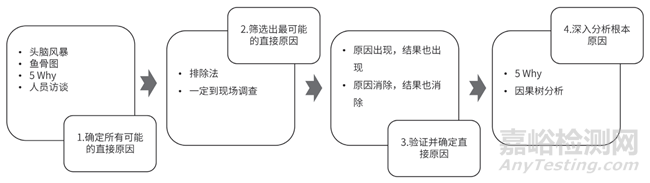
在開(kāi)展偏差根本原因調(diào)查過(guò)程中,最重要的是要梳理清楚分析的思路����,避免人為臆測(cè)原因。對(duì)此�,筆者推薦一種結(jié)構(gòu)化的方法:偏差根本原因分析四步法(如圖2 所示),其具體思路如下:
圖2 偏差根本原因分析四步法
(1) 確定所有可能的直接原因:此步驟應(yīng)客觀地收集所有可能導(dǎo)致偏差的可能因素����,盡量列全面,避免遺漏����,此步驟推薦的工具為:頭腦風(fēng)暴�、魚(yú)骨圖、“5 Why”和與相關(guān)人員訪談����。
(2) 篩選出最可能的直接原因:針對(duì)第一個(gè)步驟中列出的所有可能原因���,逐一排查,是否有證據(jù)證明不是此種因素導(dǎo)致的偏差����,如有證據(jù),則可排除掉����,如無(wú)證據(jù)暫時(shí)保留,最終可以篩選出一個(gè)或幾個(gè)最可能的直接原因�。
(3) 驗(yàn)證并確認(rèn)直接原因:針對(duì)第二個(gè)步驟中篩選出的最可能的直接原因,可以有針對(duì)性地設(shè)計(jì)一些假設(shè)性實(shí)驗(yàn)�,通過(guò)實(shí)驗(yàn)結(jié)果來(lái)確認(rèn)直接原因與偏差結(jié)果的關(guān)聯(lián)性,并確認(rèn)此偏差真正的直接原因����。但也有可能無(wú)法通過(guò)假設(shè)性實(shí)驗(yàn)來(lái)證明直接原因與偏差結(jié)果的關(guān)聯(lián)性,此時(shí)�,就將無(wú)法排除的因素均列為可能的原因。
(4) 深入分析根本原因:針對(duì)第三個(gè)步驟確定的直接原因進(jìn)行深入分析����,是否是在管理流程或組織制度上存在不足導(dǎo)致了偏差發(fā)生����,避免將偏差的根本原因確認(rèn)為人為錯(cuò)誤�。此步驟推薦的工具為:“5 Why”、因果樹(shù)分析���,此工具可以協(xié)助偏差調(diào)查者進(jìn)行深入地分析���,挖掘偏差產(chǎn)生的深層次原因。
當(dāng)前行業(yè)內(nèi)容易犯的錯(cuò)誤是將人為錯(cuò)誤定義為偏差發(fā)生的根本原因����。實(shí)際上,大多數(shù)人為錯(cuò)誤可能僅是偏差發(fā)生的直接原因�,故在調(diào)查過(guò)程中應(yīng)進(jìn)行深入挖掘,以下列舉了幾個(gè)可能導(dǎo)致人為錯(cuò)誤偏差的根本原因���,可供參考:
(1) 操作規(guī)程不適用���,員工不能遵守操作規(guī)程;
(2) 培訓(xùn)和考核流程不適用���,員工上崗前未獲得充分的培訓(xùn)與考核�;
(3) 員工不適合此項(xiàng)工作�,或工作量太大;
(4) 工藝流程的設(shè)計(jì)本身過(guò)于復(fù)雜或容易出錯(cuò)���;
(5) 工作環(huán)境不利于操作正確執(zhí)行����。
在 ISPE(國(guó)際制藥工程協(xié)會(huì))和PDA(美國(guó)注射劑協(xié)會(huì))2019 年 聯(lián)合發(fā)布的“Guide to Improving QualityCulture in Pharmaceutical ManufacturingFacilities(制藥企業(yè)質(zhì)量文化改進(jìn)指南)”中提出�,應(yīng)該對(duì)任何判定為人為因素的原因進(jìn)行更深入的分析。人為錯(cuò)誤不應(yīng)作為根本原因調(diào)查的結(jié)論����,而應(yīng)作為起點(diǎn)。人為錯(cuò)誤分析還應(yīng)包括對(duì)子團(tuán)隊(duì)���、工作組或組織文化的透徹理解或評(píng)估�。研究表明���,錯(cuò)誤發(fā)生的頻率因環(huán)境壓力或復(fù)雜性而增加�。一旦人為因素得到了很好的理解����,就可以采取諸如防錯(cuò)或相關(guān)工程解決方案之類的措施來(lái)減少人為錯(cuò)誤發(fā)生的可能性���。指南中所列人為錯(cuò)誤分析工具如下[4]:(1)防呆措施(Poka-Yoke);(2)人為因素及優(yōu)化流程���;(3)前因 - 行為 -后果(ABC) 模型的建立和分析���。
1.5重復(fù)偏差管理的重點(diǎn)
偏差的級(jí)別判定也要考慮偏差發(fā)生的重復(fù)性。一般將重復(fù)偏差定義為現(xiàn)象和根本原因都一致的偏差����。但是對(duì)于上文提及的第一次的偏差分級(jí),因?yàn)榭赡苓€未調(diào)查出根本原因���,所以在首次分級(jí)的時(shí)候�,需要判定是否“是可能的重復(fù)偏差”����,這時(shí)候一般只考慮偏差的現(xiàn)象即可。
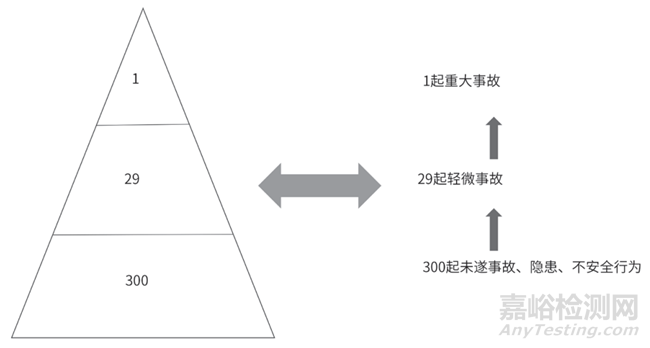
發(fā)生重復(fù)偏差時(shí)�,行業(yè)內(nèi)通用做法為:三個(gè)次要偏差升級(jí)為一個(gè)主要偏差,三個(gè)主要偏差升級(jí)為一個(gè)重大偏差�。這種管理方式是參考了海因里希安全法則,如圖3 所示。
圖3 海因里希安全法則
筆者認(rèn)為���,偏差升級(jí)管理并不是重復(fù)偏差管理的重點(diǎn)����,重點(diǎn)應(yīng)調(diào)查為什么會(huì)重復(fù)發(fā)生����。導(dǎo)致偏差重復(fù)發(fā)生只有兩種原因:(1)上次偏差調(diào)查時(shí)����,根本原因沒(méi)有確定準(zhǔn)確;(2)上次偏差制定的預(yù)防措施效果不好�。所以,針對(duì)重復(fù)偏差的調(diào)查����,應(yīng)重點(diǎn)關(guān)注這兩個(gè)方面,降低重復(fù)偏差發(fā)生的幾率����,提高偏差管理水平。
1.6偏差的糾正措施與預(yù)防措施
糾正措施指為消除已發(fā)現(xiàn)的不合格或其他不期望情況的原因所采取的措施����,預(yù)防措施指為消除潛在不合格或其他潛在不期望情況的原因所采取的措施�,有的公司還提出了“糾正”的概念����,指為消除已發(fā)現(xiàn)的不合格所采取的措施。這三個(gè)概念放在一起時(shí)容易混淆���,在此使用一個(gè)表格���,可以較為清晰地區(qū)分他們,見(jiàn)表2����。
表2 糾正、糾正措施及預(yù)防措施的區(qū)別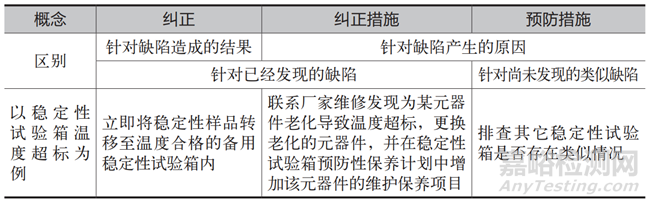
盡管表2 對(duì)糾正����、糾正措施、預(yù)防措施進(jìn)行了一定程度的區(qū)分�,但是在實(shí)際執(zhí)行過(guò)程中并不是特別容易準(zhǔn)確劃分某一個(gè)措施的屬性,而且如果每次都花一定的精力用于處理“名稱”的劃分����,并不是一個(gè)特別經(jīng)濟(jì)的做法�。只要保證了糾正措施和預(yù)防措施的充分性����、有效性,可以根據(jù)實(shí)際情況制定最適合企業(yè)的做法����。
在糾正措施與預(yù)防措施的制定過(guò)程中,除了需要參考調(diào)查出的直接原因���、根本原因、產(chǎn)生的影響之外���,還應(yīng)該針對(duì)影響偏差調(diào)查追溯性的因素進(jìn)行改進(jìn)����。比如某個(gè)無(wú)菌生產(chǎn)過(guò)程中出現(xiàn)了偏差���,在進(jìn)行分析時(shí)���,人員已經(jīng)記不清楚了當(dāng)時(shí)是如何操作的、做了哪些細(xì)節(jié)工作����,這樣就出現(xiàn)了影響偏差調(diào)查追溯性的情況���,基于這種情況,應(yīng)該在糾正措施與預(yù)防措施中增加一項(xiàng)措施�,提高再次出現(xiàn)類似問(wèn)題的調(diào)查追溯性,比如增加錄像裝置等�。
需要注意的是,考慮到調(diào)查過(guò)程的可追溯性����、導(dǎo)致偏差因素的偶發(fā)性等原因,并不是所有的偏差都能找到根本原因����,這個(gè)時(shí)候需要列出可能的原因,并且針對(duì)可能的原因進(jìn)行糾正和預(yù)防�。
2、提高糾正措施與預(yù)防措施的有效性
如何提高糾正措施與預(yù)防措施的有效性����、降低偏差發(fā)生的概率是每個(gè)制藥企業(yè)都需要考慮的事情�,這與糾正措施與預(yù)防措施制定的具體內(nèi)容密切相關(guān),如果一個(gè)企業(yè)培訓(xùn)所占糾正措施與預(yù)防措施比例較高�,很可能意味著這個(gè)企業(yè)的糾正措施與預(yù)防措施有效性較低���。
那么如何提高糾正措施與預(yù)防措施的有效性呢?筆者的建議是少采用被動(dòng)防錯(cuò)手段���,多采用主動(dòng)防錯(cuò)手段����。被動(dòng)防錯(cuò)手段一般包括培訓(xùn)���、顏色區(qū)分���、聲光報(bào)警等,主動(dòng)防錯(cuò)手段一般包括使用自動(dòng)設(shè)備代替手工操作�、自動(dòng)停機(jī)、自動(dòng)剔除等�。
在制定糾正措施與預(yù)防措施的策略上,不同防錯(cuò)策略所達(dá)到的效果也會(huì)不同����,建議優(yōu)先選擇消除����、替代���、簡(jiǎn)化和檢測(cè)�,表3 比較了不同防錯(cuò)策略的效果。
表3 不同防錯(cuò)策略的效果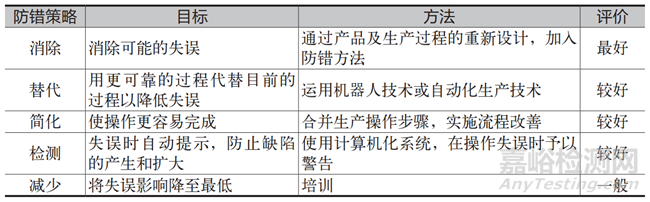
3�、提升偏差處理成熟度
預(yù)提高企業(yè)內(nèi)偏差管理水平,提升偏差處理成熟度���,建議從以下幾個(gè)方面做工作:
(1)高層管理者重視質(zhì)量����,提高企業(yè)文化和質(zhì)量文化氛圍���,企業(yè)所有員工具有主動(dòng)發(fā)現(xiàn)和報(bào)告偏差的動(dòng)力�,不瞞報(bào)���。
(2)為偏差管理設(shè)置績(jī)效指標(biāo),使偏差管理水平與員工績(jī)效掛鉤����,全體員工共同推進(jìn)偏差管理水平的提升,可參考的績(jī)效指標(biāo)如下:
①偏差調(diào)查關(guān)閉時(shí)限:從開(kāi)始調(diào)查至調(diào)查結(jié)束的平均時(shí)間���,反映了企業(yè)偏差調(diào)查的效率。
②重復(fù)偏差發(fā)生率:重復(fù)發(fā)生的偏差數(shù)量占總偏差數(shù)量的比率�,此比率越高,反映了重復(fù)偏差數(shù)量越多���,應(yīng)重點(diǎn)關(guān)注這些偏差的根本原因分析�,并采取效果更好的預(yù)防措施���。
③未找到根本原因的偏差率:未找到根本原因的偏差占總偏差數(shù)量的比率���,反映了企業(yè)應(yīng)加強(qiáng)根本原因調(diào)查,需引入一些根本原因調(diào)查工具和調(diào)查技巧的培訓(xùn)���。
④人為錯(cuò)誤偏差率:原因定義為人為錯(cuò)誤的偏差占總偏差數(shù)量的比率�,人為錯(cuò)誤偏差比率高反映了企業(yè)根本原因調(diào)查不準(zhǔn)確,只停留在了人為錯(cuò)誤的直接原因�,需要進(jìn)一步深入挖掘根本原因���。
⑤批次一次合格率:未出現(xiàn)任何偏差�、檢驗(yàn)結(jié)果超標(biāo)、異常等情況的批次占所有生產(chǎn)批次的比率����,此比率越高����,企業(yè)的綜合質(zhì)量管理水平越好����。
(3)每年開(kāi)展偏差總結(jié)���,可從不同維度進(jìn)行偏差總結(jié)����,以獲得一些改進(jìn)提升的方向:近三年不同分類偏差比例分析���、近三年偏差發(fā)生的根本原因類別比例分析、近三年不同部門(mén)偏差數(shù)量比例分析���、近三年不同產(chǎn)品偏差發(fā)生比例分析����。
參考文獻(xiàn)
[1] 中華人民共和國(guó)衛(wèi)生部 . 藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)[EB/OL].(2011-01-17)����,https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_d5e1dbaa8f284277a5f6c3e2fc840d00.html.
[2]ICH.Q7 Good Manufacturing PracticeGuide for Active PharmaceuticalIngredients [EB/OL].(2015-06-10).https://database.ich.org/sites/default/files/Q7%20Guideline.pdf.
[3]PDA.Root Cause Investigations forCAPA: Clear and Simple[J](2020-06). https://www.pda.org/bookstore/product-detail/5724-capa.
[4]ISPE, PDA. Guide to ImprovingQuality Culture in PharmaceuticalManufacturing Facilities[J].2019.https://ispe.org/initiatives/regulatory/quality-culture.
本文作者鄭文科�、張磊����,北京金瑞博企業(yè)咨詢服務(wù)有限公司�,僅供交流學(xué)習(xí)����。