引言
2020年3月�����,國際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇 (International Medical Device Regulators Forum, IMDRF)組織下設(shè)個(gè)性化醫(yī)療器械(personalized medical device, PMD)工作組制定并發(fā)布《個(gè)性 化醫(yī)療器械監(jiān)管路徑》指南(Personalized Medical Devices-Regulatory Pathways)(以下簡(jiǎn)稱《指南》)����,這是繼2018年工作組發(fā)布《個(gè)性化醫(yī)療器械術(shù)語》指南后,對(duì)個(gè)性化醫(yī)療器械監(jiān)管路徑和要求進(jìn)行全球范圍內(nèi)的規(guī)范和統(tǒng)一[1]的又一成果����。近3年來,新型冠狀病毒疫情席卷全球����,對(duì)各國和地區(qū)的醫(yī)療保障體系提出了挑戰(zhàn)。2022年����,PMD工作組結(jié)合疫情以來的臨床實(shí)踐和需求,組織對(duì)《指南》進(jìn)行了修訂��,并于2023年發(fā)布����,本研究全面闡述《指南》制修訂的背景和內(nèi)容,包括個(gè)性化醫(yī)療器械不同類型的監(jiān)管模式����,醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的不同監(jiān)管路徑,以及在我國實(shí)施監(jiān)管的可行性分析����,共同探討個(gè)性化醫(yī)療器械未來監(jiān)管對(duì)策。
1�����、 IMDRF個(gè)性化醫(yī)療器械監(jiān)管路徑
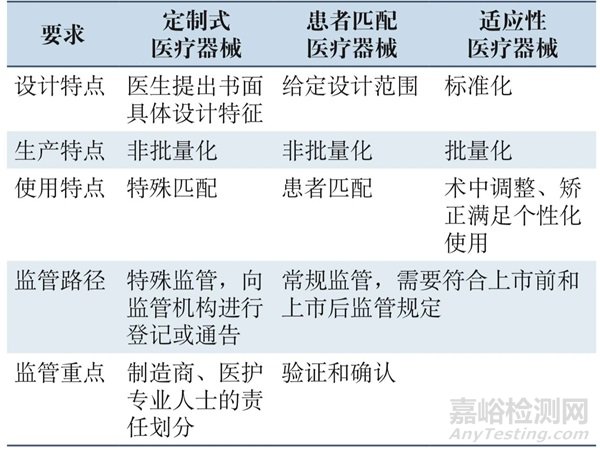
《個(gè)性化醫(yī)療器械術(shù)語》指南明確了個(gè)性化醫(yī)療器械分為定制式醫(yī)療器械��、患者匹配醫(yī)療器械和適應(yīng)性醫(yī)療器械�����,3種類型產(chǎn)品研發(fā)和生產(chǎn)的個(gè)性化程度依次降低[2],對(duì)醫(yī)療器械產(chǎn)品的風(fēng)險(xiǎn)也有不同的影響��。根據(jù)《醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》(GB/T 42062—2022)��,風(fēng)險(xiǎn)是傷害發(fā)生概率和嚴(yán)重度的組合��。醫(yī)療器械產(chǎn)品是關(guān)乎生命健康和公共安全的特殊商品��,其風(fēng)險(xiǎn)不僅來自產(chǎn)品本身����,還存在著監(jiān)管風(fēng)險(xiǎn),如監(jiān)管缺位可能導(dǎo)致產(chǎn)品風(fēng)險(xiǎn)未能得到良好的控制��,從而引發(fā)系統(tǒng)性風(fēng)險(xiǎn)����。醫(yī)療器械產(chǎn)品的管理類別、監(jiān)管經(jīng)驗(yàn)和監(jiān)管手段很大程度決定了監(jiān)管風(fēng)險(xiǎn)�����。對(duì)于尚無監(jiān)管經(jīng)驗(yàn)或僅有少量監(jiān)管經(jīng)驗(yàn)的醫(yī)療產(chǎn)品�����,需要透過現(xiàn)象看本質(zhì),抓住醫(yī)療器械新工藝��、新方法��、新產(chǎn)品的關(guān)鍵風(fēng)險(xiǎn)點(diǎn)�����,從而更好地識(shí)別并降低風(fēng)險(xiǎn)�����,創(chuàng)新監(jiān)管模式��。
對(duì)于患者匹配醫(yī)療器械和適應(yīng)性醫(yī)療器械��,雖然具有個(gè)性化特征��,但仍是基于普適人群范圍內(nèi)的個(gè)體差異��,其臨床使用的數(shù)量較多�����,足以開展具有統(tǒng)計(jì)學(xué)意義的臨床研究����。因此與標(biāo)準(zhǔn)化、批量化生產(chǎn)醫(yī)療器械類似����,其可以通過常規(guī)的醫(yī)療器械監(jiān)管模式進(jìn)行監(jiān)管,即需要符合醫(yī)療器械注冊(cè)����、生產(chǎn)、經(jīng)營和使用等相關(guān)監(jiān)管要求�����。對(duì)于常規(guī)監(jiān)管模式��,監(jiān)管責(zé)任明晰��、監(jiān)管手段多樣�����,產(chǎn)品可能產(chǎn)生的傷害嚴(yán)重程度較低����,但考慮其使用數(shù)量相對(duì)較大�����,傷害發(fā)生的概率可能較高�����。
對(duì)于定制式醫(yī)療器械����,鑒于其主要用于滿足無器械可用的特殊臨床需求��,例如特殊解剖結(jié)構(gòu)����、過大或過小骨骼尺寸的情形等����,因此其臨床使用數(shù)量極為有限,無法開展充分的臨床研究�����,產(chǎn)品安全和有效性的驗(yàn)證和確認(rèn)難以按照傳統(tǒng)方法開展�����,從而造成潛在風(fēng)險(xiǎn)較高。但是����,定制式器械仍具有較大的臨床價(jià)值。定制式醫(yī)療器械的特點(diǎn)決定其需要采取特殊監(jiān)管模式��,強(qiáng)調(diào)專業(yè)醫(yī)護(hù)人員在醫(yī)療器械全生命周期風(fēng)險(xiǎn)控制中的重要作用��,明確醫(yī)護(hù)人員在定制式器械的需求����、設(shè)計(jì)方案的確認(rèn)、臨床使用中反饋的職責(zé)����。需要注意的是,醫(yī)護(hù)人員和制造商有責(zé)任提供證明定制式器械安全性和有效性的研究資料和控制措施(包括計(jì)算機(jī)建模和模擬 等方法)��,并明確不符合常規(guī)要求之處和仍可安全使用的理由(見表1)��。除了上述內(nèi)容外��,《指 南》還列出了對(duì)于制造商和產(chǎn)品的具體要求,如生 產(chǎn)和記錄保存�����、上市后監(jiān)督��、糾正措施和不良事件 報(bào)告�����。
表1 不同個(gè)性化醫(yī)療器械的特點(diǎn)和監(jiān)管要求對(duì)比 Tab.1 Characteristics and regulatory requirements of different personalized medical devices
我國于2019年發(fā)布了《定制式醫(yī)療器械監(jiān)督管理規(guī)定(試行)》����,后又陸續(xù)出臺(tái)《無源植入性骨、關(guān)節(jié)及口腔硬組織個(gè)性化增材制造醫(yī)療器械注冊(cè)技術(shù)審查指導(dǎo)原則》《3D打印髖臼杯產(chǎn)品注冊(cè)技術(shù)審查指導(dǎo)原則》《增材制造聚醚醚酮植入物注冊(cè)審查指導(dǎo)原則》等多項(xiàng)規(guī)范性文件�����,均充分參考了IMDRF《指南》中關(guān)于個(gè)性化醫(yī)療器械的監(jiān)管要求����,并結(jié)合我國醫(yī)療器械監(jiān)管實(shí)際����,從而使我國和國際監(jiān)管要求保持了高度的一致性。
2����、 醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的監(jiān)管模式
增材制造簡(jiǎn)化了生產(chǎn)流程����,實(shí)現(xiàn)了個(gè)性化醫(yī)療器械在醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)����,也讓醫(yī)療器械監(jiān)管部門的監(jiān)管對(duì)象從傳統(tǒng)的制造商向醫(yī)療機(jī)構(gòu)延伸?����!吨改稀犯戒浱接懥酸t(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的監(jiān)管模式�����,具體可分為3種模式:全面監(jiān)管(fully regulated manufacturing)����、特殊監(jiān)管(manufacturing under special arrangements)和在醫(yī)療機(jī)構(gòu)內(nèi)采用醫(yī)療器械生產(chǎn)系統(tǒng)(medical device production system, MDPS)生產(chǎn)的監(jiān)管。
2.1 醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的全面監(jiān)管
如果醫(yī)療機(jī)構(gòu)可以按照傳統(tǒng)制造商的要求構(gòu)建質(zhì)量管理體系��,那么監(jiān)管機(jī)構(gòu)可以按照監(jiān)管制造商的方式監(jiān)管醫(yī)療機(jī)構(gòu)�����,即醫(yī)療機(jī)構(gòu)需要符合醫(yī)療器械所需全生命周期的相關(guān)法律法規(guī),并達(dá)到產(chǎn)品上市前和上市后的監(jiān)管要求��。此時(shí)�����,醫(yī)療機(jī)構(gòu)也可以取得醫(yī)療器械上市批件����。
2.2 醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的特殊監(jiān)管
醫(yī)療機(jī)構(gòu)的主要職能是從事疾病診斷、治療活動(dòng)����,而非生產(chǎn)醫(yī)療器械,并非所有醫(yī)療機(jī)構(gòu)都可按照上述要求建立全面質(zhì)量管理體系�����,但在物資緊缺的現(xiàn)實(shí)情況下�����,醫(yī)療機(jī)構(gòu)會(huì)存在就地取材生產(chǎn)和使用的情形�����。所以�����,國際上部分國家和地區(qū)采取了特殊的監(jiān)管框架(豁免條款或特殊條款)以滿足特定機(jī)構(gòu)或其附屬/合作醫(yī)療機(jī)構(gòu)內(nèi)的臨床需求��。醫(yī)療機(jī)構(gòu)需要在適當(dāng)?shù)捏w系下進(jìn)行醫(yī)療器械生產(chǎn)和使用����,并向監(jiān)管部門進(jìn)行備案。
2.3 醫(yī)療機(jī)構(gòu)內(nèi)采用MDPS生產(chǎn)醫(yī)療器械的監(jiān)管
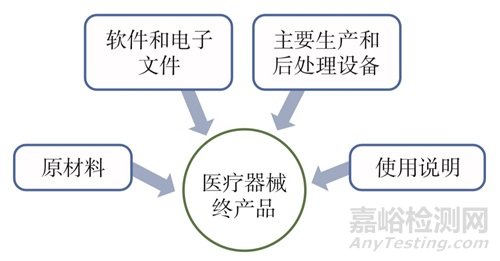
MDPS是IMDRF提出的新概念�����,指“包括醫(yī)療器械終產(chǎn)品和醫(yī)療器械生產(chǎn)過程要素(medical device production process, MDPP)的整個(gè)系統(tǒng)”�����。其中��,醫(yī)療器械生產(chǎn)過程要素包括原材料�����、軟件和電子文件、主要生產(chǎn)設(shè)備和后處理設(shè)備以及使用說明����,醫(yī)療器械生產(chǎn)系統(tǒng)框架,如圖1所示����。醫(yī)療器械生產(chǎn)系統(tǒng)符合IMDRF相關(guān)要求中以“盒(kit)”或“系統(tǒng)(system)”申報(bào)的醫(yī)療器械定義,即“包括多個(gè)組件或附件的醫(yī)療器械在內(nèi)的產(chǎn)品包裝在一起�����,共同實(shí)現(xiàn)同一預(yù)期用途”����,例如手術(shù)器械系統(tǒng)。
圖1 醫(yī)療器械生產(chǎn)系統(tǒng)框架
Fig.1 Medical device production system flowchart
IMDRF的“制造商”定義同樣適用于醫(yī)療器械生產(chǎn)系統(tǒng)(MDPS)的制造商����。在醫(yī)療器械生產(chǎn)系統(tǒng)定義中,原本作為醫(yī)療器械生產(chǎn)工具使用的原材料����、軟件��、電子文件及設(shè)備,以及預(yù)期生產(chǎn)的特定醫(yī)療器械終產(chǎn)品都成為醫(yī)療器械生產(chǎn)系統(tǒng)的組成部分����。醫(yī)療器械生產(chǎn)系統(tǒng)(MDPS)的制造商可以將MDPS不同組件外包給組件制造商,但其對(duì)整個(gè)MDPS以及該系統(tǒng)生產(chǎn)的醫(yī)療器械終產(chǎn)品負(fù)責(zé)��。表2中進(jìn)一步對(duì)比分析了原材料����、軟件、電子文件����、生產(chǎn)設(shè)備等生產(chǎn)過程要素(MDPP)在傳統(tǒng)醫(yī)療器械監(jiān)管框架和醫(yī)療器械生產(chǎn)系統(tǒng)監(jiān)管框架下的差異。
表2 醫(yī)療器械生產(chǎn)過程要素在傳統(tǒng)醫(yī)療器械監(jiān)管框架 和醫(yī)療器械生產(chǎn)系統(tǒng)監(jiān)管框架中的對(duì)比
Tab.2 Comparison of regulatory framework between traditional medical device and the medical device production system
引入“醫(yī)療器械生產(chǎn)系統(tǒng)”的最大變化是醫(yī)療器械制造商的職責(zé)從生產(chǎn)醫(yī)療器械變?yōu)樘峁┙?jīng)過驗(yàn)證及確認(rèn)的生產(chǎn)過程要素;而醫(yī)療機(jī)構(gòu)的職責(zé)從僅使用醫(yī)療器械轉(zhuǎn)變?yōu)樯a(chǎn)和使用��。從制造商的角度出發(fā)��,除了不再實(shí)質(zhì)生產(chǎn)醫(yī)療器械終產(chǎn)品����,需要完成的驗(yàn)證和確認(rèn)工作并沒有減少,特別是需要在使用說明中明確預(yù)期生產(chǎn)需要達(dá)到的環(huán)境����、條件和人員能力要求并定期參與生產(chǎn)過程要素的升級(jí)和維護(hù)�����。而對(duì)于醫(yī)療機(jī)構(gòu)來說����,嚴(yán)格按照經(jīng)驗(yàn)證的操作方法�����、在經(jīng)驗(yàn)證的適用范圍內(nèi)進(jìn)行生產(chǎn)是新的挑戰(zhàn)����。
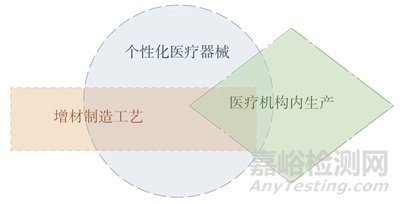
考慮到MDPS的運(yùn)行風(fēng)險(xiǎn),《指南》指出各個(gè)國家和地區(qū)的醫(yī)療器械監(jiān)管部門可以限制MDPS框架下適用的醫(yī)療器械管理類別����,例如僅限定在低風(fēng)險(xiǎn)醫(yī)療器械中應(yīng)用、可以強(qiáng)制要求MDPS使用機(jī)構(gòu)進(jìn)行認(rèn)證�����。需要關(guān)注的是��,關(guān)于醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的監(jiān)管模式并不限于增材制造或個(gè)性化醫(yī)療器械��,可以適用于所有醫(yī)療器械類型?����!吨改稀分袀€(gè)性化醫(yī)療器械�����、增材制造工藝和醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)的關(guān)系如圖2所示�����。
圖2 《指南》中個(gè)性化醫(yī)療器械�����、增材制造工藝和醫(yī)療 機(jī)構(gòu)內(nèi)生產(chǎn)的關(guān)系
Fig.2 Relationship between personalized medical devices, additive manufacturing process and production in medical institutions in the guide
3�����、 醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的監(jiān)管實(shí)施可 行性分析
在我國��,醫(yī)療機(jī)構(gòu)是指“從事疾病診斷����、治療活動(dòng)的醫(yī)院、衛(wèi)生院��、療養(yǎng)院�����、門診部��、診所�����、衛(wèi)生所(室)以及急救站等醫(yī)療機(jī)構(gòu)”[3]�����。醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械應(yīng)該以更好地輔助機(jī)構(gòu)內(nèi)救死扶傷����、防病治病為目的,而不是以為市場(chǎng)提供醫(yī)療產(chǎn)品為目的����。以下將針對(duì)《指南》中提出的醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械的監(jiān)管模式在我國實(shí)施的可行性進(jìn)行分析和討論。
3.1 全面監(jiān)管下生產(chǎn)醫(yī)療器械的可行性分析
2000年頒布實(shí)施的《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院276號(hào)令)第十條指出“醫(yī)療機(jī)構(gòu)根據(jù)本單位的臨床需要,可以研制醫(yī)療器械�����,在執(zhí)業(yè)醫(yī)師指導(dǎo)下在本單位使用����。醫(yī)療機(jī)構(gòu)研制的第二類醫(yī)療器械��,應(yīng)當(dāng)報(bào)省級(jí)以上人民政府藥品監(jiān)督管理部門審查批準(zhǔn);醫(yī)療機(jī)構(gòu)研制的第三類醫(yī)療器械�����,應(yīng)當(dāng)報(bào)國務(wù)院藥品監(jiān)督管理部門審查批準(zhǔn)[4]”����。但是實(shí)際工作中并未得到有效的落實(shí)。
對(duì)于醫(yī)療機(jī)構(gòu)在全過程監(jiān)管下生產(chǎn)����,首先要滿足醫(yī)療機(jī)構(gòu)作為醫(yī)療器械生產(chǎn)企業(yè)的基本要求,而不僅僅作為使用單位的要求��。IMDRF監(jiān)管框架遵循國際通用要求��,其制造商概念可以指設(shè)計(jì)、生產(chǎn)��、構(gòu)建����、組裝或者加工一種醫(yī)療器械終產(chǎn)品的自然人或法人。在我國醫(yī)療器械監(jiān)管法規(guī)體系中����,2021年新修訂的《醫(yī)療器械監(jiān)督管理?xiàng)l例》明確了從事醫(yī)療器械生產(chǎn)活動(dòng)應(yīng)具備“人員和環(huán)境、檢驗(yàn)檢測(cè)�����、質(zhì)量管理����、售后服務(wù)、文件要求”5個(gè)方面條件[6]�����。由此可見����,通常作為醫(yī)療器械使用單位的醫(yī)療機(jī)構(gòu)想要建立和持續(xù)運(yùn)行上述生產(chǎn)質(zhì)量體系需要投入大量的人力和物力,從體制機(jī)制、管理運(yùn)行��、監(jiān)管審計(jì)等各方面都有一定難度�����。但是不難看出����,如果按照全面監(jiān)管下生產(chǎn),醫(yī)療機(jī)構(gòu)承擔(dān)了醫(yī)療器械全生命周期的管理����,從監(jiān)管角度看風(fēng)險(xiǎn)相對(duì)較小�����。
在藥品監(jiān)管實(shí)踐中��,“醫(yī)療機(jī)構(gòu)制劑”已有30年以上的監(jiān)管經(jīng)驗(yàn)����。醫(yī)療機(jī)構(gòu)制劑相關(guān)法規(guī)最早可追溯至1984年頒布的《中華人民共和國藥品管理法》。為進(jìn)一步規(guī)范醫(yī)療機(jī)構(gòu)制劑配置和注冊(cè)管理��,原國家食藥監(jiān)局于2005年頒布實(shí)施《醫(yī)療機(jī)構(gòu)制劑配置監(jiān)督管理辦法(試行)》《醫(yī)療機(jī)構(gòu)制劑注冊(cè)管理辦法(試行)》明確,醫(yī)療機(jī)構(gòu)制劑是指 “醫(yī)療機(jī)構(gòu)根據(jù)本單位臨床需要經(jīng)批準(zhǔn)而配制�����、自用的固定處方制劑”����,并對(duì)其配制、調(diào)劑使用�����、審批�����、檢驗(yàn)和監(jiān)督管理做出了詳細(xì)規(guī)定[7]����。截至2012年底,全國醫(yī)療機(jī)構(gòu)制劑批準(zhǔn)文號(hào)就達(dá)50781個(gè)[8]�����。根據(jù)國家藥事管理專業(yè)質(zhì)控中心在2019年開展的調(diào)研結(jié)果顯示��,在全國4 639家醫(yī)院中,設(shè)立制劑室的醫(yī)院占8.15%�����,具有制劑批準(zhǔn)文號(hào)的醫(yī)院占9.36%�����。在有制劑批準(zhǔn)文號(hào)的醫(yī)院中�����,擁有中藥制劑的占比最高(73.66%)�����,其次為普通化學(xué)制劑(69.93%)[9]����。醫(yī)療機(jī)構(gòu)制劑的概念與醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械有一定的相似性�����,可以充分參考醫(yī)療機(jī)構(gòu)制劑的實(shí)際監(jiān)管經(jīng)驗(yàn)�����,例如對(duì)化藥制劑和中藥制劑實(shí)施差異化管理,發(fā)布實(shí)施鼓勵(lì)中藥制劑的政策等[8]����。
3.2 特殊監(jiān)管下生產(chǎn)的可行性分析
人體硬組織因人而異,許多口腔用醫(yī)療器械具有個(gè)性化屬性����。例如,定制式義齒通常采用金屬����、陶瓷、樹脂等材料加工而成����,用于治療牙齒缺損、牙列缺損或缺失�����。雖然其名稱中包含“定制式”��,但實(shí)質(zhì)屬于個(gè)性化醫(yī)療器械中的患者匹配醫(yī)療器械�����,需要根據(jù)患者的影像學(xué)數(shù)據(jù)進(jìn)行個(gè)性化設(shè)計(jì)和生產(chǎn)。定制式義齒是我國最早被納入監(jiān)管的個(gè)性化醫(yī)療器械之一��,其產(chǎn)業(yè)發(fā)展迅速�����,截至2020年底�����,我國定制式義齒生產(chǎn)企業(yè)約有2 037家��,數(shù)量約占所有醫(yī)療器械生產(chǎn)企業(yè)的7.7%[10]����。在我國,定制式義齒成品和定制式義齒加工用材料都作為醫(yī)療器械進(jìn)行監(jiān)管��,且都不低于第二類醫(yī)療器械��。義齒用材料獲批上市后����,一部分會(huì)在醫(yī)療器械生產(chǎn)企業(yè)中用于義齒的生產(chǎn),另一部分在口腔醫(yī)院內(nèi)的義齒加工中心或口腔技工室進(jìn)一步制作成成品��,即定制式義齒����。考慮到醫(yī)療機(jī)構(gòu)內(nèi)加工中心屬于醫(yī)療機(jī)構(gòu)內(nèi)的一個(gè)部門����,且使用的是經(jīng)過批準(zhǔn)的醫(yī)療器械材料開展生產(chǎn),具有一定的特殊性��,如果按照《指南》給出的監(jiān)管分類����,可以歸類為特殊監(jiān)管下生產(chǎn)。針對(duì)定制式義齒����,根據(jù)《關(guān)于加強(qiáng)定制式義齒生產(chǎn)監(jiān)管的通知》,醫(yī)療機(jī)構(gòu)所屬的口腔技工室加工定制式義齒產(chǎn)品僅供本單位使用�����,并應(yīng)建立與其相適應(yīng)的質(zhì)量管理體系��,并保持有效運(yùn)行。但是��,如果該醫(yī)療機(jī)構(gòu)接受其他醫(yī)療機(jī)構(gòu)委托生產(chǎn)定制式義齒����,應(yīng)取得相應(yīng)的生產(chǎn)許可和產(chǎn)品注冊(cè)證書[11]。
國家藥品監(jiān)督管理局和國家衛(wèi)健委聯(lián)合發(fā)布的《定制式醫(yī)療器械監(jiān)督管理規(guī)定(試行)》中明確了醫(yī)療機(jī)構(gòu)作為定制式醫(yī)療器械的共同備案人之一����,在定制式產(chǎn)品研制、使用過程中的職責(zé)����。這種情形下亦屬于《指南》中的特殊監(jiān)管下生產(chǎn)的情形。
特殊監(jiān)管模式僅適用于特定產(chǎn)品類別或特殊臨床情形����,并不具有普適性,且范圍不宜擴(kuò)大����。
3.3 按照MDPS模式監(jiān)管的可行性
采用MDPS模式監(jiān)管,存在兩方面的新增風(fēng)險(xiǎn)��。一是擴(kuò)大了當(dāng)前我國醫(yī)療器械定義的范圍��。藥品監(jiān)管部門主要負(fù)責(zé)醫(yī)療器械終產(chǎn)品的監(jiān)管�����,除了口腔充填修復(fù)材料��、義齒制作材料����、口腔治療輔助材料等口腔科材料(可在臨床診療中加工成義齒等用于患者)一直按照醫(yī)療器械管理外,其他原材料均不作為醫(yī)療器械管理��。而在MDPS監(jiān)管模式下����,原本不作為醫(yī)療器械管理的醫(yī)療器械原材料、軟件及設(shè)備均納入了監(jiān)管范疇����,是對(duì)當(dāng)前醫(yī)療器械監(jiān)管范圍、思路的一個(gè)重大調(diào)整��。二是醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)過程質(zhì)量控制和監(jiān)管風(fēng)險(xiǎn)問題�����。對(duì)于使用醫(yī)療器械生產(chǎn)系統(tǒng)進(jìn)行生產(chǎn),從形 式上看醫(yī)療機(jī)構(gòu)不體現(xiàn)在注冊(cè)證上�����,名義上非生產(chǎn)企業(yè)��,但實(shí)質(zhì)上醫(yī)療機(jī)構(gòu)使用醫(yī)療器械注冊(cè)人經(jīng)注冊(cè)獲批的醫(yī)療器械生產(chǎn)系統(tǒng)����、按照經(jīng)驗(yàn)證的操作方法進(jìn)行生產(chǎn)活動(dòng)、生產(chǎn)經(jīng)批準(zhǔn)的醫(yī)療器械����。此時(shí),醫(yī)療器械注冊(cè)人提供的不是醫(yī)療器械終產(chǎn)品����,而是醫(yī)療器械生產(chǎn)過程所需的設(shè)備和物料,以及經(jīng)驗(yàn)證的生產(chǎn)過程��。MDPS模式使注冊(cè)人從原本的醫(yī)療器械終產(chǎn)品生產(chǎn)者變?yōu)樯a(chǎn)要素供應(yīng)商����,醫(yī)療機(jī)構(gòu)變成了終產(chǎn)品實(shí)際生產(chǎn)者和使用單位����。其實(shí)這種情況在醫(yī)療器械領(lǐng)域并不是首次出現(xiàn)�����,許多醫(yī)療器械需要由醫(yī)務(wù)人員按照產(chǎn)品說明書在術(shù)中進(jìn)行攪拌混合����、組裝和塑形��,即使操 作相對(duì)簡(jiǎn)單��,這些步驟從某種角度可被視為醫(yī)療器械的再加工活動(dòng)��。其實(shí)這種情形在生活中也比比皆是�����,例如購買組裝成型家具和需要自組裝的家具�����、購買蛋糕成品或蛋糕原料套裝自己制作��,當(dāng)然這里存在較大區(qū)別即醫(yī)療器械是醫(yī)療產(chǎn)品,屬于特殊商品����,如出現(xiàn)不良后果將造成致命的傷害。從醫(yī)療機(jī)構(gòu)角度來說����,采用MDPS生產(chǎn)醫(yī)療器械終產(chǎn)品的過程較術(shù)中進(jìn)行攪拌混合、組裝和塑形等更為復(fù)雜��,生產(chǎn)過程質(zhì)量控制要求更高�����,從而引入更高的風(fēng)險(xiǎn)����。從監(jiān)管角度來說,采用MDPS生產(chǎn)醫(yī)療器械終產(chǎn)品模式下����,醫(yī)療器械注冊(cè)人和實(shí)際生產(chǎn)者分離,且實(shí)際生產(chǎn)者尚未納入監(jiān)管范疇�����。而且這種情形與注冊(cè)人制度的注冊(cè)人和委托 生產(chǎn)亦有所不同,注冊(cè)人制度中的每個(gè)批準(zhǔn)產(chǎn)品的注冊(cè)人和委托生產(chǎn)企業(yè)是唯一確定的��,且均作為監(jiān)管對(duì)象;但在醫(yī)療器械生產(chǎn)系統(tǒng)下醫(yī)療機(jī)構(gòu)并不限定于某一家����,理論上符合相關(guān)質(zhì)量體系要求的醫(yī)療機(jī)構(gòu)都可以采用醫(yī)療器械生產(chǎn)系統(tǒng)生產(chǎn)終產(chǎn)品,但MDPS監(jiān)管模式尚未將醫(yī)療機(jī)構(gòu)作為被監(jiān)管對(duì)象��,因此可能帶來監(jiān)管缺位的風(fēng)險(xiǎn)��。當(dāng)然�����,IMDRF也認(rèn)同可以對(duì)MDPS的適用的產(chǎn)品類別范圍進(jìn)行限定或增加醫(yī)療機(jī)構(gòu)準(zhǔn)入門檻��,以最大限度降低風(fēng)險(xiǎn)��。但是����,如果增加過多限定要求將會(huì)失去該途徑的意義和活力��,使其最后難以執(zhí)行����。所以需要進(jìn)一步精準(zhǔn)調(diào)研該模式的風(fēng)險(xiǎn)和受益�����,使其發(fā)揮最大功能����。
4����、 總結(jié)和展望
IMDRF個(gè)性化醫(yī)療器械監(jiān)管研究不僅涉及個(gè)性化醫(yī)療器械的監(jiān)管問題,同時(shí)也結(jié)合臨床實(shí)際需求��,進(jìn)一步延伸到醫(yī)療機(jī)構(gòu)內(nèi)生產(chǎn)醫(yī)療器械��。醫(yī)療機(jī)構(gòu)研制醫(yī)療器械已經(jīng)成了全球性的趨勢(shì)����,在部分國家和地區(qū)的臨床實(shí)踐中得到了一定范圍的探討和應(yīng)用。同時(shí)�����,我們也看到其在我國的發(fā)展前景����?���!抖ㄖ剖结t(yī)療器械管理規(guī)定》發(fā)布實(shí)施����,《醫(yī)療器械監(jiān)督管理?xiàng)l例》明確設(shè)立突發(fā)公共衛(wèi)生事件中醫(yī)療機(jī)構(gòu)自行研制醫(yī)療器械要求,都為后續(xù)相應(yīng)醫(yī)療器械監(jiān)管提供了經(jīng)驗(yàn)和方向����?���?梢姡t(yī)療機(jī)構(gòu)研制醫(yī)療器械不僅可以解決臨床實(shí)踐中無器械可用的困境��,同時(shí)也是促進(jìn)醫(yī)療器械監(jiān)管高質(zhì)量發(fā)展的有效手段之一��。依據(jù)IMDRF《指南》的監(jiān)管建議�����,結(jié)合我國的臨床和監(jiān)管實(shí)際����,相信能加快建立我國醫(yī)療機(jī)構(gòu)研制醫(yī)療器械的監(jiān)管法規(guī)及配套文件�����,全面提升依法監(jiān)管的能力水平����,不斷增強(qiáng)人民用械的幸福感��、獲得感和安全感��。
參考文獻(xiàn)
[1] IMDRF. Personalized medical devices-regulatory pathway[EB/OL]. (2020-04-20)[2023-01-17]. https:// www.imdrf.org/documents/personalized-medical- devices-regulatory-pathways.
[2] 閔玥, 周雯雯, 潘碩, 等. IMDRF個(gè)性化醫(yī)療器械術(shù)語解讀[J]. 中國藥事, 2019, 33 (1): 41-44.
[3] 國務(wù)院. 醫(yī)療機(jī)構(gòu)管理?xiàng)l例[EB/OL]. (2016-06-02) [2023-01-17]. https://www.gov.cn/gongbao/content/2016/ content_5139374.htm.
[4] 國務(wù)院. 醫(yī)療器械監(jiān)督管理?xiàng)l例(中華人民共和國國務(wù)院令第276號(hào))[EB/OL]. (2000-01-04)[2023-01-17].
https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20000104094801612.html.
[5] 國家藥品監(jiān)督管理局. 醫(yī)療器械注冊(cè)管理辦法(國家藥品監(jiān)督管理局令第16號(hào))[廢止] [EB/OL]. (2000-04- 05)[2023-01-17]. https://www.nmpa.gov.cn/xxgk/fgwj/ bmgzh/20000405010101637.html.
[6] 國務(wù)院. 醫(yī)療器械監(jiān)督管理?xiàng)l例(中華人民共和國國務(wù)院令第739號(hào))[EB/OL]. (2021-03-19)[2023-01-17]. https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/2021031920 2057136.html.
[7] 國家食品藥品監(jiān)督管理局. 醫(yī)療機(jī)構(gòu)制劑注冊(cè)管理辦法(試行)(原國家食藥監(jiān)局令第20號(hào))[EB/OL]. (2005-06-22)[2023-01-17]. https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20050622010101621.html.
[8] 戰(zhàn)嘉怡, 劉春, 丁建華, 等. 全國醫(yī)療機(jī)構(gòu)制劑注冊(cè)管理現(xiàn)狀研究[J]. 中國藥事, 2015, 29(6): 571-576.
[9] 蔡明遠(yuǎn), 張翠蓮, 周亮, 等. 全國醫(yī)療機(jī)構(gòu)制劑現(xiàn)狀調(diào)研及問題分析[J]. 中國藥房, 2022, 33(5): 513-518
[10] 國家藥品監(jiān)督管理局. 藥品監(jiān)督管理統(tǒng)計(jì)年度報(bào) 告(2020年)[EB/OL]. (2021-04-20)[2023-01-17]. https://www.nmpa.gov.cn/directory/web/nmpa/images/1624869232805095741.pdf.
[11] 國家食品藥品監(jiān)督管理局. 關(guān)于加強(qiáng)定制式義齒生產(chǎn)監(jiān)管的通知(國食藥監(jiān)械〔2009〕336號(hào))[EB/OL]. (2009-07-06)[2023-01-17]. https://www.nmpa.gov.cn/ xxgk/fgwj/gzwj/gzwjylqx/20090706105601485.html.
【文章來源】中國醫(yī)療器械雜志監(jiān)管與測(cè)試 2023 年 47 卷 第 6 期