2023年,對于很多制藥企業(yè)來說����,是充滿挑戰(zhàn)和機(jī)遇的一年。很多制藥企業(yè)不斷地傳來捷報(bào)����,當(dāng)然也有很多品種不被批準(zhǔn)。對于捷報(bào)�����,大家都會分析借鑒,但不批準(zhǔn)的品種同時也是一朵朵美麗的花�����,成功也許很難復(fù)制��,但對失敗的認(rèn)真分析和復(fù)盤總會帶來收獲����!
在中國仿制藥企業(yè)工作��,老板最關(guān)注的就是什么時候有成果����,什么時候能獲批?獲批后能不能進(jìn)集采����,利潤有多少?筆者研究了集采�����、上市、中標(biāo)的要求����,發(fā)現(xiàn)一致性評價(jià)和視同通過一致性評價(jià)的品種,是獲得上市銷售的基本要求����,對比了一致性評價(jià)和仿制藥的受理后的審評時間,現(xiàn)分享給大家:
一����、一致性評價(jià)申請是彎道超車的一條捷徑
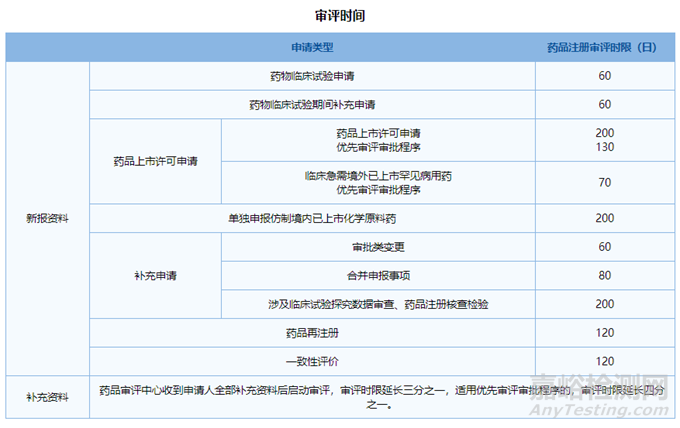
首先CDE對審評時限的要求為:
筆者根據(jù)上述審評時間進(jìn)行整理,見表1:
▲表1-仿制藥和一致性評價(jià)受理至獲批時限考察分析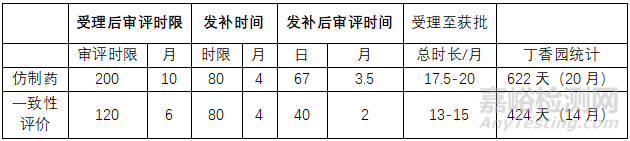
丁香園發(fā)布的《2023年度化藥和生物制品審評報(bào)告》
從上表可知����,實(shí)際申報(bào)時間統(tǒng)計(jì)與審評時限還是很接近的,受理到獲批實(shí)際時間稍微長一些�����,最主要的是兩個原因:
1.發(fā)補(bǔ)以后提交二次檢驗(yàn)�����;
2.發(fā)補(bǔ)審核完成后需要進(jìn)行生產(chǎn)工藝信息表��、說明書和質(zhì)量標(biāo)準(zhǔn)復(fù)核等。
此外��,山東華魯制藥有限公司按照一致性評價(jià)的新增規(guī)格的4ml:500mg(受理號為CYHB2350093)于2023年1月30日受理����,于2023年10月30日獲批,僅花費(fèi)了9個月����。
綜上�����,不管是從法規(guī)時限還是從實(shí)際品種受理到獲批的時限來看����,仿制藥都比一致性需要多6個月,對于有批文可以進(jìn)行一致性評價(jià)的企業(yè)來說是比較友好的�����。
二��、一致性評價(jià)的不批準(zhǔn)原因分析
雖然一致性評價(jià)有其法規(guī)方面審評時限的優(yōu)勢�����,但是因?yàn)槠髽I(yè)自身原因而導(dǎo)致優(yōu)勢不能充分發(fā)揮也是屢見不鮮。為此�����,筆者對一致性評價(jià)不批準(zhǔn)的原因進(jìn)行了充分的調(diào)研分析��,以便讀者借鑒��。
2024年2月8日����,CDE網(wǎng)站上發(fā)布的“2023年藥審報(bào)告劃重點(diǎn):IND、NDA申請雙旺盛����,以患者為中心理念首次納入指導(dǎo)原則”一文中指出,2023年����,藥審中心首次將“以患者為中心”和基于“動物法則(AnimalRule)”藥物注冊理念納入指導(dǎo)原則,標(biāo)志著我國藥物研發(fā)策略進(jìn)入了新階段��。據(jù)悉�����,“以患者為中心”的藥物研發(fā)是指基于患者角度開展的藥物開發(fā)、設(shè)計(jì)����、實(shí)施和決策的過程,旨在高效研發(fā)更符合患者需求的有臨床價(jià)值的藥物����,是當(dāng)前各國藥品監(jiān)管機(jī)構(gòu)積極探索的領(lǐng)域。
在不批準(zhǔn)的領(lǐng)域里����,立題合理性和臨床合理用藥等方面是CDE重點(diǎn)關(guān)注的對象����,本章節(jié)整理了國家藥品通知件中的一致性評價(jià)品種,并對整理的品種進(jìn)行調(diào)研��,選擇可以看出不批準(zhǔn)原因的品種進(jìn)行淺顯的分析����,不當(dāng)之處,希望各位同仁給予指導(dǎo)�����。
▲表2-2023年一致性評價(jià)不批準(zhǔn)品種
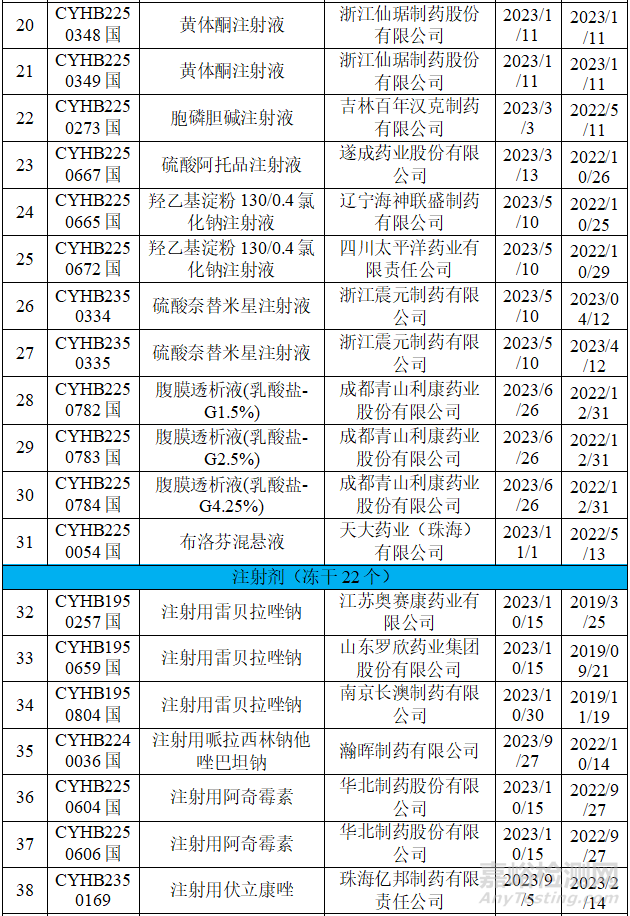
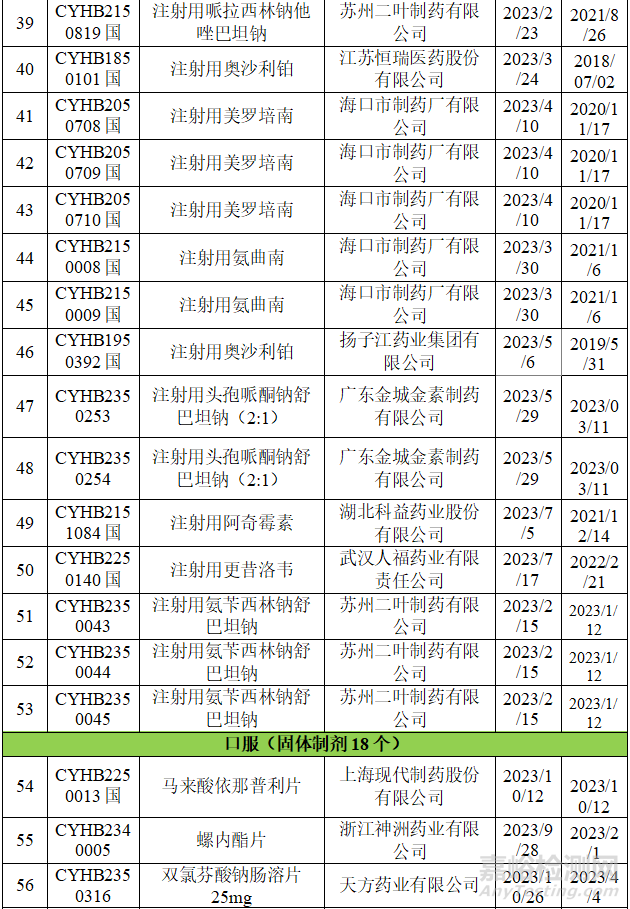
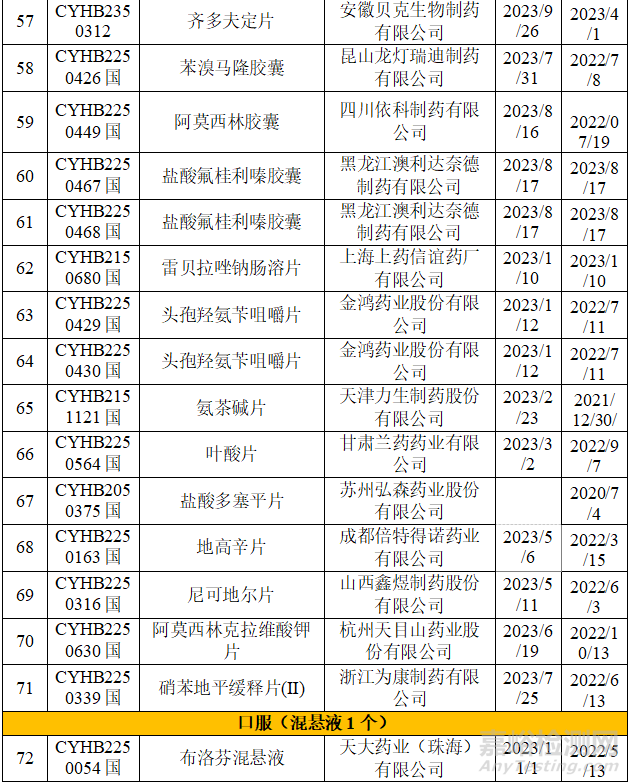
從上表可知,2023年藥品通知件中共72個受理號����,注射劑53個,占73.6%����,其中注射液31個,凍干粉針22個�;口服固體制劑18個,混懸劑1個����。歸結(jié)起來主要有兩個原因:1.參比制劑;2�、規(guī)格的臨床合理性。
2.1 參比制劑一直未公布���,審評結(jié)論不通過
鹽酸托烷司瓊注射液���,西南藥業(yè)股份有限公司于2019年申報(bào),參比制劑一直未公布,在參比制劑第63批中����,給予參比制劑不通過的結(jié)論:“經(jīng)一致性評價(jià)專家委員會審議,為確保參比制劑的質(zhì)量�,建議參比制劑首選歐盟、美國以及日本等監(jiān)管體系較為完善的機(jī)構(gòu)批準(zhǔn)上市的原研藥品���,審議未通過”�。給予筆者的反思:對于參比制劑�,優(yōu)選歐美日上市的品種,筆者對這個品種進(jìn)行初步調(diào)研���,發(fā)現(xiàn)確實(shí)存在歐洲上市的品種�。
2.2 參比制劑調(diào)出
2023年9月18日����,CDE官網(wǎng)再次發(fā)布將該參比制劑調(diào)出參比制劑目錄的征求意見稿����,內(nèi)容與第四十六批_征求意見稿調(diào)出品種目錄內(nèi)容一致,具體調(diào)出原因?yàn)椋航?jīng)一致性評價(jià)專家委員會審議����,擬調(diào)出參比制劑因采用終端滅菌工藝制備的奧沙利鉑注射液可以滿足產(chǎn)品雜質(zhì)控制及穩(wěn)定性要求���,奧沙利鉑注射劑應(yīng)首選終端滅菌的注射液,注射用奧沙利鉑為不合理劑型�,予以調(diào)出。因此將一直沒有給出結(jié)論的揚(yáng)子江藥業(yè)和恒瑞申報(bào)的奧沙利鉑注射劑一致性評價(jià)給予不批準(zhǔn)的結(jié)論���。
按照CDE 2020年發(fā)布的《化學(xué)藥品注射劑滅菌和無菌工藝研究及驗(yàn)證指導(dǎo)原則(試行)》����,注射劑只要有終端滅菌工藝���,則其他非終端一定不會被批準(zhǔn)�。這是屬于不批準(zhǔn)的紅線���,提醒各位謹(jǐn)慎立項(xiàng)非終端滅菌工藝的品種����。
2.3 臨床規(guī)格用量合理性
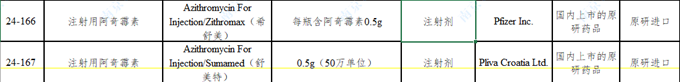
2.3.1 注射用阿奇霉素
參比制劑的規(guī)格為0.5g���,而國內(nèi)原有規(guī)格中有0.125g(25個文號)�,0.25g(50個文號),在進(jìn)行一致性評價(jià)時����,由于兩種規(guī)格小于臨床單次使用的最小劑量,而不被批準(zhǔn)����。
2.3.2 注射用更昔洛韋
公布的參比制劑規(guī)格為0.5g,武漢人福申報(bào)的0.25g和0.5g兩個規(guī)格均通過一致性評價(jià)����,而申報(bào)的0.05g的規(guī)格一致性評價(jià)未通過。因此�,大家在立項(xiàng)時一定要考慮臨床的單次最小使用量。
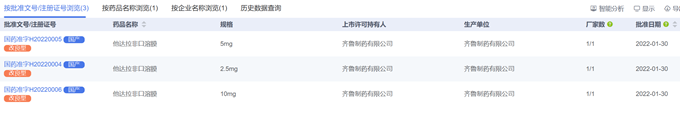
2.3.3 胞磷膽堿鈉注射液
公布的參比制劑規(guī)格為4ml:500mg和4ml:1g���;山東齊魯制藥有限公司申請了原有品種規(guī)格2ml:0.25g的一致性評價(jià)未獲批�。
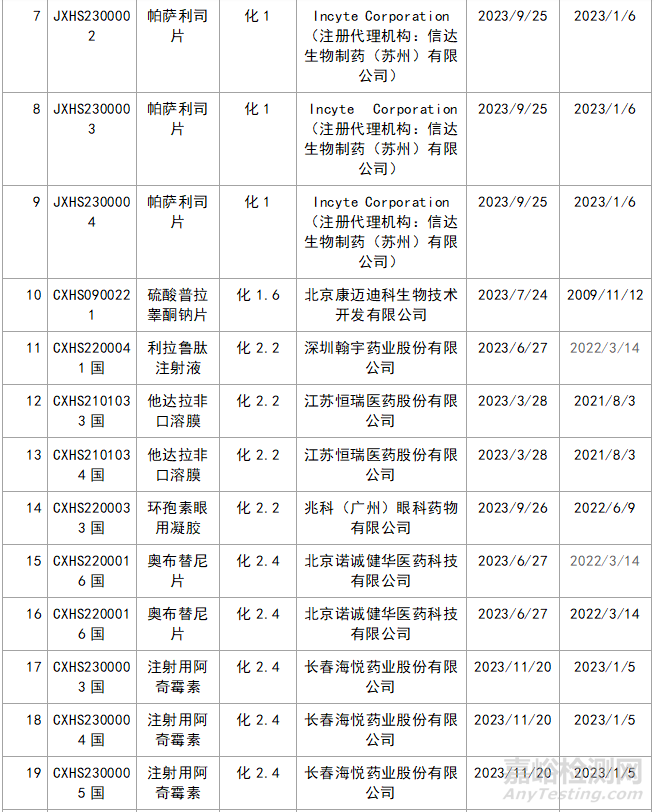
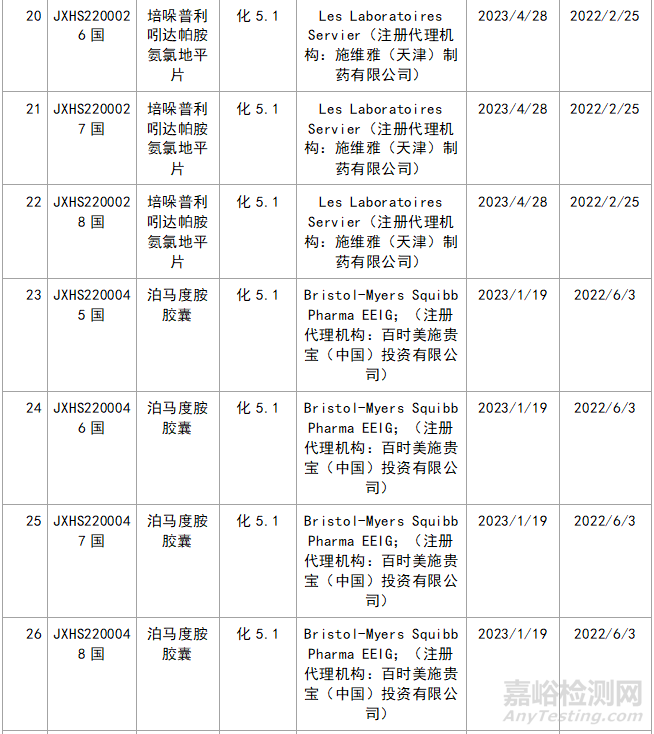
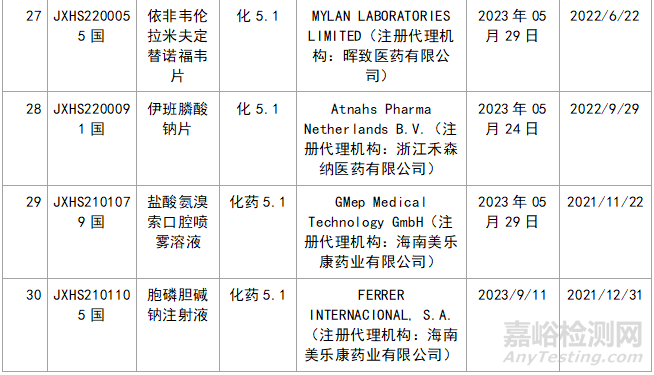
三�、新藥品種不批準(zhǔn)的品種統(tǒng)計(jì)
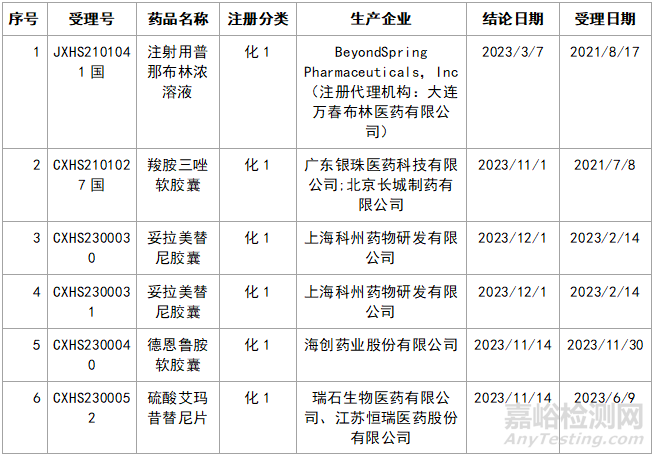
近年來,多重醫(yī)藥創(chuàng)新鼓勵政策持續(xù)激發(fā)����,產(chǎn)業(yè)創(chuàng)新活力持續(xù)釋放���,2023年藥品注冊申請申報(bào)量持續(xù)增長����。我們在看到創(chuàng)新藥給企業(yè)帶來利好的同時,也應(yīng)看看那些不批準(zhǔn)的品種的情況���,筆者根據(jù)國家局藥品通知件待領(lǐng)取信息進(jìn)行整理�,共整理了30個不批準(zhǔn)的創(chuàng)新藥����,其中化1類:10個;2類9個����;5.1類11個。具體信息見表3:
▲表3-2023年創(chuàng)新藥品種不批準(zhǔn)的品種匯總
對新藥的查詢讓筆者對堅(jiān)持做創(chuàng)新藥的企業(yè)肅然起敬���,每個品種都經(jīng)歷了漫長的立項(xiàng)���、臨床試驗(yàn)和最終的獲批或者不獲批的情況。
首先09年申報(bào)的硫酸普拉睪酮鈉片�。該品種經(jīng)歷過藥物臨床試驗(yàn)數(shù)據(jù)自查核查品種(2015.7.22);于2016年10月13日開展臨床試驗(yàn)���,2019年終止試驗(yàn)����。經(jīng)歷了10多年的時間,是一代制藥人的堅(jiān)持�。
對于新藥不獲批的情況,筆者歸結(jié)的原因有不能滿足臨床需要���、技術(shù)壁壘����、原料撤回等�,對新藥的不批準(zhǔn)的分析如下:
3.1 臨床試驗(yàn)是否完善
2.4類為增加國內(nèi)外均未有的適應(yīng)癥,臨床試驗(yàn)的結(jié)果是影響其能否獲批的主要原因����。
3.2 技術(shù)壁壘
齊魯制藥的他達(dá)拉非口溶膜與他達(dá)拉非片進(jìn)行BE試驗(yàn),獲批生產(chǎn)���。而恒瑞的同品種在進(jìn)行BE試驗(yàn)后直接申請上市���,未取得發(fā)補(bǔ)機(jī)會,直接給予不批準(zhǔn)的命運(yùn)�。筆者反思認(rèn)為:對于藥品來說�,技術(shù)壁壘和藥學(xué)質(zhì)量一直是產(chǎn)品的核心�,許多人認(rèn)為臨床等效了就肯定能獲批而忽略了藥品本身技術(shù)的壁壘���。
3.3 得原料者得天下
3.3.1 羧胺三唑軟膠囊
該原料在原料備案平臺上���,僅珠海潤都制藥股份有限公司進(jìn)行登記,目前狀態(tài)為I���;
3.3.2 注射用普那布林濃溶液
該品種的原料藥登記廠家為凱萊英醫(yī)藥集團(tuán)(天津)股份有限公司����,目前原料藥登記狀態(tài)仍然為I�。因此,大家在做新藥原料加制劑的時候����,原料藥的質(zhì)量一定要把控,可以找一些第三方咨詢公司進(jìn)行一下評估����。所有的新藥都是要經(jīng)歷臨床研究的,花費(fèi)都是比較多的����,最后因?yàn)樵隙慌鷾?zhǔn)����,就得不償失了���。
3.3.3 利拉魯肽注射液——原料競爭
利拉魯肽注射液申報(bào)按照化學(xué)藥進(jìn)行申報(bào)�,其他獲批的是按照生物藥進(jìn)行申報(bào)的����。查詢CDE原料藥備案平臺,利拉魯肽的原料的備案信息均為I�。該品種按照化學(xué)藥申報(bào),轉(zhuǎn)化為原料獲批的競爭了����。就像司美格魯肽一樣,原研是發(fā)酵����,仿制是化學(xué)合成,但美國也有處于A狀態(tài)的DMF了����。不管是化藥合成還是生物發(fā)酵����,誰能夠?qū)⒃献龀鰜聿⒌玫焦俜秸J(rèn)可����,誰就能拿到這個品種的市場�。不管是按照化藥還是生物藥仿制,必要的安全性研究和相應(yīng)的臨床試驗(yàn)一樣不能少����,只有這樣才能拿到批件而非藥品通知件!