根據(jù)藥品管理法和新版的GMP指南的指導(dǎo)精神和要求����,全生命周期方法的概念已經(jīng)開始逐漸融入到我國各個方面的狀態(tài)要求中。所謂的全生命周期方法是指一個方法從建立����、成型、應(yīng)用以及到后期的方法變更或者提升的一個動態(tài)循環(huán)的過程���。USP[1]通則1220“分析方法生命周期”在2022年5月1日正式生效。該通則為分析方法開發(fā)設(shè)定了生命周期方法����,簡化了對分析方法進(jìn)行批準(zhǔn)后變更的過程。那么我們應(yīng)該如何運(yùn)用全生命周期方法去建立一個分析方法的生命周期呢���?首先讓我們來了解幾個建立分析方法生命周期的概念�。
1����、分析目標(biāo)概況(ATP)[2]:對能夠滿足分析檢測預(yù)期目的和預(yù)期性能標(biāo)準(zhǔn)的性能特性的前瞻性總結(jié)。
2���、關(guān)鍵質(zhì)量屬性(CQA)[3]:指產(chǎn)品的物理����、化學(xué)、生物或微生物特性應(yīng)在適當(dāng)?shù)南薅?、范圍或分布之?nèi),以確保預(yù)期的產(chǎn)品質(zhì)量����。
3、既定條件(ECs)[4]:是確保產(chǎn)品質(zhì)量所必須的具有法律約束力的信息����。EC的任何變更都必須提交給監(jiān)管機(jī)構(gòu)。
4���、方法可操作設(shè)計區(qū)域(MODR)[2]:分析方法參數(shù)的范圍����,在該范圍內(nèi)操作可達(dá)到分析方法的性能標(biāo)準(zhǔn)���,從而確保檢測結(jié)果的可靠性�。
5����、分析方法驗(yàn)證策略[2]:分析方法驗(yàn)證策略描述了如何選擇用于驗(yàn)證的分析方法性能特性�。在策略中�,開發(fā)研究(例如,使用MODR或PAR)期間和系統(tǒng)適用性試驗(yàn)(SST)期間收集的數(shù)據(jù)可用于驗(yàn)證����,并且可制定涵蓋在MODR/PAR內(nèi)的參數(shù)未來波動的實(shí)驗(yàn)方案。
6�、經(jīng)證實(shí)的分析方法可接受范圍(PAR)[2]:指一個分析方法參數(shù)的范圍。在保持其他參數(shù)不變的同時����,使分析檢測結(jié)果符合相關(guān)性能標(biāo)準(zhǔn)的分析方法參數(shù)的表征范圍����。
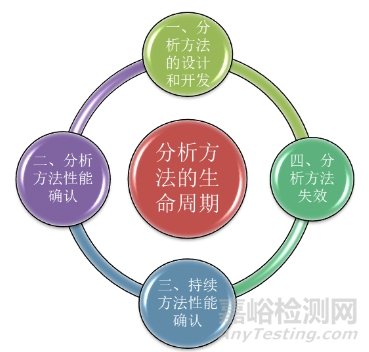
在以上概念中,其中ATP(分析目標(biāo)概況)是生命周期方法的基本組成部分���。ATP的標(biāo)準(zhǔn)是建立在分析方法的預(yù)期用途之上的����,對于定量方法����,ATP則通常根據(jù)目標(biāo)測量不確定度����,即報告結(jié)果中的最大可接受不確定度來規(guī)定分析方法產(chǎn)生的檢測結(jié)果所需的質(zhì)量����。所以,建立一個分析方法的生命周期���,ATP應(yīng)作為關(guān)鍵步驟貫穿始終����。分析方法的生命周期可以分為四個階段�。如下圖所示。
接下來����,我們對分析方法生命周期的三個階段展開進(jìn)行一個詳細(xì)的描述。
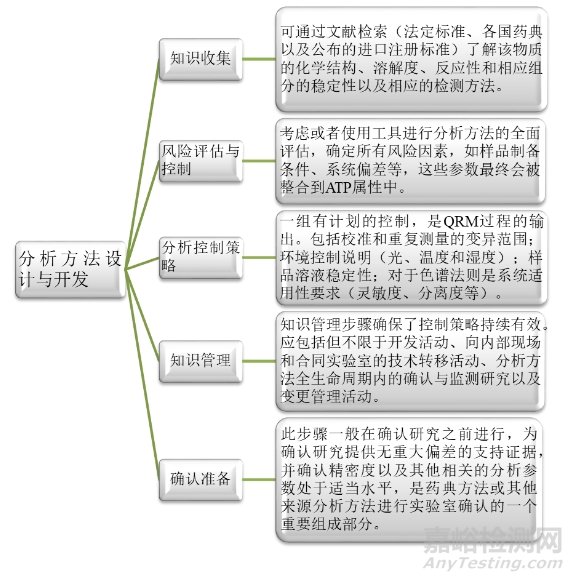
首先是第一階段:分析方法的設(shè)計與開發(fā)�。顧名思義,此階段主要包括:知識的收集�、風(fēng)險評估與控制、分析控制策略���、知識管理和確認(rèn)準(zhǔn)備等����。
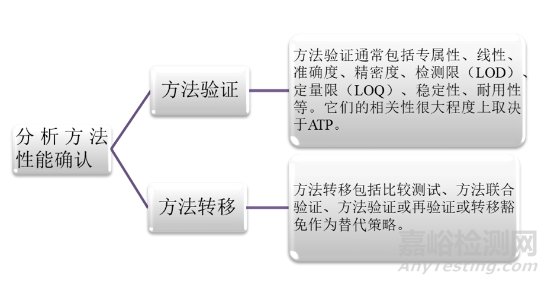
其次是第二階段:分析方法性能確認(rèn)。主要包括方法驗(yàn)證和方法轉(zhuǎn)移兩個部分�。方法驗(yàn)證的目的是確認(rèn)該方法將按預(yù)期運(yùn)行,并且能滿足先前定義的ATP的標(biāo)準(zhǔn)�。而方法轉(zhuǎn)移則是因?yàn)樵诋a(chǎn)品從開發(fā)、擴(kuò)大�、制造、生產(chǎn)和投產(chǎn)到批準(zhǔn)后的生命周期中���,要滿足將分析方法從研發(fā)實(shí)驗(yàn)室轉(zhuǎn)移到生產(chǎn)實(shí)驗(yàn)室的要求���。方法轉(zhuǎn)移過程中,應(yīng)當(dāng)進(jìn)行嚴(yán)謹(jǐn)?shù)娘L(fēng)險評估���,來確定需要進(jìn)行對比的參數(shù)。2020年版《中國藥典》四部指導(dǎo)原則9099[5]���、9101[6]和9100[7]分別對分析方法的確認(rèn)����、驗(yàn)證和轉(zhuǎn)移進(jìn)行了詳細(xì)的描述。
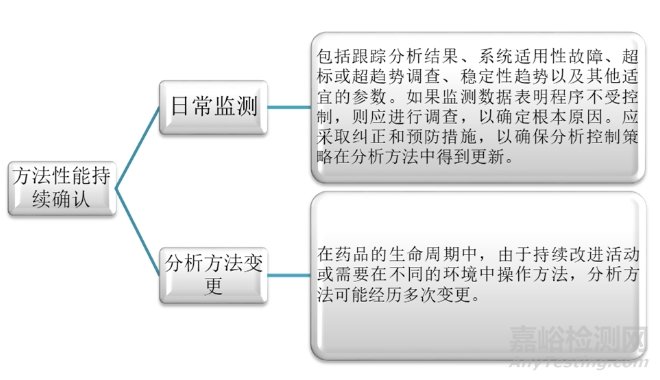
再次是第三階段:持續(xù)方法性能確認(rèn)�。此階段是分析方法生命周期中確保分析方法保持在受控狀態(tài),持續(xù)滿足ATP標(biāo)準(zhǔn)的重要方面�。主要包括日常監(jiān)測和分析方法變更兩個組成部分。因此���,此階段在ATP中被用作程序性能的參考點(diǎn)���。
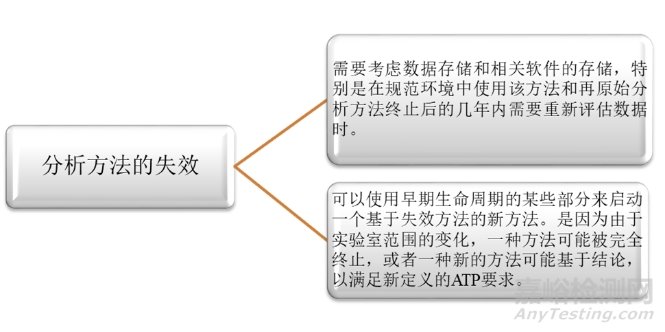
最后是第四階段:分析方法的失效。作為分析方法生命周期的最后階段���,其終止也要遵循質(zhì)量管理原則���。其主要考慮以下兩個方面。
參考文獻(xiàn)
[1] 美國藥典USP/NF,通則1220,分析方法生命周期.
[2] ICH指導(dǎo)原則,Q14分析方法開發(fā).
[3] ICH指導(dǎo)原則,Q8藥物研發(fā).
[4] ICH指導(dǎo)原則,Q12藥品生命周期管理的技術(shù)和監(jiān)管考慮.
[5]2020年版中國藥典,四部指導(dǎo)原則9099,分析方法確認(rèn)指導(dǎo)原則.
[6]2020年版中國藥典,四部指導(dǎo)原則9101,分析方法驗(yàn)證指導(dǎo)原則.
[7]2020年版中國藥典,四部指導(dǎo)原則9100,分析方法轉(zhuǎn)移指導(dǎo)原則.