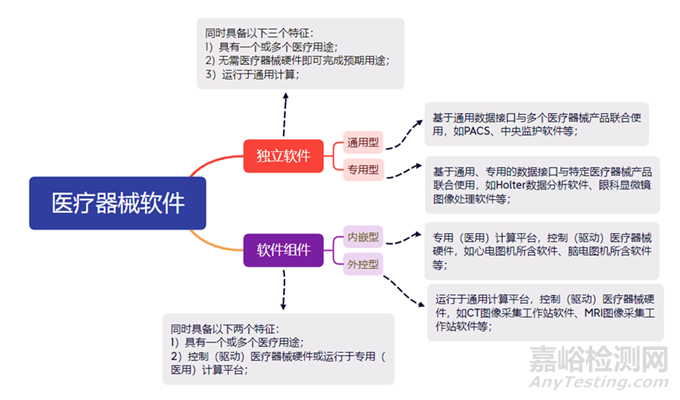
伴隨醫(yī)療保健技術(shù)的日益進(jìn)步�����,軟件已成為醫(yī)療產(chǎn)品的重要組成。醫(yī)療器械軟件可分為獨(dú)立軟件和軟件組件����,它們的區(qū)別和構(gòu)成如下圖所示:
注冊要求
1.注冊方式
獨(dú)立軟件作為醫(yī)療器械或醫(yī)療器械附件,通常單獨(dú)注冊�����,特殊情況可隨醫(yī)療器械進(jìn)行注冊����,此時(shí)雖不控制/驅(qū)動(dòng)醫(yī)療器械硬件但從產(chǎn)品角度運(yùn)行于醫(yī)用計(jì)算平臺,故視為軟件組件��,如專用型獨(dú)立軟件可作為附件隨醫(yī)療器械進(jìn)行注冊���。
軟件組件作為醫(yī)療器械或醫(yī)療器械部件�、附件的組成部分����,不宜單獨(dú)注冊,需隨醫(yī)療器械進(jìn)行整體注冊���。
2.注冊單元?jiǎng)澐衷瓌t
獨(dú)立軟件注冊單元以管理類別�����、預(yù)期用途��、功能模塊作為劃分原則����。
不同管理類別的獨(dú)立軟件作為不同注冊單元���,若在技術(shù)上無法拆分可作為一個(gè)注冊單元并按照較高管理類別申報(bào)注冊�。
不同預(yù)期用途的獨(dú)立軟件作為不同注冊單元�����,按照預(yù)期用途可分為輔助決策類和非輔助決策類����,每類又可細(xì)分為治療、診斷��、監(jiān)護(hù)�、篩查等情形���。
軟件組件注冊單元與所屬醫(yī)療器械相同,有軟件組件和無軟件組件的醫(yī)療器械作為不同注冊單元��。專用型獨(dú)立軟件視為軟件組件的注冊單元與軟件組件相同��。
檢測單元?jiǎng)澐衷瓌t
獨(dú)立軟件檢測單元原則上與注冊單元相同�����,但若有多個(gè)運(yùn)行環(huán)境或多個(gè)發(fā)布版本�����,則每個(gè)互不兼容的運(yùn)行環(huán)境(含云計(jì)算)或每個(gè)互不涵蓋的發(fā)布版本均需作為一個(gè)檢測單元�����。
若軟件核心功能相同但核心算法類型不同��,則每類核心算法所對應(yīng)的核心功能均需檢測(檢測對象為核心功能而非核心算法)��。例如���,圖像分割功能所用核心算法含常規(guī)圖像處理算法和人工智能算法��,基于這兩類算法的圖像分割功能均需檢測����。
軟件組件檢測單元原則上與所屬醫(yī)療器械相同,但醫(yī)療器械若包含多個(gè)軟件組件或多個(gè)發(fā)布版本的軟件組件����,則每個(gè)軟件組件或每個(gè)發(fā)布版本的軟件組件均需作為一個(gè)檢測單元,除非檢測單元能夠完整覆蓋注冊單元全部情況���。同理,若軟件核心功能相同但核心算法類型不同����,則每類核心算法所對應(yīng)的核心功能均需檢測。
注冊申報(bào)資料
本指導(dǎo)原則未提及的注冊申報(bào)資料應(yīng)符合《關(guān)于公布醫(yī)療器械注冊申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》的要求����。
(一)產(chǎn)品注冊
1. 產(chǎn)品名稱與結(jié)構(gòu)組成
(1)獨(dú)立軟件:產(chǎn)品名稱應(yīng)為通用名稱,并符合相關(guān)法規(guī)�����、規(guī)范性文件的要求��,可以結(jié)合人體部位(如胸部、心臟等)���、臨床科室(如骨科�、神經(jīng)外科等)��、處理對象(如CT圖像��、MRI圖像�����、心電數(shù)據(jù)等)和功能用途(如計(jì)劃����、處理、CAD等)進(jìn)行命名����。
結(jié)構(gòu)組成應(yīng)包括物理組成和邏輯組成,其中物理組成描述軟件的存儲介質(zhì)或交付方式�����,如光盤、U盤��、預(yù)裝于計(jì)算機(jī)交付或網(wǎng)絡(luò)下載交付等�;邏輯組成描述軟件的臨床功能模塊,包括服務(wù)器(如適用)和客戶端���,注明選裝和模塊版本����。
(2)軟件組件:軟件組件無相應(yīng)要求�。
專用型獨(dú)立軟件視為軟件組件時(shí),軟件名稱與獨(dú)立軟件要求相同�����,結(jié)構(gòu)組成應(yīng)明確軟件的名稱���、型號規(guī)格和發(fā)布版本。
2. 軟件研究資料
制造商應(yīng)單獨(dú)提供一份軟件描述文檔��。
鑒于進(jìn)口醫(yī)療器械軟件不一定在中國同步注冊����,即該軟件在境外已多次注冊變更但在中國為首次產(chǎn)品注冊,此時(shí)軟件描述文檔應(yīng)涵蓋申報(bào)范圍內(nèi)的全部研究資料。
3. 軟件版本
制造商應(yīng)單獨(dú)出具一份軟件版本命名規(guī)則真實(shí)性聲明�����。對于獨(dú)立軟件(含專用型獨(dú)立軟件視為軟件組件的情況)和控制型軟件組件��,注冊檢測報(bào)告應(yīng)包含軟件完整版本和軟件發(fā)布版本的界面照片�����。對于進(jìn)口醫(yī)療器械軟件�����,制造商應(yīng)提供此發(fā)布版本軟件在原產(chǎn)國獲準(zhǔn)上市的證明性文件�。
4. 產(chǎn)品技術(shù)要求
(1)獨(dú)立軟件:獨(dú)立軟件產(chǎn)品技術(shù)要求應(yīng)在“產(chǎn)品型號/規(guī)格及其劃分說明”中明確軟件的名稱、型號規(guī)格�����、發(fā)布版本和版本命名規(guī)則�,而“性能指標(biāo)”分為通用要求、質(zhì)量要求����、專用要求和安全要求,其中通用要求應(yīng)根據(jù)軟件自身特性進(jìn)行規(guī)范,質(zhì)量要求應(yīng)符合GB/T 25000.51《軟件工程 軟件產(chǎn)品質(zhì)量要求與評價(jià)(SQuaRE) 商業(yè)現(xiàn)貨(COTS)軟件產(chǎn)品的質(zhì)量要求與測試細(xì)則》的要求��,專用要求應(yīng)符合相關(guān)性能標(biāo)準(zhǔn)(如放射治療)的要求��,安全要求應(yīng)符合相關(guān)安全標(biāo)準(zhǔn)(如報(bào)警���、放射治療)的要求��。
(2)軟件組件:軟件組件應(yīng)在醫(yī)療器械產(chǎn)品技術(shù)要求中進(jìn)行規(guī)范����,其中“產(chǎn)品型號/規(guī)格及其劃分說明”應(yīng)明確軟件的名稱�����、型號規(guī)格�����、發(fā)布版本�����、版本命名規(guī)則��、運(yùn)行環(huán)境(控制型軟件組件適用��,包括硬件配置�、軟件環(huán)境和網(wǎng)絡(luò)條件),而“性能指標(biāo)”應(yīng)明確軟件全部臨床功能綱要����。
專用型獨(dú)立軟件視為軟件組件時(shí),要求與軟件組件相同(運(yùn)行環(huán)境適用)���。
5. 臨床評價(jià)資料
(1)獨(dú)立軟件:獨(dú)立軟件應(yīng)依據(jù)《醫(yī)療器械臨床評價(jià)技術(shù)指導(dǎo)原則》提交臨床評價(jià)資料�����,不適用條款說明理由���。對于采用人工智能算法實(shí)現(xiàn)的功能(如計(jì)算機(jī)輔助檢測、分類和診斷等CAD類功能)��,應(yīng)提交基于臨床試驗(yàn)的臨床評價(jià)資料�����。
制造商可以選取已上市醫(yī)療器械產(chǎn)品所含的同類軟件功能進(jìn)行實(shí)質(zhì)等同對比�。
(2)軟件組件:軟件組件應(yīng)與醫(yī)療器械產(chǎn)品整體開展臨床評價(jià)工作�����,提交醫(yī)療器械產(chǎn)品的臨床評價(jià)資料����。軟件組件的處理功能可隨醫(yī)療器械產(chǎn)品進(jìn)行臨床評價(jià)�,也可單獨(dú)進(jìn)行臨床評價(jià),此時(shí)要求與獨(dú)立軟件相同��。
專用型獨(dú)立軟件視為軟件組件時(shí)���,要求與軟件組件的處理功能相同�。
6. 說明書
說明書應(yīng)符合相關(guān)的法規(guī)����、規(guī)范性文件、國家標(biāo)準(zhǔn)����、行業(yè)標(biāo)準(zhǔn)的要求,體現(xiàn)軟件全部功能(包含安全功能)��,明確軟件發(fā)布版本�����。
(二)許可事項(xiàng)變更
1. 變更情況聲明
明確軟件和現(xiàn)成軟件(如適用)的版本命名規(guī)則���、完整版本��、發(fā)布版本和發(fā)布版本變更情況���。
2. 軟件研究資料
醫(yī)療器械許可事項(xiàng)變更應(yīng)根據(jù)軟件更新情況提交軟件變化部分對產(chǎn)品安全性與有效性影響的研究資料:
(1)涉及重大軟件更新:單獨(dú)提交一份軟件更新描述文檔;
(2)涉及輕微增強(qiáng)類軟件更新:單獨(dú)提交一份軟件更新描述文檔�����;
(3)僅發(fā)生糾正類軟件更新:提交糾正類軟件更新申報(bào)資料����;
(4)未發(fā)生軟件更新:出具真實(shí)性聲明。
3. 產(chǎn)品技術(shù)要求
(1)獨(dú)立軟件:獨(dú)立軟件產(chǎn)品技術(shù)要求應(yīng)體現(xiàn)軟件更新情況,包括“產(chǎn)品型號/規(guī)格及其劃分說明”���、“性能指標(biāo)”和“附錄”。
(2)軟件組件(如適用):醫(yī)療器械產(chǎn)品技術(shù)要求應(yīng)體現(xiàn)軟件更新情況�,包括“產(chǎn)品型號/規(guī)格及其劃分說明”中的軟件信息、“性能指標(biāo)”中的軟件要求�����。
專用型獨(dú)立軟件視為軟件組件時(shí),要求與軟件組件相同��。
4. 現(xiàn)成軟件(如適用)
醫(yī)療器械許可事項(xiàng)變更應(yīng)根據(jù)現(xiàn)成軟件更新情況提交軟件變化部分對產(chǎn)品安全性與有效性影響的研究資料:
(1)涉及重大軟件更新:單獨(dú)提交一份現(xiàn)成軟件更新描述文檔�����;
(2)涉及輕微增強(qiáng)類軟件更新:單獨(dú)提交一份現(xiàn)成軟件更新描述文檔����;
(3)僅發(fā)生糾正類軟件更新:提交糾正類軟件更新申報(bào)資料;
(4)未發(fā)生軟件更新:出具真實(shí)性聲明�����。
5. 說明書(如適用)
說明書應(yīng)體現(xiàn)軟件全部功能(包含安全功能)��,明確軟件發(fā)布版本���,提供變化情況說明��。
(三)延續(xù)注冊
1. 產(chǎn)品未變化聲明
明確軟件和現(xiàn)成軟件(如適用)的版本命名規(guī)則�、完整版本和發(fā)布版本��。
2. 產(chǎn)品分析報(bào)告(如適用)
根據(jù)已注冊醫(yī)療器械軟件在后續(xù)注冊時(shí)應(yīng)提交軟件更新資料的要求,醫(yī)療器械延續(xù)注冊產(chǎn)品分析報(bào)告第(六)項(xiàng)應(yīng)提交相應(yīng)軟件更新資料�����。
(1)涉及輕微增強(qiáng)類軟件更新:單獨(dú)提交一份軟件更新描述文檔���、現(xiàn)成軟件更新描述文檔;
(2)僅發(fā)生糾正類軟件更新:提交糾正類軟件更新申報(bào)資料���。
3. 特殊情形
本次注冊如涉及重大軟件更新���,前次注冊所批準(zhǔn)的事項(xiàng)可以延續(xù)注冊。
其他軟件相關(guān)問題
1.軟件注冊檢注意事項(xiàng)����?
軟件命名、結(jié)構(gòu)組成����、序列號、版本號�����、交付形式、標(biāo)簽�、檢測單元?jiǎng)澐帧⒓夹g(shù)要求編制�����、風(fēng)險(xiǎn)管理文件的準(zhǔn)備��。
2.軟件的交付方式變更需要注冊變更嗎?譬如增加線上下載方式�����?
首先結(jié)構(gòu)組成變更了����,技術(shù)要求變更了,生產(chǎn)工藝流程變更��,影響產(chǎn)品質(zhì)量的��,屬于重大變更需要走注冊變更�����。
3. 軟件更新,注冊申報(bào)要求�����?
給軟件更新的內(nèi)容分類����,涉及重大更新需要注冊變更,輕微更新通過質(zhì)量管理體系及設(shè)計(jì)變更控制��。
4.軟件開發(fā)工具���,環(huán)境等日常維護(hù)記錄怎么弄?
軟件開發(fā)和測試環(huán)境維護(hù)包括軟硬件設(shè)備���、開發(fā)測試工具、網(wǎng)絡(luò)等資源以及病毒防護(hù)����、數(shù)據(jù)備份與恢復(fù)等保證措施、確定軟件開發(fā)和測試環(huán)境定期驗(yàn)證��、更新升級����、病毒防護(hù)等活動(dòng)要求�。
5.軟件拓?fù)鋱D用來干嘛�,怎么用?
基于軟件設(shè)計(jì)規(guī)范(SDS)文檔提供軟件的物理拓?fù)鋱D(涵蓋全部外圍設(shè)備)�����,依據(jù)物理拓?fù)鋱D詳述軟件/組成模塊�����、必備軟件��、云計(jì)算����、通用計(jì)算平臺、醫(yī)療器械硬件/部件之間的物理連接關(guān)系�。
6.什么是用戶文檔集?
隨同軟件提供的協(xié)助用戶使用該軟件的信息。包括:用戶手冊�、操作手冊、軟件需求說明書����、數(shù)據(jù)要求說明書�����。