簡單總結(jié):采用疫苗免疫措施主要用于預(yù)防豬生殖和呼吸綜合征(PRRS)�。我們總結(jié)了目前開發(fā)的PRRSV疫苗的優(yōu)缺點(diǎn)和適用性�,包括修飾活病毒、滅活病毒、重組亞基���、活載體���、DNA、基因缺失����、合成肽、病毒樣顆粒疫苗�,以及其他各種疫苗。這些結(jié)果為新疫苗的開發(fā)提供了理論基礎(chǔ)�。
摘要:豬繁殖與呼吸綜合征(PRRS)是養(yǎng)豬業(yè)中的一種高度傳染性疾病,但其發(fā)病機(jī)制尚不完全清楚���。這種疾病是由豬呼吸綜合征病毒(PRRSV)引起的�,它主要感染豬肺泡巨噬細(xì)胞并破壞免疫系統(tǒng)�。不幸的是,目前還沒有治療PRRS的特效藥物�,因此疫苗接種對(duì)于控制該疾病至關(guān)重要。現(xiàn)有多種類型的單一疫苗和聯(lián)合疫苗�,包括活疫苗、滅活疫苗����、亞基疫苗�、DNA疫苗和載體疫苗����。其中,活疫苗具有較好的保護(hù)作用�,但交叉保護(hù)作用較弱。滅活疫苗較為安全����,但免疫效力較差。亞單位疫苗可用于妊娠晚期���,DNA疫苗可增強(qiáng)活疫苗的保護(hù)作用。然而����,載體疫苗只提供部分保護(hù),并沒有在實(shí)踐中廣泛使用�,目前仍然需要一種符合新一代國際標(biāo)準(zhǔn)的PRRS疫苗。本文全面綜述了減毒活疫苗���、滅活疫苗����、亞基疫苗、活載體疫苗���、DNA疫苗���、基因缺失疫苗、合成肽疫苗����、病毒樣顆粒疫苗以及其他預(yù)防和控制PRRS的疫苗的優(yōu)缺點(diǎn)和適用性。其目的是為疫苗研究和開發(fā)提供理論基礎(chǔ)�。
關(guān)鍵詞:豬繁殖與呼吸綜合征;疫苗����;優(yōu)點(diǎn)和缺點(diǎn);適用性���;研究進(jìn)展����。
1�、引言
豬繁殖與呼吸綜合征(PRRS)是由豬繁殖與呼吸綜合征病毒(PRRSV)引起的一種高傳染性和強(qiáng)毒性傳染病���。可引起不同年齡豬的流產(chǎn)�、早產(chǎn)、胎兒干尸等生殖障礙及呼吸系統(tǒng)疾病�。豬感染PRRSV可導(dǎo)致免疫抑制,損害免疫功能���,給養(yǎng)豬業(yè)造成重大經(jīng)濟(jì)損失���。PRRS于1987年首次在北卡羅來納州被發(fā)現(xiàn),此后在世界范圍內(nèi)分離出各種毒株�。1991年和1992年,在歐洲和美洲的感染豬中分離出Lelystat病毒和VR2332株�。PRRSV LV和VR2332株遺傳分類為1型PRRSV (PRRSV-1)和2型PRRSV (PRRSV-2)。在最近的系統(tǒng)分類中�,PRRSV-1和PRRSV-2分別歸屬于乙型肝炎病毒1和乙型肝炎病毒2種。PRRSV-2毒株主要流行于中國����,那里曾發(fā)生高致病性PRRS (HP-PRRS)疫情并伴隨仔豬的高死亡率�。2012年,中國發(fā)現(xiàn)了一株高度可變的NADC30樣毒株����,該毒株極易與其他毒株重組����。此外���,NADC30樣PRRSV在中國許多地區(qū)流行�。PRRSV繼續(xù)變異和重組�,目前的疫苗不能提供足夠的保護(hù),使預(yù)防和控制更加復(fù)雜�。
PRRSV是一種帶包膜的單正鏈RNA病毒,屬于動(dòng)脈病毒屬�。其基因組長度約為15 kb,由ORF1a����、ORF1b、ORF2a����、ORF2b、ORF3-7���、ORF5a和ORF1aTF等11個(gè)開放閱讀框(ORFs)組成���,與ORF1a的非結(jié)構(gòu)蛋白(NSP)- 2編碼區(qū)重疊�。其中ORF1a����、ORF1aTF和ORF1b占總基因組的80%。翻譯后的多肽pp1a和pp1ab被切割成15個(gè)非結(jié)構(gòu)蛋白(NSPs)����,包括NSP1α、NSP1β�、NSP2相關(guān)蛋白(NSP2N、NSP2TF和NSP2)和NSP3-NSP12����,它們參與病毒復(fù)制。ORF2a�、ORF2b、ORF3���、ORF4����、ORF5和ORF5a編碼6個(gè)包膜相關(guān)蛋白����,分別為GP2a、GP2b�、GP3、GP4�、GP5和GP5a。ORF6編碼的非糖基化基質(zhì)(M)蛋白和ORF7編碼的核衣殼(N)蛋白是優(yōu)勢(shì)結(jié)構(gòu)蛋白�,具有較強(qiáng)的免疫原性。GP5蛋白是一種主要的結(jié)構(gòu)蛋白���,具有良好的免疫原性�,能夠誘導(dǎo)機(jī)體產(chǎn)生中和抗體(neutralizing antibodies, NAs)���,在持續(xù)病毒感染中起著至關(guān)重要的作用���。因此,GP5仍是PRRS疫苗研究的首選蛋白���。
抗體依賴性增強(qiáng)(ADE)是PRRS疫苗開發(fā)的一個(gè)重大挑戰(zhàn)����,其中先前存在的非中和或亞中和抗體促進(jìn)病毒進(jìn)入和復(fù)制。首例PRRSV感染的ADE的報(bào)道可追溯到1993年�。一項(xiàng)研究發(fā)現(xiàn),與僅接種病毒的胎兒相比�,接種病毒加抗體的胎兒的病毒復(fù)制增加。Yoon等人后來報(bào)道���,在病毒感染前給豬注射亞中性量的PRRSV特異性免疫球蛋白G(IgG)會(huì)增加病毒血癥����,并且PRRSV特異性IgG會(huì)增加病毒逃逸突變體的產(chǎn)生�。Fcγ受體可參與PRRSV引起的ADE。然而���,有研究發(fā)現(xiàn)亞中和的IgG在體內(nèi)不會(huì)引起ADE����,經(jīng)修飾的PRRSV活疫苗可對(duì)異源毒株提供部分交叉保護(hù)����。目前,體內(nèi)實(shí)驗(yàn)還不足以證實(shí)ADE是否在PRRSV發(fā)病中起關(guān)鍵作用����。感染PRRSV后的ADE可能因不同的毒株和條件而異���。體外研究表明,抗PRRSV血清在稀釋27倍時(shí)對(duì)感染具有最有效的作用���。ADE試驗(yàn)采用1頭樣品與陽性對(duì)照比為1.2的豬的血清,其NA效價(jià)為1/5.9���。在PRRSV NA被動(dòng)轉(zhuǎn)移后���,血清中較高濃度的PRRSV NA滴度(1:32)可誘導(dǎo)完全保護(hù)。然而�,這只適用于一些仔豬,并且滴度(1:8)不能阻止PRRSV在肺部復(fù)制或傳播到其他周圍淋巴組織����。這些研究結(jié)果是相互矛盾的,需要進(jìn)一步研究確定PRRSV感染期間ADE的潛在機(jī)制����。確定減毒PRRS疫苗是否會(huì)使感染新毒株的豬的疾病惡化也是必要的。
目前�,疫苗接種是預(yù)防PRRS的主要措施。國產(chǎn)滅活疫苗來源于CH-1a經(jīng)典毒株����,而應(yīng)用廣泛的減毒疫苗來源不同����,分為經(jīng)典毒株(VR2332���、CH-1R���、R98)和高致病性毒株(JXA1、TJ���、HuN4����、GD)�。中國流行的PRRSV可分為4個(gè)譜系,即譜系1����、譜系3、譜系5和譜系8�。自PRRSV在中國出現(xiàn)以來,譜系8占主導(dǎo)地位����,包括2006年之前流行的經(jīng)典PRRSV毒株(CH-1a-like)和2006年之后流行的HP- PRRSV-like毒株���。譜系1也被稱為NADC30-like毒株,自2013年以來在全國范圍內(nèi)迅速傳播�,目前的臨床檢出率與譜系8(HP- PRRSV-like) 相當(dāng)。雖然譜系5 (BJ-4-like/VR2332-like)早在1996年就出現(xiàn)了���,但在中國一直處于非大流行狀態(tài),臨床檢出率較低����。
與譜系8(CH-1a-like)和譜系5相比,HP-PRRSV-like和NADC30- like毒株表現(xiàn)出更高的遺傳變異和重組率�。這些特征可能使現(xiàn)有疫苗失效,使其更容易逃避免疫監(jiān)視����。此外,目前的PRRS疫苗的局限性超出了它們對(duì)異源毒株的保護(hù)能力���。它們也不能滿足養(yǎng)豬業(yè)對(duì)全面和普遍保護(hù)的需求���,并有恢復(fù)毒性的風(fēng)險(xiǎn)。盡管商業(yè)疫苗在病毒學(xué)和臨床環(huán)境中對(duì)同源毒株提供了合理的保護(hù)����,但它們并非萬無一失。繼續(xù)研究和開發(fā)基因工程疫苗和標(biāo)記疫苗可以解決目前PRRS疫苗的局限性���。本文綜述了各種PRRS疫苗的優(yōu)點(diǎn)�、缺點(diǎn)和適用性���,包括改良活病毒(MLV)疫苗����、滅活疫苗���、亞單位疫苗���、活載體疫苗、DNA疫苗���、基因缺失疫苗�、合成肽疫苗�、病毒樣顆粒疫苗(VLP)疫苗以及其他各種疫苗�。目標(biāo)是為開發(fā)可以在受該疾病影響的地區(qū)增強(qiáng)對(duì)PRRSV的保護(hù)的新疫苗提供理論基礎(chǔ)����。在下一代疫苗開發(fā)的背景下,進(jìn)一步評(píng)價(jià)蛋白質(zhì)組全結(jié)構(gòu)域肽庫的篩選方法和鑒定出的抗原�,將對(duì)開發(fā)出能夠更好地在中國預(yù)防PRRSV的新疫苗,特別是針對(duì)異源毒株和遺傳變異率和重組率較高的毒株具有重要作用����。
2、MLV疫苗
自發(fā)現(xiàn)PRRSV以來���,已經(jīng)開發(fā)了幾種改良活病毒(MLV)疫苗來對(duì)抗PRRSV-1和PRRSV-2。針對(duì)PRRS1-1開發(fā)的Porcilis PRRS (Merck, Madison, NJ, USA)����、UNISTRAIN PRRS (Hipra, S.A, Amer, Spain)、Ingelvac PRRSFLEX EU (Boehringer Ingelheim, Ingelheim am Rhein, Germany)�、ReproCyc PRRS EU (Boehringer Ingelheim, Ingelheim am Rhein, Germany)和Suvaxyn PRRS MLV (Zoetis, Belgium, WI, USA)分別于2000年、2013年����、2015年、2015年和2018年獲批上市���,在西歐國家廣泛使用�。針對(duì)PRRSV-2開發(fā)的Ingelvac PRRS MLV (Boehringer Ingelheim, Ingelheim am Rhein, Germany)、Fostera PRRS (Zoetis, Belgium, WI, USA)���、PrimePac PRRS (Merck, Madison, NJ, USA)和prevent PRRS (Eli Lilly, Ind, USA)疫苗分別于1994年���、2012年、2014年和2018年獲批上市����,主要在美國使用。疫苗的功效和疫苗引起的免疫詳情見表1����。
表1.國外MLV疫苗統(tǒng)計(jì)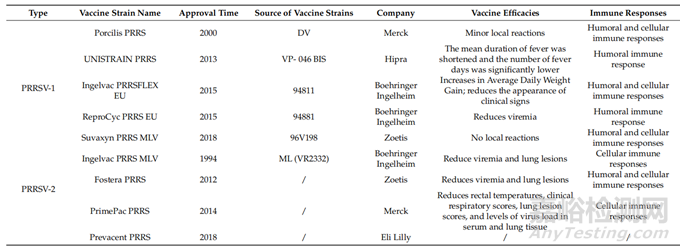
在中國,主要是針對(duì)PRRSV-2開發(fā)的PRRS疫苗�,MLV疫苗有Ingelvac PRRS、CH-1R���、R98�、JXA1-R����、TJM-F92�、HuN4-F1���、GDr-180等7種(表2)����,但沒有一種疫苗可以聲稱完全預(yù)防該病���。PRRSV����,無論是野生型還是減毒型�,都會(huì)誘導(dǎo)低水平的細(xì)胞免疫,并且直到感染后期才產(chǎn)生核NAs���。研究表明,接種疫苗后����,豬出現(xiàn)病毒血癥,但無法檢測(cè)到NAs水平�,病毒特異性γ-干擾素分泌細(xì)胞(IFN-γ-SC)頻率降低。外周血單核細(xì)胞(PBMCs)產(chǎn)生的白細(xì)胞介素-10(IL-10)水平與IFN-γ反應(yīng)呈負(fù)相關(guān)����。這些結(jié)果表明���,IFN-γ和IL-10在對(duì)PRRSV免疫的發(fā)展中起重要作用。MLV對(duì)豬的保護(hù)作用不是基于體液因素�,而是基于細(xì)胞介導(dǎo)的免疫?���?傮w而言,現(xiàn)有證據(jù)表明����,所有先前批準(zhǔn)的PRRS MLV疫苗都會(huì)引起較弱的體液和細(xì)胞免疫反應(yīng)。
表2.中國疫苗統(tǒng)計(jì)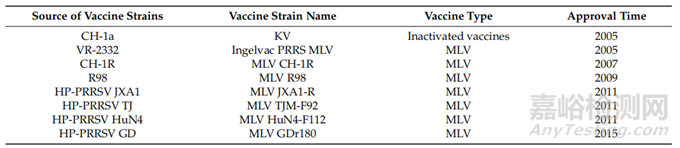
評(píng)估疫苗效力的實(shí)驗(yàn)表明���,豬呼吸與繁殖綜合征減毒活疫苗(PRRSV- MLVs)對(duì)基因同源的野生型PRRSV毒株具有足夠的保護(hù)作用����,但對(duì)異源型PRRSV毒株僅提供部分保護(hù)或沒有保護(hù)作用���。2012年���,研究表明����,與未接種MLV疫苗的豬相比����,接種疫苗的豬死亡率顯著降低,發(fā)燒天數(shù)減少���,卡他性支氣管肺炎發(fā)病率降低�,體重增長增加�,病毒血癥水平降低。該研究發(fā)現(xiàn)�,用減毒的PRRSV-1疫苗免疫可以部分保護(hù)機(jī)體免受高毒力的PRRSV-2毒株的攻擊。Bonckaert等在另一項(xiàng)檢測(cè)商業(yè)化減毒PRRSV-1亞型活疫苗UNISTRAIN有效性的實(shí)驗(yàn)中發(fā)現(xiàn)����,接種后豬的平均發(fā)熱時(shí)間縮短,發(fā)熱天數(shù)明顯低于對(duì)照豬�。少數(shù)接種疫苗的動(dòng)物出現(xiàn)發(fā)燒����、呼吸系統(tǒng)疾病和結(jié)膜炎。疫苗接種組刺激后鼻分泌物病毒平均滴度顯著低于對(duì)照組。與對(duì)照組相比����,疫苗組病毒血癥持續(xù)時(shí)間略有減少,但差異無統(tǒng)計(jì)學(xué)意義�。最近的研究表明,針對(duì)PRRSV-1的MLV疫苗可以保護(hù)1日齡仔豬在斷奶時(shí)免受異源PRRSV-1感染���。此外����,針對(duì)PRRSV-2的MLV疫苗已被證明在妊娠母豬的整個(gè)孕期對(duì)異源PRRSV-1具有交叉保護(hù)作用�。它們還對(duì)HP-PRRSV感染具有保護(hù)作用。然而����,在妊娠晚期,針對(duì)PRRSV-1的MLV疫苗只能保護(hù)后備母豬免受異源PRRSV-1的侵害�,而不能保護(hù)后備母豬免受PRRSV-2的侵害。Maragkakis等人進(jìn)行了一項(xiàng)研究�,他們觀察到與肌肉注射相比,仔豬皮內(nèi)注射PRRSV-1 MLV疫苗對(duì)其健康和生產(chǎn)性能有有益的影響�。這種積極的影響可以通過屠宰時(shí)體重的增加和肺和胸膜炎病變?cè)u(píng)分的降低來證明。因此�,目前所有的MLVs都不能提供全面的保護(hù)���,不能完全滿足養(yǎng)豬業(yè)的需求。
因?yàn)榇怪眰鞑?、出生仔豬存活數(shù)量減少以及可能在接種疫苗的宿主中引起持續(xù)感染,PRRSV-MLV的安全性面臨挑戰(zhàn)����。Charerntantanakul和Wang等人證明,接種MLV疫苗的豬在免疫后可出現(xiàn)長達(dá)四周的病毒血癥����,導(dǎo)致疫苗病毒傳播給未接種疫苗的豬。因此�,應(yīng)考慮PRRSV-MLV的安全性。自1994年Ingelvac PRRS MLV疫苗獲準(zhǔn)上市以來�,該疫苗已在中國和美國的養(yǎng)豬場(chǎng)被廣泛用于疫苗接種,并發(fā)現(xiàn)導(dǎo)致這些養(yǎng)豬場(chǎng)隨后爆發(fā)PRRS的病毒與兩國報(bào)告的疫苗株具有幾乎相同的核苷酸序列����。此外,MLVs與野生型毒株之間的重組也加劇了PRRS的爆發(fā)���。最近的研究表明�,丹麥的一種新毒株是由涉及Amervac株(單株P(guān)RRS疫苗�;Hipra)和96V198株(Suvaxyn PRRS;Zoetis AH)���。96V198菌株主要貢獻(xiàn)了該菌株的基因組成����,包括ORFs1 -2和部分ORF3����。另一方面,Amervac菌株作為次要親本����,貢獻(xiàn)了基因組的剩余部分。因此���,對(duì)新型PRRSV-MLV的研究將在疫苗的有效性和安全性方面取得突破�。
在臨床上���,MLV疫苗通常用于已經(jīng)爆發(fā)過PRRS的農(nóng)場(chǎng)���。對(duì)于沒有發(fā)生PRRS的養(yǎng)殖場(chǎng),MLV疫苗通常用于預(yù)防疾病�,而不是用于預(yù)防感染����。接種疫苗后����,疫苗中的減毒株會(huì)在豬體內(nèi)繁殖,刺激機(jī)體產(chǎn)生抗體來對(duì)抗疾病���。MLV對(duì)3-18周齡的豬具有事宜的免疫預(yù)防作用����。此外�,疫苗接種后7天內(nèi)即可發(fā)揮保護(hù)作用,保護(hù)期較長�,可達(dá)16周以上。母豬或替代后備母豬的免疫接種也能提高其繁殖性能�。疫苗毒株決定減毒疫苗的有效性,PRRSV基因多樣性影響減毒疫苗的有效性���。此外���,該疫苗對(duì)同源毒株具有良好的預(yù)防作用。MLVs對(duì)預(yù)防PRRS有特殊作用���;然而���,由于潛在的安全問題,在使用前應(yīng)仔細(xì)選擇疫苗株���。
3�、滅活疫苗
與MLV疫苗相比����,PRRSV滅活疫苗由于安全性提高,已在全球范圍內(nèi)獲得許可�。在中國和其他國家有許多針對(duì)PRRSV-2株(CH-1a、ISU-P����、JXA1、VD-A1和SD-1)和PRRSV-1株(LV���、VD-E1�、VD-E2和PRRS-CY-218-JPD-P5-6-91或Olot)的市售滅活疫苗�。然而,自2005年以來���,由于觀察到這些疫苗的療效較差�,美國已不再提供這些疫苗。Opriessnig等人證實(shí)�,PRRSV滅活疫苗可縮短感染后病毒在公豬精液中的持續(xù)時(shí)間。然而�,Nilubol在2年后用同一來源的滅活疫苗(PRRomisee、Intervir����、VR-2402疫苗株)對(duì)公豬進(jìn)行免疫,但未能顯示精液中病毒含量的減少����。兩項(xiàng)試驗(yàn)的不同之處是,前一項(xiàng)研究使用的感染株與疫苗株(VR-2402)相同���,后一項(xiàng)研究使用的感染株為VR-2385���,這說明滅活疫苗誘導(dǎo)的交叉保護(hù)較弱。與此同時(shí)�,一些報(bào)道闡明了PRRSV滅活疫苗對(duì)野生病毒感染的不良影響,其表現(xiàn)為缺乏可檢測(cè)到的PRRSV特異性抗體產(chǎn)生和細(xì)胞介導(dǎo)的免疫(CMI)應(yīng)答���。在兩種基因型PRRSV滅活疫苗誘導(dǎo)的PRRSV特異性免疫應(yīng)答(KV/ADJ���、Progressis����、Merial Labs����、PRRSV-1和PRRomisee�、Intervet、PRRSV-2)中�,病毒NAs的滴度一般低于8,不能有效清除PRRSV����。因此,在體內(nèi)實(shí)驗(yàn)中���,PRRSV滅活疫苗在感染野生型PRRSV的豬之間沒有產(chǎn)生統(tǒng)計(jì)學(xué)差異����。
PRRSV滅活疫苗具有安全�、儲(chǔ)存方便、便于運(yùn)輸?shù)葍?yōu)點(diǎn)���,一般情況下���,母源抗體對(duì)PRRSV滅活疫苗的干擾較弱�。此外����,接種滅活疫苗的母豬死胎數(shù)和流產(chǎn)率明顯降低���,母豬的繁殖力和仔豬存活率均有提高����。然而���,滅活疫苗也有一定的缺點(diǎn)����,如對(duì)異源毒株的免疫效果差����,接種劑量大,需多次免疫,成本高���,產(chǎn)生免疫需要特定的一段時(shí)間����。國內(nèi)分離的病毒株(CH-1a株)制成的滅活油佐劑疫苗具有良好的免疫調(diào)節(jié)作用����,且維持時(shí)間較長。第二次免疫后僅20天豬即能獲得免疫���,這是至關(guān)重要的����。它還為80%以上接種過疫苗的豬提供了良好的保護(hù)����,并可提供長達(dá)6個(gè)月的免疫期�。野生型病毒株(SI株)滅活油佐劑疫苗適用于仔豬免疫�。一旦動(dòng)物接種疫苗�,它可以提供超過6個(gè)月的保護(hù)。同時(shí),該疫苗還可用于替代后備母豬和公豬的接種���。最近的研究證實(shí)了匈牙利成功實(shí)施了PRRS根除規(guī)劃���。這一成就是通過給母豬注射滅活疫苗和對(duì)其后代采用隔離飼養(yǎng)來實(shí)現(xiàn)的。值得注意的是����,在整個(gè)種群更替過程中,生產(chǎn)幾乎保持不間斷����。一些研究表明,使用MLV疫苗和滅活疫苗的組合可以增強(qiáng)豬對(duì)不被PRRSV感染的保護(hù)����。在母豬妊娠第8周接種MLV疫苗,然后在分娩前3周再次接種商業(yè)滅活疫苗�,可有效降低PRRSV的發(fā)生率。并且����,有研究指出,斷奶仔豬PRRSV血清陽性個(gè)體的比例更高���。此外�,MLV疫苗與滅活疫苗聯(lián)合使用可對(duì)仔豬提供部分保護(hù)�,減少病理性肺損失,改善體重增加����,降低病毒血癥����。這種影響可能歸因于滅活疫苗誘導(dǎo)母豬產(chǎn)生NAs??傊?���,這些數(shù)據(jù)表明�,滅活PRRSV疫苗可能在治療PRRSV方面具有潛在的治療作用,而不是預(yù)防疾病�。因此���,在開發(fā)含有佐劑的新配方之前���,可能需要進(jìn)一步探索滅活疫苗的治療益處�。
4、亞單位疫苗
亞單位疫苗又稱生物合成亞單位疫苗���,是將特異性抗原編碼基因插入易增殖的病毒或細(xì)胞中�,表達(dá)有效的特異性抗原并對(duì)其進(jìn)行純化而制成的���。雖然它們是安全穩(wěn)定的���,但它們的免疫原性通常很低���。免疫原性的PRRSV蛋白以結(jié)構(gòu)和非結(jié)構(gòu)形式存在����。該病毒有六種膜蛋白���,標(biāo)記為主要((GP5和M)和次要(GP2a����、E����、GP3和GP4)包膜蛋白�。GP5是最豐富的糖蛋白���,也是NAs的主要誘導(dǎo)劑�,但在PRRSV毒株間差異較大。M蛋白是一種高度保守的非糖基化的結(jié)構(gòu)蛋白�,有助于病毒的組裝和出芽。在感染病毒的細(xì)胞中�,GP5和M存在于由共價(jià)二硫鍵連接的“異二聚體復(fù)合物”中����。N蛋白在病毒感染細(xì)胞中最為豐富����,約占病毒粒子的40%。次要包膜蛋白通過非共價(jià)相互作用在感染細(xì)胞中形成“異四聚體復(fù)合物”���。除了GP5�,次要蛋白也具有病毒中和的B細(xì)胞抗原表位���。PRRSV的潛在T細(xì)胞表位存在于蛋白GP3、GP4���、GP5����、M�、N����、NSP2、NSP5���、NSP9和NSP10中���。為了誘導(dǎo)有效的抗PRRSV免疫,在創(chuàng)新疫苗配方中以“異二聚體和異四聚體復(fù)合物”的形式暴露免疫原性病毒蛋白���,以有效誘導(dǎo)特異性和保護(hù)性B細(xì)胞和T細(xì)胞反應(yīng)是至關(guān)重要的�。在PRRSV發(fā)現(xiàn)后不久���,桿狀病毒表達(dá)的PRRSV結(jié)構(gòu)蛋白被作為潛在的亞單位疫苗進(jìn)行了測(cè)試。在最早的研究中���,Plana等通過構(gòu)建PRRSV ORF2-ORF7表達(dá)載體進(jìn)行了動(dòng)物免疫試驗(yàn)。結(jié)果顯示GP3和GP5具有特異性保護(hù)作用����,這表明GP3和GP5亞單位疫苗具有良好的免疫原性,可作為開發(fā)重組亞單位疫苗的候選基因�。此后,也測(cè)試了一種抗PRRSV的轉(zhuǎn)基因植物口服亞單位疫苗���。然而,基于植物的實(shí)驗(yàn)性疫苗與基于桿狀病毒的亞單位疫苗具有相同的缺陷;具體而言�,其對(duì)豬的功效有限�。Song等通過重疊PCR擴(kuò)增出缺失信號(hào)肽和跨膜序列的GP5基因截?cái)嗥?,將其插入原核表達(dá)載體pET-32a或pGEX-6p-1中,添加His或GST標(biāo)簽誘導(dǎo)表達(dá)和純化�,并進(jìn)行動(dòng)物實(shí)驗(yàn)。結(jié)果表明����,鼠傷寒沙門菌鞭毛蛋白是一種有效的佐劑����,因?yàn)樗梢栽鰪?qiáng)抗GP5抗體的誘導(dǎo),并誘導(dǎo)體液和細(xì)胞免疫反應(yīng)���。然而�,本研究是在小鼠模型上進(jìn)行動(dòng)物免疫實(shí)驗(yàn)����,該疫苗在豬身上的效果尚不完全清楚�。轉(zhuǎn)基因玉米愈傷組織產(chǎn)生PRRSV M蛋白,并通過口服轉(zhuǎn)基因植物組織誘導(dǎo)小鼠血清和腸黏膜抗原特異性抗體�。結(jié)果表明���,轉(zhuǎn)基因玉米是生產(chǎn)亞單位疫苗的有效途徑�,可產(chǎn)生對(duì)PRRSV的全身和粘膜免疫應(yīng)答���。An等]在擬南芥植物中成功表達(dá)了PRRSV衍生的抗原蛋白,實(shí)現(xiàn)了重組蛋白疫苗的成功生產(chǎn)�。Peng等比較了四種天然佐劑的免疫增強(qiáng)作用以提高PRRSV亞單位疫苗的效力,結(jié)果發(fā)現(xiàn)黃芪/芽孢桿菌佐劑對(duì)PRRSV GP5亞單位的免疫增強(qiáng)作用最為有效���。Peng等也研究了泰山馬尾松花粉多糖(TPPPS)和Freund佐劑對(duì)PRRSV亞單位疫苗的免疫增強(qiáng)作用�。基于上述結(jié)果�,預(yù)計(jì)中等劑量的TPPPS作為GP5佐劑可成為候選PRRSV亞單位疫苗����。
與傳統(tǒng)疫苗相比,亞單位疫苗不含核酸物質(zhì)����;因此�,它們更安全����。動(dòng)物免疫不會(huì)導(dǎo)致持續(xù)感染���,故其免疫反應(yīng)可與野生病毒感染的免疫反應(yīng)區(qū)別開來。一些研究表明���,在妊娠晚期接種PRRSV亞單位疫苗可有效預(yù)防由異種PRRSV-1和PRRSV-2感染引起的生殖失敗。這有利于預(yù)防和控制各種疾病����。但其生產(chǎn)成本較高���,免疫原性可能優(yōu)于減毒疫苗或滅活疫苗;因此�,它的發(fā)展時(shí)間相對(duì)較長。從長遠(yuǎn)來看�,PRRSV亞單位疫苗在預(yù)防和控制PRRSV方面具有廣闊的應(yīng)用前景。然而�,其免疫持續(xù)時(shí)間短,必須與佐劑聯(lián)合使用�。佐劑通過增強(qiáng)參與抗原免疫應(yīng)答的巨噬細(xì)胞的活性來促進(jìn)T細(xì)胞或B細(xì)胞的應(yīng)答。研究發(fā)現(xiàn)多種細(xì)胞因子可增強(qiáng)疫苗的特異性免疫應(yīng)答����;因此���,開發(fā)具有有益作用的佐劑將有助于增強(qiáng)PRRSV亞單位疫苗的特異性免疫應(yīng)答����。
5���、活載體疫苗
利用基因工程技術(shù)將重組PRRSV抗原基因轉(zhuǎn)化為能夠表達(dá)外源病毒蛋白的活載體,制備了PRRSV活載體疫苗���。該疫苗經(jīng)動(dòng)物直接免疫后可引起特異性免疫應(yīng)答[83]���。PRRSV活載體疫苗主要以痘病毒、腺病毒�、皰疹病毒和豬偽狂犬病毒(PRV)為載體表達(dá)PRRSV中心免疫原性基因。Alonso等成功構(gòu)建了表達(dá)GP5蛋白的重組傳染性胃腸炎病毒���,并檢測(cè)到高水平的GP5特異性抗體����。Fang等構(gòu)建了表達(dá)PRRSV GP5和M蛋白的重組PRV載體���。結(jié)果表明����,重組病毒載體疫苗能誘導(dǎo)NA的產(chǎn)生,并能刺激淋巴細(xì)胞增殖����。Tian等以PRRSV (DS722株)為活病毒載體,構(gòu)建了表達(dá)豬流感病毒(SIV)和豬圓環(huán)病毒2型(PCV-2)保護(hù)性抗原的多組分疫苗病毒DS722-SIV- PCV2���。實(shí)驗(yàn)結(jié)果表明,DS722-SIV-PCV2具有作為PRRSV三價(jià)候選疫苗的潛力����,同時(shí)也揭示了其作為PRRSV活疫苗載體的可能性�。近年來的研究表明����,表達(dá)豬瘟病毒E2蛋白的重組PRRSV載體的候選疫苗rPRRSV-E2是有效預(yù)防和控制HP-PRRSV和豬瘟的必要條件����。近年來,活病毒載體在PRRSV疫苗研究中顯示出巨大的潛力����,但其生產(chǎn)成本高�,效率低,且載體病毒也可能引發(fā)免疫反應(yīng)����,從而降低疫苗的有效性。盡管研究人員仍然不了解病毒的自然發(fā)生����,但人們對(duì)活病毒載體疫苗株與野生或減毒病毒疫苗株之間是否會(huì)發(fā)生重組存在疑問�。盡管如此,我們相信隨著生物技術(shù)的發(fā)展���,活病毒載體疫苗有可能成為PRRSV疫苗領(lǐng)域的焦點(diǎn)����。
6、DNA疫苗
DNA疫苗又稱核酸或基因疫苗�,其原理是將產(chǎn)生病原微生物特異性抗原的真核表達(dá)載體直接引入動(dòng)物體內(nèi)���,刺激產(chǎn)生典型的免疫反應(yīng)���。Kwang等構(gòu)建了PRRSV ORF4-ORF7四種重組DNA疫苗,并進(jìn)行了動(dòng)物免疫試驗(yàn)���。通過ELISA�、病毒中和和Western blotting分析,71%的免疫動(dòng)物檢測(cè)到PRRSV特異性抗體�。此外�,通過IFN-γ和/或增殖試驗(yàn),86%的免疫豬檢測(cè)到細(xì)胞免疫應(yīng)答�。結(jié)果證實(shí)PRRSV抗原中和表位主要集中在GP4和GP5蛋白上,表明DNA疫苗可誘導(dǎo)體液免疫和細(xì)胞免疫����。Siriseewan等人發(fā)現(xiàn),在MLV免疫前2周使用編碼截?cái)郟RRSV N蛋白的DNA疫苗進(jìn)行預(yù)免疫����,可以提高PRRSV特異性免疫,這可以通過增加NA滴度和PRRSV特異性IFN-γ的產(chǎn)生以及減少IL-10和PRRSV特異性Treg的產(chǎn)生來觀察����。用PRRSV GP5嵌合序列構(gòu)建的DNA疫苗也與陽離子脂質(zhì)體絡(luò)合���,并皮下和肌肉注射到實(shí)驗(yàn)豬體內(nèi)���。結(jié)果顯示,接種GP5-Mosaic疫苗的豬外周血單個(gè)核細(xì)胞中IFN-γ mRNA的表達(dá)量顯著高于對(duì)照組���。“自殺式”DNA疫苗是一種基于病毒復(fù)制子開發(fā)的新型DNA疫苗。Sun等利用PRRSV GP5和CSFV E2基因構(gòu)建了“自殺式”DNA疫苗pSFV1CS-E2����。結(jié)果表明,“自殺式”DNA疫苗pSFV1CS-E2共表達(dá)GP5和E2���,可誘導(dǎo)對(duì)PRRSV和CSFV的特異性體液和細(xì)胞介導(dǎo)的免疫應(yīng)答���。Jiang等通過構(gòu)建GP5m和PRRSV M蛋白共表達(dá)的“自殺式”DNA疫苗,即PSFV-ORF5m/ORF6���,并報(bào)道了與PSFV-ORF5m/ORF6相關(guān)的典型免疫反應(yīng)����。本實(shí)驗(yàn)也為PRRSV DNA疫苗的研制提供了新的思路和途徑����。與傳統(tǒng)疫苗相比����,DNA疫苗更安全,制備過程更簡單����;雖然生產(chǎn)周期短�,但基于DNA的疫苗與其他方法具有相同的缺點(diǎn)���,如免疫原性低����,不能充分解決PRRSV的異質(zhì)性。“自殺式”DNA疫苗因其安全�、高效和易于制備����,是DNA疫苗發(fā)展的重大突破。蛋白質(zhì)的低表達(dá)可歸因于抗原呈遞細(xì)胞對(duì)DNA疫苗質(zhì)粒的攝取不足�。研究人員已經(jīng)探索了遞送DNA疫苗的替代途徑和方法,以增強(qiáng)其吸收�。皮下注射針已被研究作為通常的皮下和肌肉注射途徑的替代���。其他方法����,如透皮���、粘膜和微針應(yīng)用,以及噴射注射和電穿孔,也已經(jīng)過測(cè)試����,以提高DNA疫苗的免疫原性。
7���、基因缺失疫苗
基因缺失疫苗是利用基因工程技術(shù)切除毒株的毒力相關(guān)基因而構(gòu)建的。Leng等獲得了PRRSV基因缺失疫苗株TJM-F92���,可在豬的任何生長期接種����,保護(hù)率為80%����。Xu等通過刪除HuN4-F112減毒疫苗NSP2區(qū)的75個(gè)核苷酸���,構(gòu)建了感染性cDNA克隆。將編碼新城疫病毒核蛋白(NP)的免疫顯性B細(xì)胞表位基因片段插入缺失位點(diǎn)�。用重組PRRSV免疫仔豬,然后攻毒����,接種仔豬產(chǎn)生NP和PRRSV特異性抗體,但沒有NSP2抗體�。實(shí)驗(yàn)組免疫仔豬在攻毒后無臨床體征�,對(duì)照組免疫仔豬在攻毒后10 d全部死亡。結(jié)果表明�,重組PRRSV rHuN4-F112-?508-532可作為PRRS的標(biāo)記疫苗。Hu等構(gòu)建了帶有CMV啟動(dòng)子的日本腦炎病毒(JEV)活疫苗SA14-14-2���,并基于JEV DNA將PRRSV GP5/M插入復(fù)制子的缺失位點(diǎn),開發(fā)出Balb/c嵌合復(fù)制子候選疫苗pJEVREP-G-2A-M-IRES和pJEV-REP-G-2A-M用于動(dòng)物免疫檢測(cè)����。ELISA數(shù)據(jù)分析顯示,GP5/M復(fù)制子誘導(dǎo)較好的免疫應(yīng)答�;因此,基于GP5/M JEV DNA的復(fù)制子可以進(jìn)一步開發(fā)成為一種新的����、安全的PRRSV候選疫苗����。Zhou等對(duì)2012- 2016年收集的61個(gè)PRRSV NSP2高變區(qū)(NSP2HVs)和ORF5進(jìn)行了測(cè)序,除典型的30個(gè)氨基酸不連續(xù)缺失外,PRRSV中還檢測(cè)到5個(gè)NSP2HVs缺失���;因此,本研究提出了一種可用于PRRSV基因缺失疫苗開發(fā)的方法���?��;騽h除疫苗通過選擇性地刪除或突變與毒力相關(guān)的基因,將高傳染性病毒修飾為弱病毒����。這種改變確保疫苗保持其免疫原性�,同時(shí)防止病毒在動(dòng)物中輕易恢復(fù)其毒力。此外����,它允許明確區(qū)分野生病毒的自然感染和通過疫苗接種獲得的免疫。目前�,基因缺失疫苗被廣泛用作PRRSV疫苗,相應(yīng)的開發(fā)技術(shù)也將有助于新型PRRSV疫苗的研發(fā)����。
8、合成肽疫苗
合成肽疫苗是以病毒基因組序列衍生的病毒蛋白氨基酸序列為基礎(chǔ)�,采用化學(xué)合成技術(shù)人工合成的疫苗。它們通常通過與佐劑偶聯(lián)來制備����。Mokhtar等利用合成全蛋白質(zhì)組的肽庫���,對(duì)免疫PRRSV-1Olot/91的小群豬進(jìn)行反復(fù)檢測(cè)和感染,較好地證明了T細(xì)胞對(duì)PRRSV-1的應(yīng)答�。然而,蛋白質(zhì)組全結(jié)構(gòu)域肽庫的篩選方法和鑒定的抗原需要在下一代疫苗開發(fā)的背景下進(jìn)一步評(píng)估����。Mokhtar等發(fā)現(xiàn)M和NSP5蛋白是多功能CD8和CD4T細(xì)胞的保守靶點(diǎn)。然后����,通過摻入合成的多聚TLR2/TLR7興奮劑���,將代表M和NSP5的肽包被在疏水修飾的殼聚糖顆粒中����,并與含有模型B細(xì)胞PRRSV抗原的佐劑一起使用。結(jié)果顯示CD8 T細(xì)胞對(duì)M/ NSP5特異性IFN-γ有顯著應(yīng)答����;然而���,未來的工作應(yīng)側(cè)重于增強(qiáng)M/NSP5與CD8 T細(xì)胞的交叉呈遞���。在合成肽疫苗的開發(fā)中,我們應(yīng)著重加強(qiáng)M/NSP5與CD8 T細(xì)胞的交叉呈遞�。
合成肽疫苗作為一種新型疫苗�,起步較晚,但具有良好的安全性���、穩(wěn)定性和較低的生產(chǎn)成本���。這有助于根據(jù)疫情快速開發(fā)出有效的靶向疫苗,具有良好的發(fā)展前景�。然而����,合成肽疫苗是通過人工合成的方式生產(chǎn)的�,單個(gè)線性抗原表位在豬體內(nèi)的保護(hù)能力可能不太好�,免疫原性較低���。因此����,串聯(lián)多個(gè)中和性表位并添加合適的佐劑是目前增強(qiáng)合成肽疫苗免疫原性的有效手段���,深入研究豬PRRSV與免疫系統(tǒng)的空間構(gòu)象是進(jìn)一步開發(fā)合成肽疫苗的關(guān)鍵。
9�、VLP疫苗
VLP是由一種或幾種體外表達(dá)的病毒結(jié)構(gòu)蛋白組裝而成的中空蛋白顆粒�。它們的外觀與天然病毒顆粒相似,但它們不含核酸�,因此不能繁殖,也沒有致病性���。它們直徑約為20 - 150nm,具有良好的免疫原性���,可以在低免疫誘導(dǎo)劑量下使用���。免疫后可誘導(dǎo)體液免疫�、細(xì)胞免疫和粘膜免疫�。
VLP疫苗已被商業(yè)化開發(fā)用于預(yù)防和控制其他疾病,臨床效果良好���。研究人員還探索了PRRSV VLP疫苗的開發(fā)并取得了具體進(jìn)展。先前的研究表明�,PRRSV VLPs的形成需要兩種以上的蛋白。采用桿狀病毒表達(dá)系統(tǒng)制備的含有PRRSV GP5和M蛋白的VLPs的免疫活性與天然蛋白沒有差異�,用不同劑量的VLPs免疫小鼠均表現(xiàn)出特異性免疫活性。有研究表明GP2b在促進(jìn)VLPs釋放中起重要作用���。PRRSV的免疫原性基因也可以嵌入到其他病原體的免疫原性基因中合成VLPs�,用于同時(shí)防治多種病原體�。Wang等制備了與主要免疫原性蛋白SIV和PRRSV嵌合的VLPs�。動(dòng)物免疫試驗(yàn)發(fā)現(xiàn),嵌合VLPs可能是一種安全有效的PRRSV和SIV候選疫苗����,并能在體內(nèi)誘導(dǎo)細(xì)胞和體液免疫反應(yīng)。Kang等通過肌注���、飲水�、滴鼻等方法制備由PCV2�、豬細(xì)小病毒和PRRSV主要免疫原性蛋白組成的VLPs,并免疫豬�,測(cè)試其免疫誘導(dǎo)效果。結(jié)果表明�,VLPs可以同時(shí)刺激豬對(duì)三種病原體的體液和細(xì)胞免疫反應(yīng)�,在豬的所有階段都具有保護(hù)作用,并且可以用作多種疾病的疫苗�。這為開發(fā)新疫苗提供了基礎(chǔ)����。利用大腸桿菌表達(dá)系統(tǒng)也表達(dá)了乙型肝炎病毒核心蛋白與PRRSV GP5的融合蛋白����,該融合蛋白可以獨(dú)立組裝形成VLPs。體外實(shí)驗(yàn)表明����,VLPs能夠抑制PRRSV對(duì)細(xì)胞的感染,且越高濃度的VLPs抑制效果越好�。利用新的桿狀病毒表達(dá)系統(tǒng)進(jìn)一步制備了含有PRRSV GP5-GP4-GP3-GP2a-M蛋白的VLPs。將PLGA納米顆粒包埋后���,通過鼻內(nèi)滴注免疫豬����,然后激發(fā)檢測(cè)對(duì)免疫的影響���。結(jié)果表明�,免疫后豬體內(nèi)同時(shí)誘導(dǎo)體液免疫和細(xì)胞免疫���,可顯著降低豬肺中的病毒載量。然而����,關(guān)于PRRS VLP疫苗的研究才剛剛開始。PRRSV中能夠促進(jìn)VLPs形成并保持良好免疫原性的蛋白和能夠提高免疫誘導(dǎo)效果的佐劑有待進(jìn)一步探索�。
10、潛在的有效疫苗
佐劑對(duì)于滅活疫苗的免疫調(diào)節(jié)作用至關(guān)重要���。常用的佐劑主要有不溶性鋁鹽、礦物油佐劑、蜂膠���、微生物及其代謝物�、免疫刺激復(fù)合物�、細(xì)胞因子等���。使用納米顆粒包封的PRRSV滅活疫苗和聚乳酸-乙醇酸或結(jié)核分枝桿菌全細(xì)胞裂解液作為佐劑的鼻內(nèi)注射策略已被廣泛用于誘導(dǎo)針對(duì)異種PRRSV毒株的交叉保護(hù)性抗PRRSV免疫�。此外���,由大腸桿菌和人參皂苷Rg1的耐熱性腸毒素B亞基組成的鼻內(nèi)佐劑加入滅活的PRRSV疫苗中���,可以上調(diào)IFN-I信號(hào)轉(zhuǎn)導(dǎo)���,增強(qiáng)小鼠的耐藥反應(yīng);然而���,還需要進(jìn)一步的研究來評(píng)估這種聯(lián)合佐劑對(duì)豬的免疫保護(hù)效果�。toll樣受體(TLR)激動(dòng)劑9可減少疫苗接種后的病毒血癥并增強(qiáng)非抗原特異性IFN-γ水平�。因此,它有望成為與滅活疫苗聯(lián)合使用的一種有前景的佐劑�。Chen等采用新型PRRSV特異性IgM單克隆抗體(Mab)-PR5nf1作為疫苗佐劑,將滅活的PRRSV(KIV)和Mab-PR5nf1與標(biāo)準(zhǔn)佐劑混合制備�,增強(qiáng)PRRSV-KIV疫苗介導(dǎo)的保護(hù)作用,并將其與普通的KIV和MLV疫苗對(duì)免疫系統(tǒng)的作用進(jìn)行比較���。結(jié)果表明����,在PRRSV-KIV疫苗中添加PRRSV特異性IgM���,血清IFN-γ定量和IFN-γ ELISpot檢測(cè)顯示,PRRSV-KIV疫苗可顯著提高總生存率和CMI�。因此,這種獨(dú)特的配方與新佐劑結(jié)合����,可能會(huì)增強(qiáng)對(duì)PRRSV滅活疫苗的免疫應(yīng)答�。最近的研究也表明,豬腸道菌群可以減少接種滅活疫苗時(shí)的應(yīng)激反應(yīng)����,這可能引導(dǎo)開發(fā)新的策略來提高疫苗的效力�。在他們的研究中����,Maragkakis等人重點(diǎn)研究了接種PRRSV MLV的ID和IM疫苗對(duì)Fas相關(guān)細(xì)胞凋亡的影響。結(jié)果顯示���,PRRSV病毒載量與Fas水平存在顯著正相關(guān)和中度相關(guān)。接種豬血清Fas水平升高提示細(xì)胞凋亡受到抑制���。這項(xiàng)研究從不同的角度揭示了MLV疫苗的潛在作用����。
最優(yōu)免疫方案不僅與免疫劑量和加強(qiáng)免疫間隔有關(guān)�,而且疫苗接種途徑也是重要因素。常見的疫苗接種方法有肌肉注射���、皮內(nèi)注射和皮下注射。不同接種途徑誘導(dǎo)的免疫應(yīng)答強(qiáng)度也各不相同���。肌肉組織只含有少量的常駐免疫細(xì)胞。然而���,肌肉注射疫苗會(huì)導(dǎo)致免疫細(xì)胞的大量募集和局部炎癥反應(yīng)�。皮膚富含大量具有免疫功能的細(xì)胞,參與炎癥����、修復(fù)和免疫反應(yīng)的初始階段���。皮下組織主要由脂肪細(xì)胞組成���,只有少量巨噬細(xì)胞和淋巴細(xì)胞。最近的研究表明����,皮內(nèi)注射可能會(huì)降低IL-10和IFN-γ-SC的水平,從而提高疫苗的療效����。腸道菌群對(duì)PRRS-MLV疫苗的有效性起著至關(guān)重要的作用���,為提高M(jìn)LV疫苗的有效性提供了新的思路�。
為了解決現(xiàn)有疫苗免疫原性差的問題����,研究人員找到了提高疫苗效力的方法�。VCSL1-GP5-N33D是利用反向遺傳技術(shù)開發(fā)的低糖基化嵌合病毒�,含有韓國家譜-1野生型株的GP5外區(qū)���。在發(fā)生PRRSV流行的豬場(chǎng)應(yīng)用vCSL1-GP5-N33D滅活疫苗可獲得較高的血清病毒中和抗體滴度����,但陰性對(duì)照中沒有豬出現(xiàn)SVN抗體滴度����。動(dòng)物實(shí)驗(yàn)的總體結(jié)果表明,vCSL1-GP5-N33D滅活疫苗是一種有希望的候選疫苗����。Cui等針對(duì)GP5-Mosaic開發(fā)了GP5-Mosaic DNA Vaccine Prime/GP5-Mosaic rVaccine����,實(shí)驗(yàn)結(jié)果表明,接種基于GP5-Mosaic的疫苗可導(dǎo)致VR2332和MN184C PRRSV株產(chǎn)生細(xì)胞反應(yīng)性和更高水平的NAs�。此外,在MN184C或VR2332攻擊后����,血清、組織���、PAMS和支氣管肺泡灌洗液中的病毒載量顯著降低,肺部病變較輕���。結(jié)果表明����,采用DNA引物/VACV增強(qiáng)方案的GP5-Mosaic疫苗可以保護(hù)豬免受異源病毒的感染���。
11���、總結(jié)與展望
PRRS是全球養(yǎng)豬業(yè)最嚴(yán)重的疾病之一,它可以損害豬的免疫器官�,引起免疫抑制,并增加對(duì)其他疾病的易感性����。PRRSV與ADE現(xiàn)象相關(guān)����,容易發(fā)生突變�。不同的病毒株需要更好的交叉保護(hù)�,這使得開發(fā)傳統(tǒng)疫苗具有挑戰(zhàn)性。目前的滅活疫苗具有免疫誘導(dǎo)作用持續(xù)時(shí)間短����、接種劑量大�、成本高的特點(diǎn)。此外����,MLVs的毒力也有增加的風(fēng)險(xiǎn)。此外�,很難確定抗體是在應(yīng)對(duì)野生病毒感染或疫苗免疫時(shí)產(chǎn)生的。DNA����、亞單位或病毒載體疫苗也已進(jìn)行了測(cè)試,但它們作為PRRSV-MLV替代品的潛在價(jià)值仍不確定(表3)���。商業(yè)化的VLP疫苗產(chǎn)品很少,還有許多問題需要解決,如基因序列的選擇和優(yōu)化���、表達(dá)系統(tǒng)的選擇���、表達(dá)量的提高����、VLP的大規(guī)模純化、成本的降低����、佐劑的選擇和添加比例等���。以及疫苗功效的評(píng)價(jià)����。因此����,迫切需要開發(fā)一種新的疫苗來預(yù)防和控制這種疾病。此外���,在系統(tǒng)分析的基礎(chǔ)上�,可以利用DNA重組或合成PRRSV結(jié)構(gòu)蛋白基因片段來開發(fā)新的PRRSV雜交毒株���。此外���,如果NAs的保守表位能夠被識(shí)別和表征,則可以在設(shè)計(jì)中考慮這種新的雜交基因誘導(dǎo)針對(duì)異種PRRSV的交叉保護(hù)的能力�。可被期待的是�,結(jié)合先進(jìn)技術(shù)設(shè)計(jì)的PRRSV疫苗將比現(xiàn)有疫苗表現(xiàn)出更好的有效性和安全性?���?傊?��,本文建議在PRRSV疫苗開發(fā)領(lǐng)域需要繼續(xù)進(jìn)行研究和開發(fā)�,以解決現(xiàn)有疫苗的局限性���,并提供更好的PRRSV保護(hù)�。
表3.幾種PRRSV疫苗的比較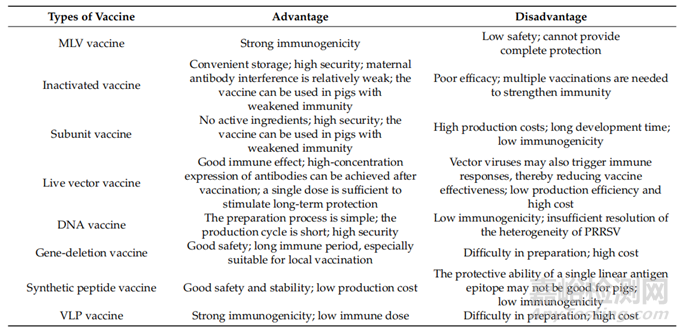
參考資料:Zhang H, Luo Q, He Y, Zheng Y, Sha H, Li G, Kong W, Liao J, Zhao M. Research Progress on the Development of Porcine Reproductive and Respiratory Syndrome Vaccines. Vet Sci. 2023 Jul 28;10(8):491. doi: 10.3390/vetsci10080491. PMID: 37624278; PMCID: PMC10459618.



