隨著“以患者為中心”的研發(fā)理念逐步成熟,依托于創(chuàng)新技術(shù)的疫苗藥學(xué)研究策略也在不斷升級(jí)�����。本文聚焦于疫苗產(chǎn)品有效性評(píng)價(jià)的痛點(diǎn)開展分析�����,具有免疫原性替代終點(diǎn)的成熟疫苗遠(yuǎn)遠(yuǎn)少于當(dāng)前在研疫苗數(shù)量��,研發(fā)過(guò)程更應(yīng)加強(qiáng)過(guò)程控制��,在難以避免的研發(fā)變更中基于質(zhì)量可比要求有效評(píng)估關(guān)鍵質(zhì)量屬性��,實(shí)現(xiàn)每一道生產(chǎn)工序工藝質(zhì)量可比�,以此優(yōu)化研究策略���。
近年來(lái)����,因人民生活水平提升、疾病預(yù)防需求增加�����、技術(shù)迭代加速等因素��,疫苗產(chǎn)品在我國(guó)醫(yī)藥市場(chǎng)的消費(fèi)占比呈上升趨勢(shì)�。而《疫苗管理法》《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》等政策法規(guī)的出臺(tái),顯示國(guó)家政策層面積極鼓勵(lì)疫苗企業(yè)加強(qiáng)研發(fā)與技術(shù)創(chuàng)新��,對(duì)我國(guó)疫苗行業(yè)的發(fā)展提出了更高的標(biāo)準(zhǔn)與要求��。這也就要求廣大疫苗企業(yè)擯棄傳統(tǒng)研發(fā)觀念��,基于“以患者為中心”的理念�,從傳統(tǒng)數(shù)據(jù)收集逐步聚焦到患者需求本身,堅(jiān)持以患者為中心��,即從患者角度進(jìn)行藥物開發(fā)�����、設(shè)計(jì)��、實(shí)施和決策��,將患者對(duì)藥品安全性、有效性等的關(guān)鍵需求納入研發(fā)設(shè)計(jì)�����、工藝開發(fā)等關(guān)鍵考慮要素中 [1]����。
1、疫苗有效性評(píng)價(jià)痛點(diǎn)分析
疫苗作為特殊的生物制劑�����,作用原理為通過(guò)誘導(dǎo)產(chǎn)生特異性免疫應(yīng)答使健康人群免于患病�����,主要面向健康人群���,對(duì)安全性和有效性的要求比普通藥物更高。區(qū)別于普通藥物的特性在于其預(yù)防效果不能直觀體現(xiàn)�,評(píng)價(jià)疫苗的傳統(tǒng)方法是比較疫苗組和安慰劑組的臨床終點(diǎn)事件發(fā)生率(臨床保護(hù)性研究),但是存在研發(fā)周期長(zhǎng)���、入組人數(shù)多�、費(fèi)用高昂等問(wèn)題�����,限制了產(chǎn)品獲批上市的速度��,當(dāng)前行業(yè)內(nèi)已在積極探索通過(guò)臨床替代終點(diǎn)評(píng)價(jià)疫苗的有效性�����。
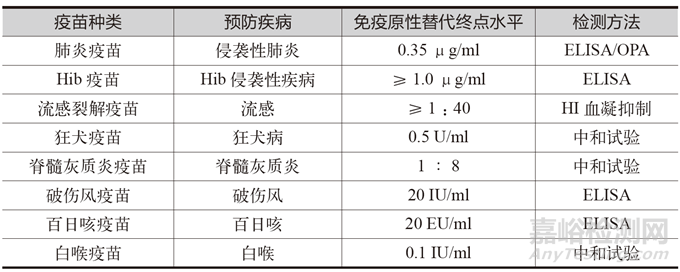
世界衛(wèi)生組織(WHO)提出了免疫臨床替代終點(diǎn)概念�����,突出可預(yù)測(cè)疫苗保護(hù)效果的免疫學(xué)反應(yīng)指標(biāo)建立的重要性���,能有效減少人群樣本量�?;谝呙缫延?200 多年的成熟發(fā)展歷史,部分疫苗已建立了免疫學(xué)的臨床替代終點(diǎn)��,有相對(duì)明確的免疫學(xué)指標(biāo)����,即有相關(guān)性����、明確的閾值和統(tǒng)一的檢測(cè)方法����,能夠通過(guò)免疫后一定時(shí)間(7 天、14 天�����、28 天)內(nèi)抗體終點(diǎn)水平以及非劣效水平判斷主要免疫終點(diǎn)����,或通過(guò)其他時(shí)間的抗體水平、免疫持續(xù)性等判斷次要免疫終點(diǎn)���,代表性疫苗主要有流感疫苗、肺炎疫苗�����、乙肝疫苗等 [2]�����,具體見表 1。
表1 預(yù)防性疫苗的免疫原性替代終點(diǎn)水平
但截至2023 年初�,全球疫苗研發(fā)種類高達(dá)960 余種[3]���,滅活疫苗�、減毒疫苗����、重組蛋白疫苗���、核酸疫苗�、病毒載體疫苗等技術(shù)路線多元化發(fā)展����,大部分疫苗的免疫原性替代終點(diǎn)仍處于摸索階段���,更多的是使用保護(hù)率指標(biāo)來(lái)指征疫苗的有效性,尤其是創(chuàng)新技術(shù)疫苗的有效性更難以評(píng)價(jià)�。而疫苗研發(fā)過(guò)程中的不確定性�,可能會(huì)出現(xiàn)大量工藝變更甚至是場(chǎng)地變更���,使得如何可以確保變更后的產(chǎn)品工藝狀態(tài)仍然代表原臨床確認(rèn)后的產(chǎn)品工藝�,使其具有相同的安全性和有效性是研發(fā)階段的重點(diǎn)工作�。
2��、發(fā)生變更后疫苗有效性控制關(guān)鍵要點(diǎn)研判
疫苗在研發(fā)過(guò)程中發(fā)生變更往往不可避免����,重要的是在發(fā)生工藝變更、場(chǎng)地變更等重大變更時(shí)����,根據(jù)現(xiàn)有的知識(shí)和研究確保變更前后質(zhì)量高度相似以控制產(chǎn)品有效性,并且能用先驗(yàn)知識(shí)和技術(shù)開展預(yù)測(cè)�����,對(duì)關(guān)鍵點(diǎn)進(jìn)行控制�����,以此證明在工藝變更上存在的差別不足以對(duì)產(chǎn)品的安全性或有效性產(chǎn)生不利影響[4]����。最重要的是在開展可比性研究時(shí),使用已被臨床確證過(guò)的批次工藝為中心����,獲得該工藝過(guò)程控制的數(shù)據(jù),保證臨床批次的生產(chǎn)工藝與因商業(yè)化而變更后的工藝的藥學(xué)數(shù)據(jù)具有可比性���。因多數(shù)在研疫苗沒(méi)有免疫學(xué)替代指標(biāo)����,若藥學(xué)數(shù)據(jù)無(wú)法可比��,且非臨床研究亦無(wú)法證實(shí)變更對(duì)產(chǎn)品安全性�����、有效性的影響�����,需考慮進(jìn)行橋接性或確證性的臨床試驗(yàn)�����,直接影響研發(fā)進(jìn)程。
2.1可比性研究設(shè)計(jì)
可比性研究應(yīng)基于體系化的設(shè)計(jì)�����,此階段從風(fēng)險(xiǎn)評(píng)估要求出發(fā)�,用分析手段對(duì)藥物的質(zhì)量屬性做不同維度的分析����,以分析其可比性。對(duì)研發(fā)過(guò)程的變更實(shí)施分階段管理��,早期臨床階段關(guān)注安全性風(fēng)險(xiǎn)�,發(fā)生的變更實(shí)質(zhì)上屬于藥學(xué)研究信息不斷充實(shí)、完善和修訂的過(guò)程�����。確證性臨床階段如發(fā)生藥學(xué)變更����,應(yīng)探索更多的實(shí)驗(yàn)數(shù)據(jù)進(jìn)行可比分析,重點(diǎn)關(guān)注變更前后的過(guò)程數(shù)據(jù)����、放行檢測(cè)�、長(zhǎng)期/ 加速穩(wěn)定性及強(qiáng)制性降解等可比性研究[5]�����,涉及場(chǎng)地變更等情況的關(guān)鍵變更還需要明確所有工序的過(guò)程控制可比���。當(dāng)藥學(xué)可比性研究證明變更前后的質(zhì)量具有較大差異或存在藥學(xué)數(shù)據(jù)缺失導(dǎo)致的變更前后不可比等情況,需進(jìn)一步開展非臨床或/ 和臨床橋接研究���,對(duì)于沒(méi)有合適的免疫原性替代指標(biāo)進(jìn)行臨床評(píng)價(jià)的疫苗產(chǎn)品����,則需考慮通過(guò)臨床保護(hù)率研究確證變更后有效性���。
這些研究對(duì)疫苗有效性影響的風(fēng)險(xiǎn)級(jí)別逐步升高�,對(duì)企業(yè)成本��、開發(fā)進(jìn)度等項(xiàng)目推進(jìn)過(guò)程影響也在逐步增大��,因而在前期設(shè)計(jì)過(guò)程中���,一方面應(yīng)將風(fēng)險(xiǎn)前置���,盡可能通盤考慮以減少非臨床與臨床可比研究的開展���;另一方面,設(shè)計(jì)階段應(yīng)前瞻性設(shè)置可比性研究的驗(yàn)收標(biāo)準(zhǔn)�,包括適應(yīng)不同階段的疫苗產(chǎn)品質(zhì)量標(biāo)準(zhǔn)、變更前后數(shù)據(jù)趨勢(shì)分析對(duì)比結(jié)果驗(yàn)收標(biāo)準(zhǔn)等�����,綜合設(shè)置定性標(biāo)準(zhǔn)與定量標(biāo)準(zhǔn)�����,實(shí)現(xiàn)科學(xué)化的可比性研究�����。
2.2可比性研究實(shí)施要求
第一步����,需要收集工藝的關(guān)鍵質(zhì)量屬性,工藝變更的內(nèi)容以及原因�,變更前的各項(xiàng)數(shù)據(jù)。第二步,要基于對(duì)工藝的理解�����,確認(rèn)可能被工藝變更所影響的質(zhì)量屬性�。第三步,針對(duì)這些可能受影響的關(guān)鍵質(zhì)量屬性����,設(shè)計(jì)充分必要的分析策略以證明變更的影響�����?�?杀刃匝芯块_展過(guò)程基于風(fēng)險(xiǎn)遞進(jìn)的原則���,針對(duì)變更的不同大小��,有策略地選擇評(píng)價(jià)策略��,可以對(duì)工藝性能��、放行數(shù)據(jù)���、產(chǎn)品表征��、穩(wěn)定性研究��、非臨床與臨床研究等關(guān)鍵點(diǎn)的數(shù)據(jù)進(jìn)行分析和評(píng)價(jià)���,確認(rèn)變更影響。
工藝性能可比性研究中應(yīng)重點(diǎn)突出工藝比對(duì)信息��,分析原液和制劑每一步驟的關(guān)鍵控制點(diǎn)���,對(duì)中間控制數(shù)據(jù)進(jìn)行逐一比對(duì)�,確保變更前后的工藝控制能力高度相似��,避免因變更導(dǎo)致工藝控制能力下降���。
批放行數(shù)據(jù)的可比性研究同樣重點(diǎn)突出數(shù)據(jù)的比對(duì)信息���,對(duì)生產(chǎn)數(shù)據(jù)、放行檢測(cè)數(shù)據(jù)等關(guān)鍵信息進(jìn)行控制���,保證變更前后放行的狀態(tài)及標(biāo)準(zhǔn)不受影響�����。
產(chǎn)品表征可比性研究應(yīng)突出表征分析的關(guān)鍵信息���,通過(guò)對(duì)一級(jí)����、二級(jí)高級(jí)結(jié)構(gòu)的對(duì)比��,潛在雜質(zhì)及工藝雜質(zhì)的殘留分析等��,控制變更前后產(chǎn)品的結(jié)構(gòu)��、性能��、安全性等表征一致性�����。
穩(wěn)定性可比研究也應(yīng)突出變更前后穩(wěn)定性變化分析的關(guān)鍵信息�����,通過(guò)穩(wěn)定性試驗(yàn)進(jìn)一步發(fā)現(xiàn)在常規(guī)試驗(yàn)中難以檢測(cè)的細(xì)微差距����,主要關(guān)注加速穩(wěn)定性、強(qiáng)制降解穩(wěn)定性研究中涉及的降解模式���、途徑和速率等重點(diǎn)內(nèi)容是否可比���。若穩(wěn)定性研究結(jié)果表明變更前后存在差異,則必須在已有數(shù)據(jù)的基礎(chǔ)上進(jìn)行額外的研究評(píng)價(jià)�����,并在生產(chǎn)及貯存過(guò)程中采取額外措施以控制不可預(yù)期的差異[6]�����。
2.3可比性研究驗(yàn)收要求
可比性研究完成后應(yīng)以工藝設(shè)計(jì)階段確定的各關(guān)鍵質(zhì)量屬性驗(yàn)收標(biāo)準(zhǔn)進(jìn)行驗(yàn)收����。針對(duì)工藝可比研究驗(yàn)收,重點(diǎn)關(guān)注工藝步驟����、過(guò)程參數(shù)、過(guò)程控制�、抗原����、效力���、雜質(zhì)及外源因子去除能力分析以及歷史數(shù)據(jù)等結(jié)果可比性���,必要時(shí)需考慮中間產(chǎn)物的可比性;針對(duì)質(zhì)量可比研究���,重點(diǎn)關(guān)注分析方法適用性���、批放行以及擴(kuò)展表征的結(jié)果和歷史數(shù)據(jù)可比性;針對(duì)穩(wěn)定性可比研究��,重點(diǎn)關(guān)注常規(guī)放行檢測(cè)難以考察的差異點(diǎn)在變更前后的可比性�。
實(shí)施可比性研究驗(yàn)收時(shí)應(yīng)基于統(tǒng)計(jì)學(xué)原則與知識(shí)�����,結(jié)合質(zhì)量屬性和分析方法的變異程度研判定性和定量評(píng)估中需要的批次數(shù)量���。變更前后的質(zhì)量屬性若只是符合放行標(biāo)準(zhǔn)���,通常不足夠證明其可比性���;很多時(shí)候,還需要使用更為嚴(yán)格的統(tǒng)計(jì)學(xué)進(jìn)行判定�。判定邏輯主要分為兩大類:第一類是比較變更前后質(zhì)量屬性的統(tǒng)計(jì)學(xué)分布,通常使用等效性檢驗(yàn)�����;由于等效性檢驗(yàn)對(duì)于變更前后的批次數(shù)有一定的要求����,所以這個(gè)方法的使用有一定的局限性;第二類的判定邏輯是用變更前的數(shù)據(jù)設(shè)定一個(gè)可接受的范圍��,若變更后的質(zhì)量數(shù)據(jù)落在這個(gè)范圍內(nèi)����,那么可以認(rèn)為變更前后質(zhì)量可比。
為有效觀察工藝質(zhì)量變化趨勢(shì)���,至少需要三批的工藝質(zhì)量屬性數(shù)據(jù)���,因而在上市申請(qǐng)階段���,應(yīng)至少進(jìn)行臨床批和商業(yè)化批次各三批的藥學(xué)對(duì)比研究。而且這些批次的數(shù)據(jù)均應(yīng)滿足質(zhì)量標(biāo)準(zhǔn)要求且趨勢(shì)一致�����,表明不同階段生產(chǎn)工藝所生產(chǎn)的產(chǎn)品的有效性具有一致性���,質(zhì)量可比�。以某重組蛋白疫苗為例���,工藝發(fā)生變更后需要對(duì)比關(guān)鍵質(zhì)量數(shù)據(jù)�����,抗原含量作為有效性指標(biāo)之一�����,開展Ⅲ期臨床批與商業(yè)化各三批對(duì)比,結(jié)果趨勢(shì)一致�����,可以滿足要求,表明變更前后的生產(chǎn)工藝所生產(chǎn)的產(chǎn)品的有效性����、安全性具有一致性,質(zhì)量可比���,如圖1所示����。
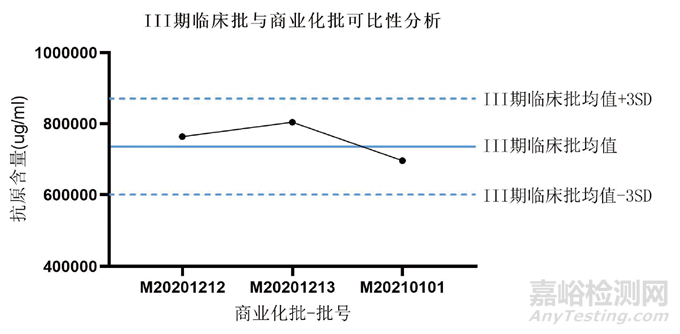
圖1?、笃谂R床批與商業(yè)化批可比性分析
3、基于工藝設(shè)計(jì)實(shí)現(xiàn)研發(fā)策略優(yōu)化
基于“以患者為中心”的研發(fā)理念�����,工藝設(shè)計(jì)階段最重要的產(chǎn)出是穩(wěn)定且高產(chǎn)的生產(chǎn)工藝���,它從源頭賦予了產(chǎn)品質(zhì)量��,是研發(fā)策略優(yōu)化的重要基礎(chǔ)��。
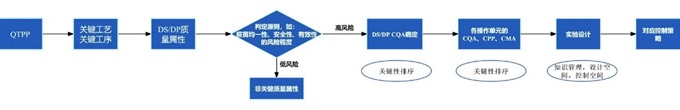
有效的研發(fā)策略首先要求每個(gè)關(guān)鍵工序的成功與否均有評(píng)價(jià)標(biāo)準(zhǔn)�����,這要求每個(gè)關(guān)鍵工序的關(guān)鍵質(zhì)量屬性(CQA)和工藝控制能力可被評(píng)價(jià)��,其中工藝控制能力也需要根據(jù)關(guān)鍵質(zhì)量屬性(CQA)對(duì)應(yīng)的關(guān)鍵工藝參數(shù)(CPP)計(jì)算�����,因而各工序的關(guān)鍵質(zhì)量屬性(CQA)的設(shè)計(jì)至關(guān)重要�。目標(biāo)產(chǎn)品質(zhì)量概況(QTPP)雖然為CQA 的評(píng)估提供了起始點(diǎn),但此階段由于對(duì)產(chǎn)品的認(rèn)識(shí)才剛剛開始����,評(píng)估出的CQA 并非最終都是關(guān)鍵的,只是可能的關(guān)鍵質(zhì)量屬性(pCQA)�。而將其確認(rèn)為CQA 的過(guò)程還需要不斷評(píng)估,應(yīng)結(jié)合法規(guī)要求�����、分析與生物學(xué)特征及發(fā)表文獻(xiàn)等先驗(yàn)知識(shí)�����,利用風(fēng)險(xiǎn)評(píng)估工具如失效模式與影響分析(FMEA)�����、危害分析和關(guān)鍵點(diǎn)控制(HACCP)等對(duì)每一個(gè)pCQA 進(jìn)行評(píng)估并證明合理性����, 嚴(yán)格執(zhí)行工藝控制,保證各項(xiàng)CQA 在適當(dāng)限度范圍內(nèi)��,以期達(dá)到控制產(chǎn)品質(zhì)量的目的[7]��。
其次���,要求完善的工藝表征以確保工藝一致性���。應(yīng)收集目標(biāo)產(chǎn)品現(xiàn)有的科學(xué)知識(shí),梳理對(duì)目標(biāo)產(chǎn)品的工藝?yán)斫庖约爱a(chǎn)品理解��,在過(guò)程中不斷積累產(chǎn)品知識(shí)與數(shù)據(jù)�。在工藝開發(fā)前利用現(xiàn)有資料評(píng)估潛在的CQA 以指導(dǎo)工藝表征開展。確定初步的參數(shù)后�,根據(jù)潛在CQA 確定工藝步驟的優(yōu)先級(jí),并進(jìn)一步評(píng)估以確定潛在的CPP��。在工藝表征階段利用縮小模型(SDM)���、試驗(yàn)設(shè)計(jì)(DOE����、單因子、最差條件研究)等進(jìn)行科學(xué)研究�����,初步表征產(chǎn)品的結(jié)構(gòu)和雜質(zhì)信息后�,通過(guò)風(fēng)險(xiǎn)評(píng)估定義設(shè)計(jì)空間并形成控制策略草案,實(shí)現(xiàn)篩選表征實(shí)驗(yàn)中的潛在差異����,以最大程度地減少試驗(yàn),并使所獲知識(shí)最大化�,具體流程參見圖2。
圖2 工藝設(shè)計(jì)關(guān)鍵要點(diǎn)流程分析
以上市為目標(biāo)的疫苗產(chǎn)品研發(fā)策略涉及藥物開發(fā)�、臨床前研究、臨床研究及注冊(cè)申請(qǐng)等關(guān)鍵環(huán)節(jié)�����,其中工藝設(shè)計(jì)階段的產(chǎn)出直接決定了在研疫苗的研發(fā)方向���,并與產(chǎn)品有效性密切相關(guān)[8]�����。此階段應(yīng)采用上述評(píng)估CQA 的合理流程與方法確定各個(gè)工序的CQA���,形成工藝可比的基礎(chǔ)并有效開展工藝表征。當(dāng)出現(xiàn)工序變化�����、工藝變化��、場(chǎng)地變化等重大變更后���,可基于CQA 數(shù)據(jù)對(duì)比變更前后的質(zhì)量趨勢(shì)���,判斷是否在藥學(xué)上可比。同時(shí)在研發(fā)進(jìn)程中應(yīng)全面記錄研發(fā)過(guò)程的相關(guān)數(shù)據(jù)�����,保證真實(shí)性和準(zhǔn)確性���,所擁有的可比性數(shù)據(jù)越多�,越能確保工藝的變更不影響患者用藥的安全性和有效性。
4�����、總結(jié)和展望
本文以優(yōu)化疫苗研發(fā)策略為目的�����,在多數(shù)疫苗無(wú)免疫原性替代指標(biāo)判斷有效性的情況下��,分析了變更后開展可比性分析的關(guān)鍵要點(diǎn)���,并基于研發(fā)工藝設(shè)計(jì)明確了研發(fā)策略應(yīng)建立評(píng)價(jià)標(biāo)準(zhǔn)和完善的工藝表征,為“以患者為中心”的疫苗研發(fā)策略優(yōu)化提供了理論依據(jù)�。
隨著國(guó)家對(duì)疫苗和生物制品行業(yè)的日益重視,產(chǎn)品的研發(fā)創(chuàng)新成為了推動(dòng)行業(yè)發(fā)展的核心動(dòng)力�����,也是企業(yè)從日益激烈的市場(chǎng)競(jìng)爭(zhēng)中脫穎而出的有利武器����。然而,僅有研發(fā)創(chuàng)新是不足夠的�,一個(gè)成功的產(chǎn)品從開發(fā)到上市既需要?jiǎng)?chuàng)新理念的支持�,也需要技術(shù)平臺(tái)的突破�、高質(zhì)量目標(biāo)的堅(jiān)持、成本與進(jìn)度之間的權(quán)衡等�。其中,產(chǎn)品質(zhì)量是研發(fā)創(chuàng)新的堅(jiān)實(shí)后盾�����,也是贏得消費(fèi)者信任和市場(chǎng)認(rèn)可的關(guān)鍵�。因此����,企業(yè)必須將質(zhì)量放在首位,堅(jiān)持質(zhì)量源于設(shè)計(jì)的創(chuàng)新理念����,嚴(yán)格把控研發(fā)過(guò)程質(zhì)量,以確保每一項(xiàng)研發(fā)成果都能轉(zhuǎn)化為安全���、有效的產(chǎn)品���。只有高質(zhì)量的產(chǎn)品,才能真正地造福人類���,推動(dòng)行業(yè)的可持續(xù)發(fā)展�����。
參考文獻(xiàn)
[1]F D A . P a t i e n t - F o c u s e d D r u g Development: Selecting, Developing,or Modifying Fi t - f o r-Purpose Clinical Outcome Assessments [EB/OL].(2022-06).https://www.fda.gov/regulatory-information/searchfda-guidance-documents/patientfocused-drug-development-selectingdeveloping-or-modifying-fit-purposeclinical-outcome.
[2]金鵬飛�,李靖欣,周洋�����,等. 評(píng)價(jià)疫苗效力的免疫學(xué)替代終點(diǎn)[J] 中華預(yù)防醫(yī)學(xué)雜志. 2015���,49(12):1110-1114.
[3]J i a n y i n g Yu e , Yu e h u a L i u ,Mingliang Zhao,et al.The R&D landscape for infectious disease vaccines [J].Nature Reviews Drug Discovery.2023,22:867-868.
[4]ICH,Comparability Of Biotechnological/Biological Products Subject to Changes in Their Manufacturing Process Q5E[EB/OL].(2004-11-18).https://database.ich.org/sites/default/files/Q5E%20Guideline.pdf.
[5]李敏�,常衛(wèi)紅�,高恩明. 治療用生物制品上市后變更的藥學(xué)可比性研究[J]. 中國(guó)生物制品學(xué)雜志����,2012,25(10):1399-1041.
[6]李敏���,高恩明. 疫苗生產(chǎn)場(chǎng)地變更質(zhì)量可比性研究的總體思考[J].中國(guó)生物制品學(xué)雜志����,2013,26(02):289-291+296.
[7]景榮先���,曾媛,張國(guó)林. 單克隆抗體類生物制品關(guān)鍵質(zhì)量屬性[J]. 中國(guó)醫(yī)藥科學(xué)����,2023,13(18):177-180.
[8]李敏�����,許嘉齊. 從“質(zhì)量源于設(shè)計(jì)”角度淺談多糖- 蛋白結(jié)合疫苗藥學(xué)研發(fā)的考慮[J]. 中國(guó)新藥雜志,2017����,26(14):1623-1627.