摘 要 / Abstract
第三類深度學(xué)習(xí)獨(dú)立軟件是人工智能醫(yī)療器械的典型產(chǎn)品��,統(tǒng)計(jì)分析其注冊(cè)數(shù)據(jù)有助于了解人工智能醫(yī)療器械產(chǎn)業(yè)發(fā)展態(tài)勢(shì)并完善監(jiān)管要求��。本文統(tǒng)計(jì)分析了2020~2023 年我國(guó)第三類深度學(xué)習(xí)獨(dú)立軟件的注冊(cè)數(shù)據(jù)�����,結(jié)果表明我國(guó)人工智能醫(yī)療器械產(chǎn)業(yè)進(jìn)入穩(wěn)定發(fā)展新階段��,呈現(xiàn)良好發(fā)展態(tài)勢(shì)�����,具有廣闊發(fā)展空間��。我國(guó)人工智能醫(yī)療器械監(jiān)管工作已取得階段性成果��,基于產(chǎn)業(yè)發(fā)展態(tài)勢(shì)��,后續(xù)需要加強(qiáng)重點(diǎn)產(chǎn)品監(jiān)管科學(xué)研究��、頭部企業(yè)調(diào)研�����、新入企業(yè)培訓(xùn)��、信息化建設(shè)等工作����。
The Class III deep learning SaMD is a typical product of artificial intelligence medical devices, and statistical analysis of its registration data helps to understand the development trend of the artificial intelligence medical device industry and improve regulatory requirements. This paper statistically analyzes registration data for the Class III deep learning SaMD in China from 2020 to 2023. The results indicate that China's artificial intelligence medical device industry has entered a new stage of stable development, showing a positive trend with broad development prospects. Phased achievements have been made in China's artificial intelligence medical device supervision, and follow-up works should focus on strengthening scientific research on key products, conducting surveys of leading enterprise, providing training for new enterprise, and enhancing information construction based on the industrial development trend.
關(guān) 鍵 詞 / Key words
人工智能醫(yī)療器械;獨(dú)立軟件��;注冊(cè)數(shù)據(jù)����;產(chǎn)業(yè)發(fā)展態(tài)勢(shì);監(jiān)管要求
artificial intelligence medical device; SaMD; registration data; industrial development trend; regulatory requirements
人工智能醫(yī)療器械是指采用人工智能技術(shù)實(shí)現(xiàn)其預(yù)期醫(yī)療用途的醫(yī)療器械����,包括本身即為醫(yī)療器械的人工智能獨(dú)立軟件(AISaMD)和含有人工智能軟件組件(AI SiMD) 的醫(yī)療器械[1]。因人工智能獨(dú)立軟件可以單獨(dú)按照醫(yī)療器械注冊(cè)��,且第三類醫(yī)療器械風(fēng)險(xiǎn)最高����,深度學(xué)習(xí)是當(dāng)前人工智能技術(shù)的主流技術(shù)����,故第三類深度學(xué)習(xí)獨(dú)立軟件為人工智能醫(yī)療器械的典型產(chǎn)品[2]�����。
自2020 年1 月首款第三類深度學(xué)習(xí)獨(dú)立軟件產(chǎn)品注冊(cè)以來(lái)�����,產(chǎn)品注冊(cè)數(shù)量逐年增加�����,呈現(xiàn)良好發(fā)展態(tài)勢(shì)����,表明我國(guó)人工智能醫(yī)療器械產(chǎn)業(yè)發(fā)展迅速,監(jiān)管工作切實(shí)促進(jìn)了產(chǎn)業(yè)的健康發(fā)展����。本文在前期統(tǒng)計(jì)分析工作的基礎(chǔ)上[2],結(jié)合產(chǎn)品��、注冊(cè)人等角度深入分析了2020~2023 年我國(guó)第三類深度學(xué)習(xí)獨(dú)立軟件的產(chǎn)品注冊(cè)數(shù)據(jù)�����,以期進(jìn)一步了解我國(guó)人工智能醫(yī)療器械產(chǎn)業(yè)發(fā)展態(tài)勢(shì)����,為完善我國(guó)人工智能醫(yī)療器械監(jiān)管工作提供參考與思路。
1�����、人工智能醫(yī)療器械典型產(chǎn)品注冊(cè)情況
(一)年度產(chǎn)品注冊(cè)情況
2020~2023 年在我國(guó)注冊(cè)的第三類深度學(xué)習(xí)獨(dú)立軟件共73 項(xiàng)(表1)����,其中境內(nèi)產(chǎn)品注冊(cè)71 項(xiàng),占97.3% ����;進(jìn)口產(chǎn)品注冊(cè)2 項(xiàng),占2.7% ����;港澳臺(tái)無(wú)產(chǎn)品注冊(cè)。說(shuō)明境內(nèi)產(chǎn)品是第三類深度學(xué)習(xí)獨(dú)立軟件的主流產(chǎn)品��,且發(fā)展迅猛。進(jìn)口產(chǎn)品注冊(cè)數(shù)量偏少��,主要原因在于:進(jìn)口產(chǎn)品大部分為人工智能軟件組件�����,未納入人工智能獨(dú)立軟件的統(tǒng)計(jì)范圍�����;部分進(jìn)口產(chǎn)品轉(zhuǎn)產(chǎn)我國(guó)����,重新進(jìn)行算法訓(xùn)練以滿足我國(guó)臨床需求,并按境內(nèi)產(chǎn)品完成注冊(cè)�����。
由表1 可知����,2020~2023年分別注冊(cè)第三類深度學(xué)習(xí)獨(dú)立軟件9、13�����、23、28 項(xiàng)�����,占12.3%�����、17.8%�����、31.5%�����、38.4%��。2022 年產(chǎn)品注冊(cè)數(shù)量較前兩年大幅增長(zhǎng)��,2023 年產(chǎn)品注冊(cè)數(shù)量較2022 年有小幅增長(zhǎng)�����?����?傮w而言����,我國(guó)人工智能醫(yī)療器械產(chǎn)業(yè)發(fā)展態(tài)勢(shì)良好。
(二)產(chǎn)品類型分析
人工智能獨(dú)立軟件通常以“病變部位+ 數(shù)據(jù)類型+ 預(yù)期用途+軟件”進(jìn)行產(chǎn)品命名[1-3]�����,故產(chǎn)品類型主要從預(yù)期用途��、病變部位和數(shù)據(jù)類型3 個(gè)維度進(jìn)行統(tǒng)計(jì)�����。預(yù)期用途分為4 種��,按風(fēng)險(xiǎn)水平從低到高包括:輔助分診與評(píng)估����、輔助檢測(cè)、輔助診斷�����、輔助治療。病變部位包括9 個(gè):肺部��、心臟�����、頭頸����、骨骼��、眼部����、消化道、細(xì)胞��、乳腺����、肝臟。數(shù)據(jù)類型包括8 種:CT 圖像�����、X 射線圖像、眼底圖像����、心電數(shù)據(jù)、內(nèi)窺鏡圖像���、MR 圖像����、顯微鏡圖像���、超聲圖像���。2020~2023 年我國(guó)第三類深度學(xué)習(xí)獨(dú)立軟件產(chǎn)品類型情況,見(jiàn)表2�。

從預(yù)期用途來(lái)看, 輔助分診與評(píng)估類軟件28 項(xiàng)�, 占38.4% ;輔助檢測(cè)類軟件24 項(xiàng)����,占32.9%���;輔助診斷類軟件19 項(xiàng),占26.0% ����;輔助治療類軟件2 項(xiàng),占2.7%����。前三類呈梯度分布,輔助治療類軟件產(chǎn)品注冊(cè)數(shù)量較少�。
從病變部位來(lái)看,肺部類軟件22 項(xiàng)�,占30.1% ����;心臟類軟件14 項(xiàng), 占19.2% ����;頭頸、骨骼類軟件各10 項(xiàng)����,各占13.7% �;眼部類軟件8 項(xiàng)���,占11.0% ���;消化道類軟件4 項(xiàng),占5.5%���;細(xì)胞���、乳腺類軟件各2 項(xiàng),各占2.7% ����;肝臟類軟件1 項(xiàng),占1.4%�。肺部類軟件產(chǎn)品注冊(cè)數(shù)量最多,心臟類軟件次之�,頭頸、骨骼類軟件排第三位�,細(xì)胞、乳腺���、肝臟類軟件產(chǎn)品注冊(cè)數(shù)量相對(duì)較少�。
從數(shù)據(jù)類型來(lái)看,圖像類軟件68 項(xiàng)���,占93.2% �;波形類軟件5 項(xiàng)���,占6.8%�。圖像類軟件中���,CT 圖像類軟件42 項(xiàng)����, 占61.7% ���;眼底圖像、X 射線圖像類軟件各8 項(xiàng)�,占11.8% ;內(nèi)窺鏡圖像類軟件4 項(xiàng)����, 占5.9% ;MR 圖像類軟件3 項(xiàng)�,占4.4% ����;顯微鏡圖像類軟件2 項(xiàng)����,占2.9%;超聲圖像類軟件1 項(xiàng)���,占1.5%����。波形類軟件均為心電數(shù)據(jù)類軟件����。CT 圖像類軟件數(shù)量最多,是第三類深度學(xué)習(xí)獨(dú)立軟件的代表產(chǎn)品���,眼底圖像����、X 射線圖像類軟件次之�,其他類軟件產(chǎn)品注冊(cè)數(shù)量相對(duì)較少。
第三類深度學(xué)習(xí)獨(dú)立軟件基于上述3 個(gè)分類維度共有23 種產(chǎn)品類型����,其中CT 圖像類軟件9 種�,X 射線圖像類軟件5 種����,MR 圖像類軟件3 種,顯微鏡圖像類軟件2 種�,眼底圖像、心電數(shù)據(jù)�、內(nèi)窺鏡圖像、超聲圖像類軟件各1 種���。CT 圖像類軟件種類最多���,X 射線圖像類軟件次之,MR 圖像類軟件排第三位�,其他類軟件種類較少。
整體而言����,CT 圖像類軟件產(chǎn)品注冊(cè)的種類和數(shù)量最多����,特別是肺部數(shù)量和種類均較多���;X 射線圖像類軟件產(chǎn)品注冊(cè)的種類和數(shù)量排第二位,眼底圖像類軟件產(chǎn)品注冊(cè)種類較少但數(shù)量較多���,其他類軟件產(chǎn)品注冊(cè)的種類和數(shù)量均較少���,可見(jiàn)產(chǎn)品分布不均勻。一方面反映了我國(guó)當(dāng)前對(duì)于人工智能醫(yī)療器械的臨床需求情況���;另一方面也預(yù)示著人工智能醫(yī)療器械產(chǎn)業(yè)尚有廣闊的發(fā)展空間���。
(三)重點(diǎn)產(chǎn)品情況
重點(diǎn)產(chǎn)品是指注冊(cè)數(shù)量較多的產(chǎn)品,可以反映產(chǎn)品集中度情況�。上述23 種產(chǎn)品類型平均每種注冊(cè)3.2 項(xiàng)產(chǎn)品,其中眼底圖像類軟件1 種注冊(cè)8 項(xiàng)產(chǎn)品����,心電數(shù)據(jù)類軟件1 種注冊(cè)5 項(xiàng)產(chǎn)品,CT 圖像類軟件平均每種注冊(cè)4.7項(xiàng)產(chǎn)品���,內(nèi)窺鏡圖像類軟件1 種注冊(cè)4 項(xiàng)產(chǎn)品����,X 射線圖像類軟件平均每種注冊(cè)1.6 項(xiàng)產(chǎn)品,MR圖像����、顯微鏡圖像、超聲圖像類軟件每種注冊(cè)1 項(xiàng)產(chǎn)品�。前四類軟件產(chǎn)品集中度較高,特別是眼底圖像類軟件集中度最高���;后四類軟件產(chǎn)品集中度較低����。
從產(chǎn)品名稱來(lái)看�,重點(diǎn)產(chǎn)品主要有肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件12 項(xiàng)、糖尿病視網(wǎng)膜病變眼底圖像輔助診斷軟件6 項(xiàng)����、肺炎CT 圖像輔助分診與評(píng)估軟件6 項(xiàng)、冠脈CT 造影圖像血管狹窄輔助分診與評(píng)估軟件5 項(xiàng)���、心電分析軟件5 項(xiàng)�、骨折CT 圖像輔助檢測(cè)軟件4 項(xiàng)�、結(jié)腸息肉電子內(nèi)窺鏡圖像輔助檢測(cè)軟件4 項(xiàng)���、顱內(nèi)出血CT 圖像輔助分診軟件3 項(xiàng)���、兒童手部X 射線圖像骨齡輔助評(píng)估軟件3 項(xiàng)�。這些重點(diǎn)產(chǎn)品占全部產(chǎn)品的65.8%�,產(chǎn)品集中度較高,特別是肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件占16.4% ����;另有2 項(xiàng)產(chǎn)品含有肺結(jié)節(jié)輔助檢測(cè)功能。若全部納入統(tǒng)計(jì)����,則其占比高達(dá)19.2%。
從年度產(chǎn)品注冊(cè)情況來(lái)看���,2020 年重點(diǎn)產(chǎn)品為肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件2 項(xiàng)����、糖尿病視網(wǎng)膜病變眼底圖像輔助診斷軟件2 項(xiàng)����,2 種產(chǎn)品年度占比44.4% ;2021 年重點(diǎn)產(chǎn)品為肺炎CT 圖像輔助分診與評(píng)估軟件6 項(xiàng)、肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件2 項(xiàng)�,2種產(chǎn)品年度占比61.5% ;2022年重點(diǎn)產(chǎn)品為肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件5 項(xiàng)���、糖尿病視網(wǎng)膜病變眼底圖像輔助診斷軟件3 項(xiàng)�、心電分析軟件3 項(xiàng)�、顱內(nèi)出血CT 圖像輔助分診軟件2 項(xiàng),4 種產(chǎn)品年度占比56.5% �;2023 年重點(diǎn)產(chǎn)品為冠脈CT 造影圖像血管狹窄輔助分診與評(píng)估軟件4 項(xiàng)、肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件3項(xiàng)�、結(jié)腸息肉電子內(nèi)窺鏡圖像輔助檢測(cè)軟件3 項(xiàng)、骨折CT 圖像輔助檢測(cè)軟件2 項(xiàng)���、乳腺X 射線圖像輔助檢測(cè)軟件2 項(xiàng)����,5 種產(chǎn)品年度占比50.0%����。肺結(jié)節(jié)CT圖像輔助檢測(cè)軟件4 年中均為重點(diǎn)產(chǎn)品,糖尿病視網(wǎng)膜病變眼底圖像輔助診斷軟件在2 個(gè)年度為重點(diǎn)產(chǎn)品���,特別是2021 年重點(diǎn)產(chǎn)品肺炎CT 圖像輔助分診與評(píng)估軟件���,為新冠疫情防控做出了應(yīng)有貢獻(xiàn)���。總體而言�,重點(diǎn)產(chǎn)品的年度占比趨于穩(wěn)定�,產(chǎn)品類型呈增長(zhǎng)趨勢(shì),說(shuō)明產(chǎn)品集中度較高問(wèn)題有所改善���。
2�、人工智能醫(yī)療器械典型產(chǎn)品注冊(cè)人情況
(一)年度注冊(cè)人累計(jì)情況
2020~2023 年我國(guó)第三類深度學(xué)習(xí)獨(dú)立軟件注冊(cè)人累計(jì)情況見(jiàn)表3�。2020 年累計(jì)9 家企業(yè),平均每家注冊(cè)1 項(xiàng)產(chǎn)品����;2021 年累計(jì)16 家企業(yè),新增7 家����,平均每家注冊(cè)1.4 項(xiàng)產(chǎn)品;2022 年累計(jì)28 家企業(yè)�,新增12 家,平均每家注冊(cè)1.6 項(xiàng)產(chǎn)品����;2023 年累計(jì)39 家企業(yè)���,新增11 家,平均每家注冊(cè)1.9 項(xiàng)產(chǎn)品�。由表3可知,年度新增企業(yè)數(shù)量較為穩(wěn)定����,企業(yè)數(shù)量呈快速增長(zhǎng)趨勢(shì);年度平均每家注冊(cè)產(chǎn)品數(shù)量也呈快速增長(zhǎng)趨勢(shì)����,企業(yè)頭部效應(yīng)日益增強(qiáng)。
截至目前共有第三類深度學(xué)習(xí)獨(dú)立軟件注冊(cè)人39 家���,其中境內(nèi)注冊(cè)人37 家���,注冊(cè)71 項(xiàng)產(chǎn)品,平均每家注冊(cè)1.9 項(xiàng)產(chǎn)品���;進(jìn)口注冊(cè)人2 家�,每家注冊(cè)1 項(xiàng)產(chǎn)品�。表明境內(nèi)企業(yè)是我國(guó)人工智能醫(yī)療器械產(chǎn)業(yè)的主力軍�。
(二)境內(nèi)注冊(cè)人情況
本文主要從注冊(cè)產(chǎn)品數(shù)量����、所在地區(qū)和企業(yè)類型3 個(gè)維度分析境內(nèi)注冊(cè)人情況,其中企業(yè)類型分為醫(yī)療器械行業(yè)傳統(tǒng)企業(yè)和新入企業(yè)[2]�。
從注冊(cè)產(chǎn)品數(shù)量來(lái)看(表4),注冊(cè)5 項(xiàng)以上產(chǎn)品的企業(yè)有4 家�,共注冊(cè)31 項(xiàng)產(chǎn)品,占境內(nèi)產(chǎn)品的43.7% �;注冊(cè)2~3 項(xiàng)產(chǎn)品的企業(yè)有6 家�,共注冊(cè)13 項(xiàng)產(chǎn)品,占境內(nèi)產(chǎn)品的18.3% ���;注冊(cè)1 項(xiàng)產(chǎn)品的企業(yè)有27 家�,占境內(nèi)產(chǎn)品的38.0%�。企業(yè)頭部效應(yīng)較為明顯,呈梯度分布����。
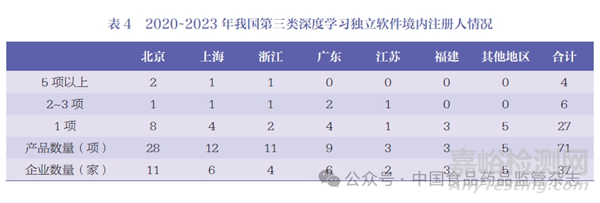
從所在地區(qū)來(lái)看(表4),北京有11 家企業(yè)����,注冊(cè)28 項(xiàng)產(chǎn)品���,平均每家注冊(cè)2.5 項(xiàng)產(chǎn)品;上海有6 家企業(yè)���, 注冊(cè)12 項(xiàng)產(chǎn)品�,平均每家注冊(cè)2 項(xiàng)產(chǎn)品�;浙江有4 家企業(yè),注冊(cè)11 項(xiàng)產(chǎn)品�,平均每家注冊(cè)2.8 項(xiàng)產(chǎn)品;廣東有6家企業(yè)�,注冊(cè)9 項(xiàng)產(chǎn)品,平均每家注冊(cè)1.5 項(xiàng)產(chǎn)品�;江蘇有2 家企業(yè),注冊(cè)3 項(xiàng)產(chǎn)品���,平均每家注冊(cè)1.5 項(xiàng)產(chǎn)品����;福建有3 家企業(yè)���,每家注冊(cè)1 項(xiàng)產(chǎn)品�;其他地區(qū)有5 家企業(yè)���,每家注冊(cè)1 項(xiàng)產(chǎn)品�。北京企業(yè)數(shù)量和產(chǎn)品注冊(cè)數(shù)量均位于首位,上海�、浙江、廣東次之���,其他地區(qū)較少�,地區(qū)頭部效應(yīng)明顯����;浙江、北京產(chǎn)品集中度較高���,企業(yè)頭部效應(yīng)明顯。
從企業(yè)類型來(lái)看����,5 家屬于醫(yī)療器械行業(yè)傳統(tǒng)企業(yè),注冊(cè)12 項(xiàng)產(chǎn)品�,平均每家注冊(cè)2.4 項(xiàng)產(chǎn)品;其余32 家為醫(yī)療器械行業(yè)新入企業(yè)����,注冊(cè)59 項(xiàng)產(chǎn)品�,平均每家注冊(cè)1.8 項(xiàng)產(chǎn)品���。新入企業(yè)是人工智能醫(yī)療器械產(chǎn)業(yè)的主力軍���,企業(yè)數(shù)量、產(chǎn)品注冊(cè)數(shù)量均多于傳統(tǒng)企業(yè)����,但產(chǎn)品集中度低于傳統(tǒng)企業(yè)。
(三)頭部企業(yè)情況
頭部企業(yè)共有4 家����,其中1家注冊(cè)12 項(xiàng)產(chǎn)品、1 家注冊(cè)7項(xiàng)產(chǎn)品�、2 家注冊(cè)6 項(xiàng)產(chǎn)品,產(chǎn)品注冊(cè)數(shù)量占全部的42.5%����。北京頭部企業(yè)有2 家,注冊(cè)18 項(xiàng)產(chǎn)品����,占本地區(qū)注冊(cè)產(chǎn)品數(shù)量的64.3% ;上海頭部企業(yè)有1 家,注冊(cè)6 項(xiàng)產(chǎn)品�,占本地區(qū)注冊(cè)產(chǎn)品數(shù)量的50.0% ;浙江頭部企業(yè)有1 家���,注冊(cè)7 項(xiàng)產(chǎn)品���,占本地區(qū)注冊(cè)產(chǎn)品數(shù)量的63.6%。有3 家頭部企業(yè)屬于新入企業(yè)����,共注冊(cè)25 項(xiàng)產(chǎn)品,占新入企業(yè)注冊(cè)產(chǎn)品數(shù)量的42.4% ���;1 家頭部企業(yè)屬于傳統(tǒng)企業(yè)���,注冊(cè)6 項(xiàng)產(chǎn)品,占傳統(tǒng)企業(yè)注冊(cè)產(chǎn)品數(shù)量的50.0%����?���?梢?jiàn), 企業(yè)頭部效應(yīng)在地區(qū)、企業(yè)類型等方面均較為明顯�。
2020~2023 年4 家頭部企業(yè)注冊(cè)產(chǎn)品數(shù)量分別為4、5���、6�、16 項(xiàng)����, 占比分別為44.4%、38.5%���、26.1%�、57.1%�, 企業(yè)頭部效應(yīng)在前三年呈下降趨勢(shì),但2023 年較為顯著���,說(shuō)明第三類深度學(xué)習(xí)獨(dú)立軟件產(chǎn)業(yè)發(fā)展可能進(jìn)入新階段�。
3���、人工智能醫(yī)療器械監(jiān)管工作的建議
當(dāng)前�,我國(guó)人工智能醫(yī)療器械產(chǎn)業(yè)可能開(kāi)始進(jìn)入穩(wěn)定發(fā)展新階段����,境內(nèi)企業(yè)是產(chǎn)業(yè)的主力軍���,企業(yè)和地區(qū)頭部效應(yīng)均較為明顯,新入企業(yè)發(fā)展態(tài)勢(shì)整體優(yōu)于傳統(tǒng)企業(yè)�;境內(nèi)產(chǎn)品是主流產(chǎn)品,但產(chǎn)品種類和數(shù)量均相對(duì)較少���,部分產(chǎn)品集中度較高�,產(chǎn)品分布不均勻����;產(chǎn)業(yè)整體呈良好發(fā)展態(tài)勢(shì),具有廣闊的發(fā)展空間�。
我國(guó)人工智能醫(yī)療器械監(jiān)管工作取得階段性成果,已發(fā)布8項(xiàng)指導(dǎo)原則����、8 項(xiàng)審評(píng)要點(diǎn)和6項(xiàng)行業(yè)標(biāo)準(zhǔn),涵蓋產(chǎn)品命名���、分類界定����、技術(shù)審評(píng)���、體系核查等監(jiān)管環(huán)節(jié)����,初步建成了人工智能醫(yī)療器械指導(dǎo)原則體系[1,3-21]���。結(jié)合人工智能醫(yī)療器械產(chǎn)業(yè)發(fā)展態(tài)勢(shì)�,筆者認(rèn)為以下4 個(gè)方面工作仍需相關(guān)部門持續(xù)關(guān)注[2,21]���。
首先�,在現(xiàn)有工作基礎(chǔ)上加速人工智能醫(yī)療器械重點(diǎn)產(chǎn)品審評(píng)指導(dǎo)原則���、審評(píng)要點(diǎn)以及行業(yè)標(biāo)準(zhǔn)的制修訂工作����,持續(xù)推進(jìn)人工智能醫(yī)療器械指導(dǎo)原則體系和標(biāo)準(zhǔn)體系的構(gòu)建�,以滿足產(chǎn)業(yè)發(fā)展需求。其次���,加強(qiáng)針對(duì)人工智能醫(yī)療器械頭部企業(yè)產(chǎn)業(yè)調(diào)研工作���,深入了解人工智能醫(yī)療器械新技術(shù)新產(chǎn)品情況����,提前做好技術(shù)儲(chǔ)備����,服務(wù)于產(chǎn)業(yè)高質(zhì)量發(fā)展。再次���,針對(duì)醫(yī)療器械行業(yè)新入企業(yè)大力開(kāi)展培訓(xùn)工作����,及時(shí)宣貫法律法規(guī)�、指導(dǎo)原則、審評(píng)要點(diǎn)以及行業(yè)標(biāo)準(zhǔn)相關(guān)要求�,提升行業(yè)理解和認(rèn)識(shí),促進(jìn)產(chǎn)業(yè)可持續(xù)發(fā)展���。最后����,加強(qiáng)信息化建設(shè)工作����,規(guī)范產(chǎn)品注冊(cè)證載明信息,加強(qiáng)人工智能軟件組件的標(biāo)識(shí)���,做好統(tǒng)計(jì)分析工作�,全面準(zhǔn)確反映人工智能醫(yī)療器械產(chǎn)業(yè)發(fā)展情況���。
總之����,我國(guó)對(duì)于人工智能醫(yī)療器械監(jiān)管的框架�、原則和要求,在上市前評(píng)價(jià)����、變更控制、信息透明���、生存周期質(zhì)控����、真實(shí)世界監(jiān)測(cè)����、新技術(shù)評(píng)價(jià)等方面與國(guó)際監(jiān)管先進(jìn)水平基本相當(dāng)���,在重點(diǎn)產(chǎn)品評(píng)價(jià)方面處于領(lǐng)先水平[22]。但人工智能醫(yī)療器械新技術(shù)新產(chǎn)品所帶來(lái)的監(jiān)管挑戰(zhàn)依然存在且將長(zhǎng)期存在�,因此仍需持續(xù)加強(qiáng)監(jiān)管科學(xué)研究,不斷完善和推進(jìn)監(jiān)管工作����,進(jìn)一步提升我國(guó)國(guó)際競(jìng)爭(zhēng)力和話語(yǔ)權(quán)。
參考文獻(xiàn)
[1] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布人工智能醫(yī)療器械注冊(cè)審查指導(dǎo)原則的通告(2022 年第8 號(hào))[EB/OL].(2022-03-09).https://www.cmde. org.cn//xwdt/shpgzgg/gztg/20220309090800158.html.
[2] 彭亮,���,劉梟寅. 第三類深度學(xué)習(xí)獨(dú)立軟件產(chǎn)品注冊(cè)情況分析[J]. 中國(guó)數(shù)字醫(yī)學(xué),2023,18(5):32-36.
[3] 國(guó)家藥品監(jiān)督管理局. 國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)用康復(fù)器械通用名稱命名指導(dǎo)原則等6 項(xiàng)指導(dǎo)原則的通告(2021 年第48 號(hào))[EB/OL].(2021-07-15).https://www.nmpa.gov.cn/ylqx/ylqxggtg/20210715165810118.html.
[4] 國(guó)家藥品監(jiān)督管理局. 國(guó)家藥監(jiān)局關(guān)于發(fā)布人工智能醫(yī)用軟件產(chǎn)品分類界定指導(dǎo)原則的通告(2021 年第47 號(hào))[EB/OL].(2021-07-08).https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20210708111147171.html.
[5] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布醫(yī)療器械軟件注冊(cè)審查指導(dǎo)原則(2022 年修訂版)的通告(2022年第9 號(hào))[EB/OL]. (2022-03-09).https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20220309091454609.html.
[6] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布醫(yī)療器械網(wǎng)絡(luò)安全注冊(cè)審查指導(dǎo)原則(2022 年修訂版)的通告(2022 年第7 號(hào))[EB/OL]. (2022-03-09).https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20220309085600367.html.
[7] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布肺結(jié)節(jié)CT 圖像輔助檢測(cè)軟件注冊(cè)審查指導(dǎo)原則的通告(2022 年第21 號(hào))[EB/OL]. (2022-05-26). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20220526102356105.html.
[8] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布糖尿病視網(wǎng)膜病變眼底圖像輔助診斷軟件注冊(cè)審查指導(dǎo)原則的通告(2022 年第23 號(hào))[EB/OL]. (2022-06-02). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20220602103048151.html.
[9] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布人工智能輔助檢測(cè)醫(yī)療器械(軟件)臨床評(píng)價(jià)注冊(cè)審查指導(dǎo)原則的通告(2023 年第38 號(hào))[EB/OL].(2023-11-07). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20231107153309174.html.
[10] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 關(guān)于發(fā)布深度學(xué)習(xí)輔助決策醫(yī)療器械軟件審評(píng)要點(diǎn)的通告(2019 年第7 號(hào))[EB/OL].(2019-07-03). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20190703141714991.html.
[11] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 關(guān)于發(fā)布《肺炎CT 影像輔助分診與評(píng)估軟件審評(píng)要點(diǎn)(試行)》的通告(2020 年第8 號(hào))[EB/OL].(2020-03-05). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20200305143300485.html.
[12] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布口咽部新型冠狀病毒核酸采樣設(shè)備技術(shù)審評(píng)要點(diǎn)(試行)的通告(2022 年第33 號(hào))[EB/OL]. (2022-08-26). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20220826150421104.html.
[13] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布影像超聲人工智能軟件(流程優(yōu)化類功能)技術(shù)審評(píng)要點(diǎn)等4個(gè)審評(píng)要點(diǎn)的通告(2023 年第23 號(hào))[EB/OL].(2023-07-10). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20230710154952109.html.
[14] 國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心. 國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布磁共振成像系統(tǒng)人工智能軟件功能審評(píng)要點(diǎn)的通告(2023 年第36 號(hào))[EB/OL].(2023-09-15). https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20230915164216106.html.
[15] 國(guó)家藥品監(jiān)督管理局. 人工智能醫(yī)療器械 質(zhì)量要求和評(píng)價(jià) 第1 部分:術(shù)語(yǔ):YY/T 1833.1—2022[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,2022.
[16] 國(guó)家藥品監(jiān)督管理局. 人工智能醫(yī)療器械 質(zhì)量要求和評(píng)價(jià) 第2 部分:數(shù)據(jù)集通用要求:YY/T 1833.2—2022[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,2022.
[17] 國(guó)家藥品監(jiān)督管理局. 人工智能醫(yī)療器械 質(zhì)量要求和評(píng)價(jià) 第3 部分:數(shù)據(jù)標(biāo)注通用要求:YY/T 1833.3—2022[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,2022.
[18] 國(guó)家藥品監(jiān)督管理局. 人工智能醫(yī)療器械 肺部影像輔助分析軟件 算法性能測(cè)試方法:YY/T 1858—2022[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,2022.
[19] 國(guó)家藥品監(jiān)督管理局. 人工智能醫(yī)療器械 質(zhì)量要求和評(píng)價(jià) 第4 部分:可追溯性:YY/T 1833.4—2023[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,2023.
[20] 國(guó)家藥品監(jiān)督管理局. 人工智能醫(yī)療器械 冠狀動(dòng)脈CT 影像處理軟件 算法性能測(cè)試方法:YY/T 1907—2023[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,2023.
[21] 彭亮,孫磊. 人工智能醫(yī)療器械監(jiān)管研究進(jìn)展[J]. 中國(guó)食品藥品監(jiān)管,2022(2):30-35.
[22] 彭亮,劉梟寅,張宇晶,等. 人工智能醫(yī)療器械國(guó)際監(jiān)管比較研究[J]. 中國(guó)數(shù)字醫(yī)學(xué),2023,18(5):1-7.





