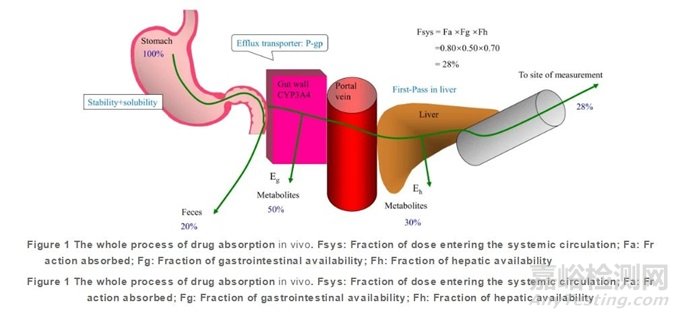
絕對生物利用度(fraction of dose entering the systemic circulation, Fsys)是指藥物到達(dá)體循環(huán)的劑量��,由口服給藥與靜脈給藥的比值求得��;吸收分?jǐn)?shù)(fraction absorbed, Fa)是指從制劑中溶出���,然后穿過頂端細(xì)胞膜吸收進(jìn)入腸細(xì)胞內(nèi)的劑量分?jǐn)?shù)。Fsys是Fa�����、胃腸道代謝分?jǐn)?shù)(fraction of gastrointestinal availability, Fg)及肝臟首過代謝分?jǐn)?shù)(fraction of hepatic availability, Fh)的乘積�,如圖1所示。藥物的Fa與Fsys是很容易混淆的兩個概念�����,F(xiàn)g��、Fh是化合物依賴性特征�����,而Fa受極其復(fù)雜的因素影響���。
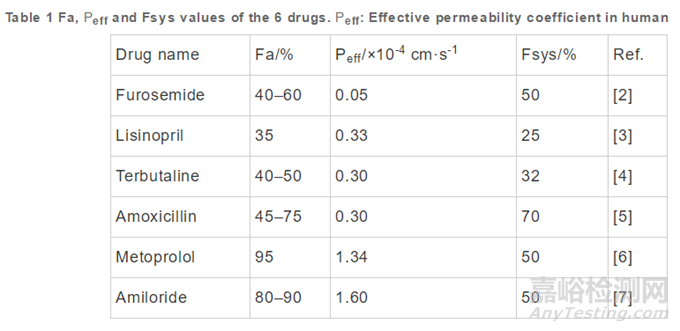
一個藥物的Fsys、Fa�����、通透性有時候并不同步��,例如特布他林的Fa與阿莫西林相似���,但是特布他林的Fsys比阿莫西林低��;依那普利與阿莫西林的人體通透性數(shù)值相似�,但是依那普利的Fa遠(yuǎn)低于阿莫西林���;有的藥物Fa相似�����,但是人體通透性數(shù)值差別極大�����,如呋塞米和特布他林(表1)��。導(dǎo)致藥物的絕對生物利用度比較低的原因通常有兩類�����,一類是Fa低導(dǎo)致的�,另一類是首過代謝引起的。前者可以通過制劑處方的優(yōu)化來改善�����,而后者是化合物依賴性特征�,處方優(yōu)化難以改善生物利用度。將絕對生物利用度和吸收分?jǐn)?shù)進(jìn)行區(qū)分對于生物藥劑學(xué)而言十分重要����,尤其是據(jù)文獻(xiàn)報道,當(dāng)Fa<20%的時候����,藥物極其容易受到各種因素的影響����。
1��、直接影響吸收分?jǐn)?shù)大小的三個時間因素
制劑在體內(nèi)經(jīng)過崩解��、溶出以及跨膜轉(zhuǎn)運(yùn)后進(jìn)入體循環(huán)��。以往生物藥劑學(xué)分類系統(tǒng)(BCS)根據(jù)藥物的溶解度和通透性的高低將藥物分為四類��,后來有學(xué)者建議應(yīng)將通透性改為可吸收性�����,例如歐盟����。
對BCS分類系統(tǒng)可以進(jìn)一步用無量綱參數(shù)吸收數(shù)(absorption number, An)����、溶出數(shù)(dissolution number, Dn)以及劑量數(shù)(dose number, Do)來描述藥物的吸收特征。具體計算公式如下:
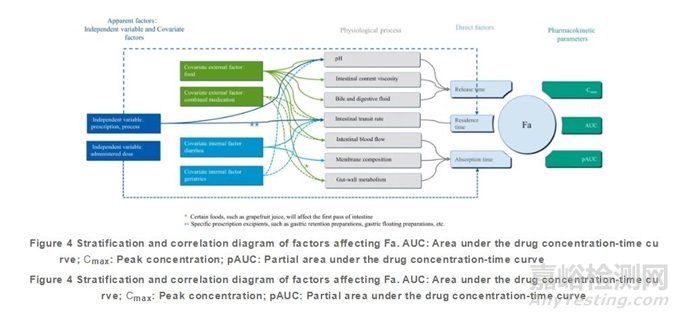
An為藥物在腸道停留時間除以吸收時間(使用一室模型預(yù)估)�,小于1.0時����,表示藥物可能不會被完全吸收�;Dn為腸道停留時間除以溶解時間,小于1.0表示藥物在通過小腸的過程中可能不會溶出全部藥物����,Do為給藥劑量除以250mL介質(zhì)中按照pH1.0~8.0之間最低溶解度可以溶解的藥量,大于1.0表示該劑量可能不會完全溶解在250mL水中�。以上分析表明,F(xiàn)a是一個包含有三個變量(完全釋放所需時間��、完全吸收所需時間����、藥物胃腸道吸收窗內(nèi)停留時間)的多元函數(shù)(圖2)。
1.1 Fa與藥物完全吸收所需時間的關(guān)系
Fa難以直接測定�����,除了沒有首過效應(yīng)也不與蛋白結(jié)合的藥物(例如二甲雙胍�����、核苷酸類藥物等)的Fa等于Fsys,其他藥物只能通過間接方法進(jìn)行估算�。Li等對常用體外模型(Caco-2、Ussing Chamber等)做過系統(tǒng)綜述���,這里不進(jìn)行詳細(xì)敘述�。
理想狀態(tài)下�����,當(dāng)固定濃度的藥物溶液在圓柱體腸腔內(nèi)灌流過程中����,假設(shè)沒有擴(kuò)散過程,即用充分?jǐn)嚢枘P蛠砻枋?����,其吸收分?jǐn)?shù)和吸收所需時間的關(guān)系如下公式:

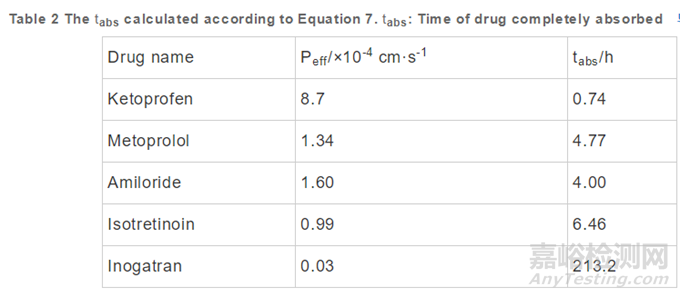
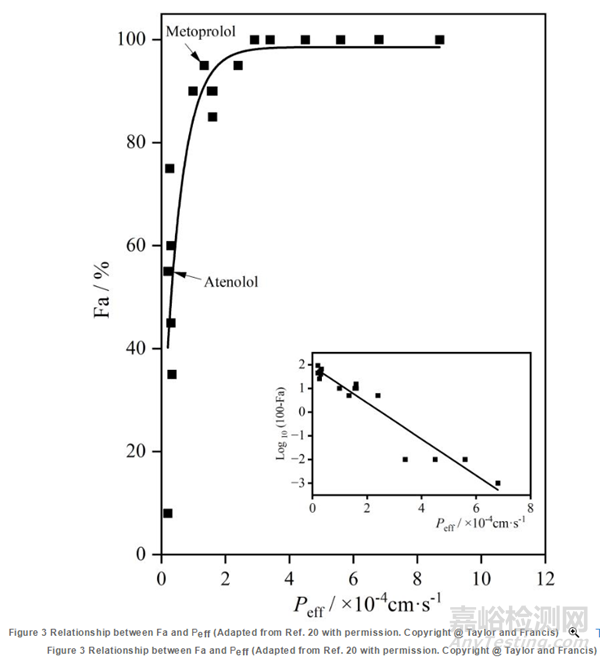
雖然可以直接通過Loc-I-Gut技術(shù)測定藥物在人體的通透性值����,但是Loc-I-Gut不能直接評估制劑的Fa����,且實驗操作繁瑣,價格昂貴,涉及倫理學(xué)問題���,其應(yīng)用受到很大限制���。
1.2 Fa和藥物完全釋放所需時間的關(guān)系
通常情況下,當(dāng)有足夠的時間使得藥物能完全釋放�����,則藥物的Fa會增加��,但是這個關(guān)系并不絕對��,例如當(dāng)給予相同的日劑量時�����,鹽酸二甲雙胍緩釋制劑的生物利用度只有速釋制劑的79%����;相同日劑量下,緩釋普萘洛爾的生物利用度也只有速釋制劑的57%�����。雖然緩釋制劑充分利用了胃腸道停留時間,但是釋放的藥物不能被完全吸收���,部分藥物是無效釋放�����。而當(dāng)給予大鼠同樣劑量的麥冬多糖時��,控釋制劑比速釋制劑的藥時曲線下面積(area under the concentration time curve, AUC)增加163%���,F(xiàn)a增加160%左右;而對于不同釋放速度的控釋制劑���,其達(dá)峰時間(peak time, tmax)不同�����,AUC和Fa均不同���;當(dāng)釋放速度更加低時,其AUC和Fa與速釋制劑沒有明顯差別��。
1.3 Fa與藥物胃腸道停留時間的關(guān)系
胃腸道的遷移速度影響著藥物制劑在胃腸道的停留時間�����,并對藥物的Fa產(chǎn)生顯著影響��。對于膜通透性有限���、易在腸道內(nèi)降解或溶出成為體內(nèi)吸收限速步驟的藥物����,腸道轉(zhuǎn)運(yùn)時間對其吸收有顯著影響����。大量文獻(xiàn)報道,利用射線掃描技術(shù)���、氫氣呼吸試驗���、插管技術(shù)以及γ-閃爍掃描技術(shù)等測量小腸轉(zhuǎn)運(yùn)時間。根據(jù)報道����,食物對胃排空的影響十分顯著,溶液劑�、微丸及片劑��、膠囊劑受食物影響情況不同��,高脂早餐后����,溶液劑的胃中停留時間約為1h���,微丸劑大約1~5h��,片劑����、膠囊在胃中甚至可以保留9h��;小腸遷移速度受食物影響較小�����,各劑型平均停留時間為3~4h�����。藥物粒子大小也會影響停留時間�����,大粒子比小粒子在胃內(nèi)停留時間長�。
藥物在胃腸道的停留時間受很多因素影響,包括協(xié)變量食物�����、合并用藥以及自變量輔料的影響��。腹瀉縮短胃腸道停留時間�����,促胃動力藥(如甲氧氯普胺��、多潘立酮)以及阿片類藥物都能改變藥物在胃腸道的停留時間����,從而導(dǎo)致藥物的吸收改變,Greiff等對此作過具體敘述����。一些滲透活性輔料(如甘露醇、山梨醇�、PEG400等)導(dǎo)致腸壁膜兩側(cè)滲透壓發(fā)生改變�����,從而導(dǎo)致滲透性腹瀉����,加速小腸轉(zhuǎn)運(yùn)����,縮短藥物的胃腸道停留時間,降低藥物的Fa和生物利用度(如西咪替丁��、雷尼替丁等)���。
目前可以通過制劑技術(shù)來延長藥物在胃腸道內(nèi)的停留時間�����,增加制劑的密度�、浮力�、黏附能力或者改變幾何形狀是常用的技術(shù)。
增加浮力的制劑包括地爾硫?漂浮片�����、維拉帕米漂浮顆粒等;當(dāng)制劑密度達(dá)到2.6~2.8g·mL-1�,制劑可以在胃中長時間停留。但是這種技術(shù)的缺點是無法應(yīng)用于大部分藥物以及技術(shù)很難達(dá)到預(yù)期的浮力與密度標(biāo)準(zhǔn)����。
可以在液體制劑中添加聚合物�、凝膠或薄膜等增加制劑的黏度和黏附作用,例如將液體布地奈德與增稠劑(如楓糖漿或三氯蔗糖)混合可增加在食管黏膜的黏附性����,獲得更長的滯留時間,從而增加藥物的局部吸收��。此技術(shù)的缺點是無法精準(zhǔn)定位附著部位��。
以色列Intec Pharmaceuticals Ltd. 公司研發(fā)出一種名為Accordion Pill Carbidopa/ Levodopa (AP-CDLD)的治療帕金森病的新型制劑����,該制劑采用了一種折疊成手風(fēng)琴狀、可生物降解的高分子材料����,內(nèi)含控釋藥物層和速釋藥物層,該高分子材料可以在胃中延展并保留長達(dá)12h�����。
2、影響Fa的表觀因素和中間過程因素
上述三個時間因素之間的相互關(guān)系會直接影響Fa的大小����,但是在臨床實踐中并不能直接獲取這三個因素的信息����,從而難以預(yù)測和估算Fa的高低。而一些能直接收集到的表觀信息和因素�,例如劑型、劑量�����、年齡��、處方����、食物����、合并用藥等因素也會影響Fa的大小��,不過這些因素是通過對一些生理過程和內(nèi)環(huán)境的影響,例如胃pH��、胃腸道內(nèi)容物的黏度��、消化液(包括膽汁)的組成���、胃腸道血流量等,進(jìn)而影響藥物完全釋放時間��、藥物消化道吸收窗停留時間�����、藥物完全吸收時間��,而最終影響Fa的大小�����,有必要對上述的復(fù)雜關(guān)系和過程進(jìn)行系統(tǒng)梳理。
2.1 生理過程和內(nèi)環(huán)境
2.1.1 內(nèi)臟血流量
疾病及食物會改變?nèi)梭w內(nèi)臟血流速度,當(dāng)胃腸道血流量下降時�,血液運(yùn)走藥物的能力降低,無法維持漏槽狀態(tài)��,因此藥物的吸收降低����。研究表明���,絨毛血供的改變可能會影響某些藥物的腸道吸收�。例如在大鼠中���,安替比林和水楊酸(主要由血漿蛋白結(jié)合轉(zhuǎn)運(yùn))在非血管灌注腸中的吸收率降低60%�����,兩種藥物的吸收都受到血流限制。
2.1.2 胃腸道首過代謝
胃腸道黏膜內(nèi)存在各種消化酶和腸道菌群產(chǎn)生的酶����,能代謝某些藥物,藥物在胃腸道滯留時間越長���,這種代謝反應(yīng)就越容易發(fā)生��,影響藥物的吸收����。Fagerholm[43]作了關(guān)于胃腸道代謝如何影響藥物的吸收以及如何預(yù)測這種影響的系統(tǒng)綜述����。在這里只討論CYP3A4酶����、食物(果汁、酚類及多酚類物質(zhì))、藥物等可以抑制CYP3A4酶��,降低藥物的代謝����,使得吸收增加�����。典型代表是葡萄柚汁可以抑制CYP3A4酶,降低非洛地平的體前代謝����,其AUC、血藥峰濃度(peak concentration, Cmax)分別增加267%和345%[44]��;葡萄柚汁還抑制有機(jī)陰離子轉(zhuǎn)運(yùn)肽1A2轉(zhuǎn)運(yùn)蛋白�,當(dāng)給予300mL葡萄柚汁后����,非索非那定的AUC0-8h下降52%,提前2h服用葡萄柚汁則下降38%�����,提前4h服用則對AUC無影響���。
2.1.3 改變胃腸pH
Abuhelwa等對食物和胃腸道pH值變化如何影響藥物的吸收作了詳細(xì)研究,食物��、胃腸道或全身性疾?���。ㄈ鐞盒载氀龋?��、年齡�����、晝夜節(jié)律和共同給藥等均會影響pH值���,這些變化可能會影響藥物的釋放�、藥物的溶解度����、藥物的穩(wěn)定性以及腸道通透性等��,導(dǎo)致藥物的吸收發(fā)生改變����。例如健康受試者同時服用200mg劑量的伊曲康唑(一種水溶性差的弱堿性藥物���,pKa=3.7)和抗酸劑混懸液,伊曲康唑的口服吸收率和程度顯著降低��,AUC和Cmax分別降低66%和70%。胃pH升高與酮康唑�����、伊曲康唑��、雙嘧達(dá)莫��、桂利嗪等藥物的口服吸收減少有關(guān)�。
2.1.4 膽汁分泌
食物中的脂肪類物質(zhì)會促進(jìn)膽汁分泌�����,膽汁具有表面活性�����,能增加難溶性藥物的溶解度����,通過影響藥物從制劑中的溶出釋放過程來改變Fa��。例如���,餐后膽汁分泌增加�����,通過增加卡馬西平及苯妥英的溶解度增加吸收����。在大鼠中����,懸浮液中環(huán)孢素A的生物利用度為5.4%���,而當(dāng)大鼠膽汁插管后��,其生物利用度降至1.6%�����。早期研究表明,膽汁可促進(jìn)脂溶性維生素的吸收��,比如維生素A����、維生素K、維生素D等�。
2.1.5 消化道壁膜組成改變
在某些疾病狀態(tài)下�,機(jī)體消化液成分、消化道壁膜組成會發(fā)生改變��,藥物在胃腸道的通透性增大導(dǎo)致Fa增加����?����?肆_恩疾病可能會破壞細(xì)胞間的緊密性��,導(dǎo)致某些藥物的細(xì)胞旁路通透性增加�,如蔗糖和乳果糖�;潰瘍性結(jié)腸炎可能會改變胃腸道膜的組成,從而影響藥物的胃腸道通透性��,患者結(jié)腸和直腸黏膜中BCRP、MRP2和P-gp的表達(dá)水平顯著降低�����,磺胺吡啶(MRP2和BCRP底物���,用于治療腸炎)在此疾病狀態(tài)下的腸道吸收可能會增加,生物利用度也增加�,不良反應(yīng)也將增加。
2.1.6 遷移速度
遷移速度影響胃腸道停留時間��,年齡�����、處方工藝����、食物合并用藥以及疾病等都能改變遷移速度�。阿托品能減慢胃排空速率與腸內(nèi)容物的運(yùn)行速率�����,從而增加某些藥物的吸收;甲氧氯普胺等促胃動力藥能促進(jìn)胃排空且增加腸運(yùn)行速率���,減少在消化道內(nèi)的滯留時間,從而減少藥物的吸收����,例如甲氧氯普胺可以增強(qiáng)美西律的吸收速率����,而阿托品則降低了吸收速率。
2.2 表觀因素
2.2.1 協(xié)變量外因:食物
食物通過影響藥物的溶解度���、釋放度�、胃腸pH�����、減緩胃排空��、影響消化液組成、促進(jìn)膽汁分泌�����、增加淋巴運(yùn)輸以及改變藥物的通透性等改變Fa�����。食物與藥物相互作用可能導(dǎo)致以下四種結(jié)局之一:吸收延遲�����、吸收減少�����、吸收增加或者吸收不受影響��。關(guān)于食物影響已經(jīng)研究透徹,不作細(xì)致討論�。
2.2.1 協(xié)變量外因:食物
食物通過影響藥物的溶解度、釋放度�、胃腸pH��、減緩胃排空、影響消化液組成��、促進(jìn)膽汁分泌����、增加淋巴運(yùn)輸以及改變藥物的通透性等改變Fa��。食物與藥物相互作用可能導(dǎo)致以下四種結(jié)局之一:吸收延遲���、吸收減少�����、吸收增加或者吸收不受影響��。關(guān)于食物影響已經(jīng)研究透徹����,不作細(xì)致討論。
2.2.2 協(xié)變量外因:合并用藥
合并用藥通過改變藥物的溶解����、通透性��、改變胃腸遷移速度(如胃動力藥類)��、腸血流量以及降低藥物在胃腸代謝影響Fa。關(guān)于合并用藥中產(chǎn)生的藥物相互作用有非常多的研究和報道��,例如碳酸氫鈉加速胃排空并增加對乙酰氨基酚的吸收��,還能改變氟伐他汀與膜磷脂的相互作用��。甲氧氯普胺能降低西咪替丁的吸收;當(dāng)?shù)馗咝僚c甲氧氯普胺聯(lián)合給藥后��,地高辛血藥濃度顯著降低(0.72~0.46μg·L-1)。很早就報道過同時服用鐵劑會顯著降低口服四環(huán)素的血清水平���。乙醇在日常中經(jīng)常使用����,乙醇可能增加親脂性藥物的溶解度����,增加藥物的吸收����,例如在給予50%乙醇水溶液后����,安定的Cmax幾乎翻倍�����;苯巴比妥可減少灰黃霉素的吸收。
2.2.3 協(xié)變量內(nèi)因:疾病
某些疾病會改變胃腸道內(nèi)容物的遷移速度、消化道壁膜的組成等�����,導(dǎo)致Fa改變。吉非替尼的主要不良反應(yīng)包括腹瀉��,臨床試驗結(jié)果表明�����,腹瀉患者AUC值僅為未腹瀉患者AUC的46%,主要原因是胃排空與胃腸道遷移速度加快��,導(dǎo)致藥物在胃腸道中的停留時間縮短��,部分藥物來不及從制劑中釋放就被排出機(jī)體�。甲狀腺功能異常會改變腸道運(yùn)動的自主節(jié)律性�����,導(dǎo)致藥物在胃腸道的停留時間改變,藥物的吸收也改變����。在甲狀腺功能減退的兒童中觀察到對維生素B2的吸收增加����,而甲狀腺功能亢進(jìn)的兒童維生素B2的吸收降低�。
2.2.4 協(xié)變量內(nèi)因:年齡
老年人的結(jié)腸遷移速度較慢�����,同時胃內(nèi)pH會升高�����,這些因素可能會影響藥物的Fa值。老年人胃內(nèi)pH的升高會導(dǎo)致雙嘧達(dá)莫的吸收受損���;在年齡較大的受試者(≥65歲)中,非索非那定的血漿峰值水平比年輕受試者中(<65歲)的血漿峰值高99%。
2.2.5 自變量:給藥劑量
不僅藥物本身的吸收是劑量依賴性的�,食物對藥物的影響也具有劑量依賴性����。許多藥物低劑量表現(xiàn)出線性動力學(xué)特征����,F(xiàn)a比較高�;隨著劑量增加�����,藥物吸收飽和��,AUC不能隨之增加���,呈現(xiàn)出非線性動力學(xué)特征�。在研究12.5、25����、50mg·kg-1給藥劑量后,由于吸收飽和���,γ-氨基丁酸的AUC與劑量不成比例增加。阿比特龍的水溶性極低�,在早期開展的250~1000mg食物影響研究探索階段發(fā)現(xiàn)��,低劑量下����,吸收呈線性動力學(xué)特征����,高劑量在空腹時發(fā)生吸收飽和��,且食物對阿比特龍AUC的影響具有顯著的劑量依賴性��。
2.2.6 自變量:處方����、工藝
制劑及其工藝通過改變pH和遷移速度影響制劑釋放過程和胃腸道停留時間�,進(jìn)而改變Fa����。活性藥物成分(API)顆粒大小�、API理化性質(zhì)�、片劑大小、腸溶衣等會影響藥物在胃腸道的溶解釋放過程�����,從而影響藥物的吸收情況。
制劑中輔料(山梨醇、甘露醇��、PEG400等)通過改變藥物的溶解度�、減少代謝或外排、改變通透性以及改變胃腸轉(zhuǎn)運(yùn)時間等來影響藥物的吸收����。少量的表面活性劑(如十二烷基硫酸鈉)或山梨醇可能改變腸膜穩(wěn)定性��,這將導(dǎo)致藥物的通透性改變�,如僅4mg十二烷基硫酸鈉就會使阿侖膦酸鹽的生物利用度增加500%~600%����,7mg山梨醇會降低利培酮的Cmax���,60mg時會降低AUC��。
2.3 直接因素�����、中間生理因素�、表觀因素的相互關(guān)系匯總
直接因素和表觀因素以及機(jī)體中間變化過程之間關(guān)系如圖4所示����。這些因素之間并不獨立����,是相互影響的。比如多種因素導(dǎo)致胃內(nèi)pH升高,這將會降低水溶性差的弱堿性藥物的溶解度���,然而當(dāng)藥物具有一定親脂性時,這種影響可能會被膽汁介導(dǎo)的溶解增加所抵消�����。
3、Fa的評估
評估藥物的Fa涉及到多個因素和生理過程,且受到各種協(xié)變量因素的影響�����,目前尚無公認(rèn)的����、高效的���、準(zhǔn)確的一攬子解決方案,一直是工業(yè)界希望解決的難點和痛點���。解決問題的思路主要從兩個方向進(jìn)行努力:一種是用更復(fù)雜的體外溶出和吸收裝置模擬體內(nèi)過程��,另一種是利用軟件獲取各種生理參數(shù)����,結(jié)合藥物的物理化學(xué)特性、藥代特性�����,更好地虛擬模擬體內(nèi)過程。
3.1 溶出-滲透一體裝置
利用復(fù)雜的體外裝置盡量準(zhǔn)確地模擬體內(nèi)過程����,同時考慮三個直接因素:利用生物相關(guān)溶出介質(zhì)模擬人體內(nèi)釋放情況,利用流通池或往復(fù)筒等方法設(shè)定體內(nèi)特定生理環(huán)境下的停留時間��,利用平行人工膜體外滲透技術(shù)(parallel artificial membrane permeability assay, PAMPA)等模擬人體內(nèi)的吸收情況�����。目前文獻(xiàn)報道較多的是TNO TIM-1系統(tǒng)和LOGAN PERMETRO系統(tǒng)����。
TNO TIM-1系統(tǒng)模擬了人體胃和小腸內(nèi)腔內(nèi)發(fā)生的體內(nèi)動態(tài)生理過程,包括生理量的酶變化情況和膽汁鹽的分泌情況��,阿斯利康公司利用該設(shè)備對難溶性藥物AZD8055進(jìn)行了吸收預(yù)測���;TNO TIM-1系統(tǒng)還可研究藥物(如對乙酰氨基酚)的口服吸收以及食物影響等。
LOGAN最新的PERMETRO系統(tǒng)是集成了溶出和滲透功能的全自動測試系統(tǒng)��,可同時測試藥物的溶出和滲透結(jié)果����,可以評估特定條件下Fa的大小�����。滲透部分使用的膜是PermeaPad���,是一種具有三明治式層狀結(jié)構(gòu)的人工纖維素-磷脂仿生膜,用于測試藥物的表觀滲透系數(shù)���,使用PermeaPad測得的數(shù)據(jù)與文獻(xiàn)報道中成熟體外測定方法(Caco-2或PAMPA)之間存在良好的相關(guān)性����。
3.2 利用軟件預(yù)測Fa
目前有多個商用軟件可以應(yīng)用于Fa的預(yù)測�����,包括GastroPlusTM���、SimCYP®�����、GI Sim等�����。其中應(yīng)用比較廣泛的是GastroPlus™����,該軟件基于高級房室吸收與轉(zhuǎn)運(yùn)模型開發(fā)�����,并經(jīng)歷了多次改進(jìn)�。其基本原理是分段研究藥物在生物相關(guān)溶出介質(zhì)下的釋放�����、藥物的跨膜通透能力�、制劑的生物黏附能力等����,然后結(jié)合人體生理參數(shù)��,預(yù)測人體內(nèi)藥物的釋放���、吸收等�。利用GastroPlus™可以預(yù)測API的溶解度����、粒度和粒度分布等不同理化因素對口服藥物吸收的影響����。在GastroPlus™中�����,可以使用藥物的物理化學(xué)參數(shù),結(jié)合臨床前體內(nèi)藥代數(shù)據(jù)來預(yù)測藥物吸收����。
4��、結(jié) 語
對于制劑開發(fā)研究人員來說,當(dāng)進(jìn)入臨床階段后才發(fā)現(xiàn)制劑的生物利用度易受協(xié)變量外因(如食物)和協(xié)變量內(nèi)因(如pH等)的影響時���,再進(jìn)行處方優(yōu)化會極大地影響項目進(jìn)度和成本�����。提前預(yù)判這些潛在風(fēng)險是一個亟待解決的科學(xué)問題�����。
Fa與自變量以及協(xié)變量因素之間關(guān)系錯綜復(fù)雜��,本文綜述了影響藥物Fa的各種因素�����,可以通過判斷釋放和吸收環(huán)的限速步驟���,進(jìn)而優(yōu)化處方工藝或給藥方案,以降低協(xié)變量內(nèi)外因?qū)λ幬矬w內(nèi)暴露水平的影響��,充分發(fā)揮藥品固有療效��,控制藥品的臨床表現(xiàn)�����。本文對這些因素進(jìn)行系統(tǒng)梳理��,以期對口服制劑的處方優(yōu)化提供一定借鑒和參考���。
文章來源:《藥學(xué)學(xué)報》作者:張萍�����,畢福林����,楊勁