今日頭條
興齊兒童近視改良新藥獲批上市�。興齊眼藥改良型新藥硫酸阿托品滴眼液(SQ-729)獲國家藥監(jiān)局批準上市,成為國內(nèi)首款用于延緩兒童近視進展的低濃度硫酸阿托品滴眼液。在Ⅲ期研究中�,與安慰劑組相比����,硫酸阿托品滴眼液組在主要療效指標上顯示出了具有統(tǒng)計學意義的顯著性改善,而且藥物安全性良好����,患者使用依從性好。有專業(yè)機構預測該產(chǎn)品上市的第3個完整年(2027年)將達到銷售峰值101.8億元����。
國內(nèi)藥訊
1.云頂新耀引進結腸炎新藥報產(chǎn)。云頂新耀從Arena公司(已被輝瑞收購)引進的口服選擇性1-磷酸鞘氨醇(S1P)受體調(diào)節(jié)劑伊曲莫德(etrasimod)的新藥上市申請獲得了澳門藥監(jiān)部門受理����,用于治療中重度潰瘍性結腸炎(UC)患者。去年3月發(fā)布于《柳葉刀》上的Ⅲ期ELEVATE UC 52研究顯示����,第52周時,etrasimod組患者達到32.1%(vs7.0%����,p<0.001)的臨床緩解率。該新藥此前已獲FDA和EMA批準上市,用于治療中重度UC患者���。
2.AZ/康諾亞ADC啟動國際Ⅲ期臨床���。阿斯利康Claudin18.2靶向抗體偶聯(lián)藥物AZD0901(CMG901)在中國登記啟動一項Ⅲ期臨床,在表達Claudin 18.2的晚期或轉移性胃及胃食管結合部腺癌的成人受試者中�,比較AZD0901單藥與研究者選擇的方案作用于二線或二線以上治療的有效性與安全性。這是一項國際Ⅲ期試驗����,項目中國部分由中山大學腫瘤防治中心徐瑞華博士牽頭開展。
3.銳格口服GLP-1啟動減肥Ⅱ期臨床�。銳格醫(yī)藥口服小分子GLP-1R激動劑RGT-075治療肥胖的Ⅱ期臨床完成首例患者入組。該項試驗計劃入組約69例肥胖患者(BMI在27-45之間)����,每天口服一次RGT-075或安慰劑,評估藥物安全性���、耐受性���、藥代動力學(PK)和藥效學(PD)。頂線數(shù)據(jù)預計2024年下半年讀出���。此前�,RGT-075已在美國開展用于治療二甲雙胍治療后血糖控制不佳的2型糖尿病患者的II期臨床。
4.諾誠健華濕疹新藥亮相AAD2024年會����。諾誠健華新型酪氨酸激酶2(TYK2)抑制劑ICP-332在AAD2024年會上公布了用于治療中重度特應性皮炎(AD)的Ⅱ期臨床最新數(shù)據(jù)。與安慰劑相比����,ICP-332(80m�、120mg)每日一次治療組患者的EASI評分較基線改善的百分比變化更高(78.2%和72.5%,vs16.7%)���,達成EASI 75應答的比例更高(64%和64%���,vs8%)。兩個治療組的總體不良事件發(fā)生率均與安慰劑組相當�。
5.樂普胰腺癌ADC獲快速通道認定。樂普生物TF靶向ADC新藥MRG004A獲FDA授予用于治療胰腺癌的快速通道資格�。值得一提的是,該產(chǎn)品胰腺癌適應癥此前已獲FDA授予孤兒藥資格認定�。TF的異常表達通常與腫瘤生長、血管生成���、腫瘤轉移和臨床治療預后差相關���。樂普生物正在中美兩國同步開展I/II期臨床���,評估MRG004A用于治療胰腺癌、三陰性乳腺癌及宮頸癌的抗腫瘤初步療效���。
6.科士華創(chuàng)新TCR-T報IND�。科士華生物1類生物制品“KSH01注射液”的臨床試驗申請獲CDE受理�。KSH01是該公司專有技術平臺TCR-XFinder™及TCR-XPlanet™ T細胞數(shù)據(jù)庫從患者體內(nèi)快速篩選出的天然來源TCR序列細胞療法,具有強效抗腫瘤活性����。科士華計劃開發(fā)KSH01用于治療包括食管癌����、胃癌、黑色素瘤���、肉瘤���、膀胱癌���、喉癌等多種晚期實體瘤。
國際藥訊
1.Epitomee/雀巢減肥膠囊報產(chǎn)����。Epitomee公司與雀巢合作開發(fā)的“減肥膠囊”已通過510(k)途徑向FDA遞交上市申請。“減肥膠囊”含有可膨脹的生物聚合物���,服用之后在胃部可膨脹成一個靈活的三角形���,使胃部產(chǎn)生飽腹感���,以幫助超重和輕度肥胖人群減重�。在關鍵RESET研究中����,受試者口服減肥膠囊24周后體重比基線減輕≥5%的比例達到56%;臨床中沒有發(fā)生與醫(yī)療器械相關的嚴重不良事件(SAE)�。
2.Dermavant公司濕疹乳膏亮相AAD2024年會。Dermavant公司在AAD2024年會上公布其芳香烴受體調(diào)節(jié)劑Vtama(tapinarof 1%乳膏)治療兩歲以上兒童和成人特應性皮炎(AD)患者的兩項Ⅲ期試驗(ADORING 1和ADORING 2)積極結果����。數(shù)據(jù)顯示�,兩項試驗均達到主要終點和關鍵次要終點����,分別有57.1%和58.1%的Fitzpatrick皮膚類型IV、V���、VI患者在第8周達到EASI75緩解����。目前�,Vtama用于≥2歲AD患者的sNDA正接受FDA監(jiān)管審查。
3.CuraSen公司CNS新藥Ⅱ期臨床積極����。CuraSen公司高腦透性β2腎上腺素受體(β2-AR)激動劑CST-2032聯(lián)合β阻滯劑CST-107在治療阿爾茨海默病或帕金森病相關輕度認知障礙(MCI)或癡呆患者的Ⅱa期臨床獲積極結果。數(shù)據(jù)顯示�,CST-2032/CST-107治療能顯著改善患者在多個認知領域的指標(包括記憶、注意力���、執(zhí)行功能����、面部識別和沖動控制)����;且組合療法安全性良好����,沒有發(fā)生嚴重不良事件���。
4.NodThera公司帕金森新藥早期臨床積極�。NodThera公司NLRP3炎癥小體抑制劑NT-0796治療帕金森病(PD)患者的Ⅰb/Ⅱa期試驗結果積極����。NT-0796(每日口服一次)治療28天后,患者腦脊液中的關鍵促炎生物標志物(例如IL-1β���、IL-6、CCL2���、CXCL1和CXCL8)和神經(jīng)退行性標志物(包括神經(jīng)絲輕鏈(NfL)和sTREM2)平均水平顯著降低���;腦脊液測量結果顯示,NT-0796在大腦中的有效濃度水平可維持超過24小時�。此外,NT-0796總體耐受性良好���。
5.遺傳性肝病基因編輯療法獲批臨床����。IECURE公司基于兩種AAV載體開發(fā)的基因療法ECUR-506獲英國藥品和保健品監(jiān)管局(MHRA)批準開展Ⅰ/Ⅱ期臨床,擬評估用于治療鳥氨酸氨甲?��;D移酶(OTC)缺乏癥新生兒的安全性與初步療效���。這是一種由遺傳缺陷導致的遺傳性代謝障礙,常發(fā)生于新生兒����。目前唯一針對早期發(fā)作的嚴重OTC缺乏癥的糾正性治療是肝移植。
6.Amylyx公司漸凍癥新藥III期研究失敗���。Amylyx公司創(chuàng)新復方制劑Relyvrio(AMX0035���,苯丁酸鈉/牛磺酸二醇)治療肌萎縮側索硬化(ALS)患者的III期PHOENIX研究未達到主要終點���。與安慰劑比�,AMX0035治療第48周時患者肌萎縮側索硬化功能評定量表(ALSFRS-R)評分較基線變化的統(tǒng)計不具顯著性差異(p=0.667)���。該項研究也未達到次要終點指標(生活質(zhì)量結果評估�、總生存期以及慢肺活量(SVC)衡量的呼吸功能等)。
醫(yī)藥熱點
1.我國科學家發(fā)現(xiàn)新冠病毒新血清型���。中國科學院微生物研究所等團隊以小鼠血清交叉中和的方法�,系統(tǒng)研究了新型的奧密克戎變異株XBB.1.16�、EG.5、FL.1.5.1和BA.2.86等受體結合域抗原性�,發(fā)現(xiàn)新冠病毒BA.2.86已經(jīng)分化為一種新的血清型?;赬BB抗原的新冠疫苗存在被BA.2.86及其后續(xù)衍生變異株逃逸的風險。這將為未來針對多價廣譜新冠疫苗和中和抗體的研發(fā)提供依據(jù)����,并為全球新冠病毒的預防和治療提供重要科學基礎。
2.基于腦機接口的神經(jīng)技術中心在米蘭成立�。意大利IRCCS圣拉斐爾醫(yī)院和圣拉斐爾生命健康大學3月6日宣布與巴西尼科萊利斯先進腦科學研究所達成協(xié)議,在米蘭市建立全球最先進的神經(jīng)技術中心——圣拉斐爾神經(jīng)技術中樞����。該中心基于非侵入性腦機接口(nBMI)技術�,將成為歐洲首個專注于大規(guī)模神經(jīng)技術和神經(jīng)康復協(xié)議的機構。
評審動態(tài)
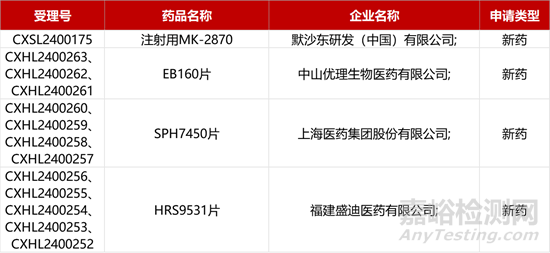
1. CDE新藥受理情況(03月10)
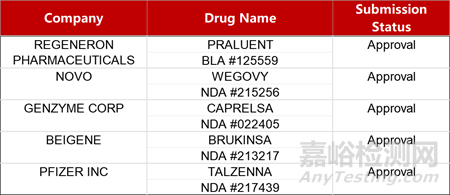
2. FDA新藥獲批情況(北美03月08日)