穩(wěn)定性研究在制藥行業(yè)中扮演著重要角色���。藥品產(chǎn)品的穩(wěn)定性研究有所有的指導(dǎo)方針,如國際協(xié)調(diào)會(ICH)���、美國食品和藥物管理局(USFDA)����、歐洲藥品管理局(EMEA)�、世界衛(wèi)生組織(WHO)等。存放時限研究數(shù)據(jù)應(yīng)該確保中間產(chǎn)品/待包裝產(chǎn)品的最大允許存放時限����。
存放時限研究樣品需要使用常用的聚乙烯袋、消毒容器����、高密度聚乙烯(HDPE)或玻璃容器包裝�。樣品需要存放在GMP條件下,即在制造區(qū)域的批次或階段保持���。
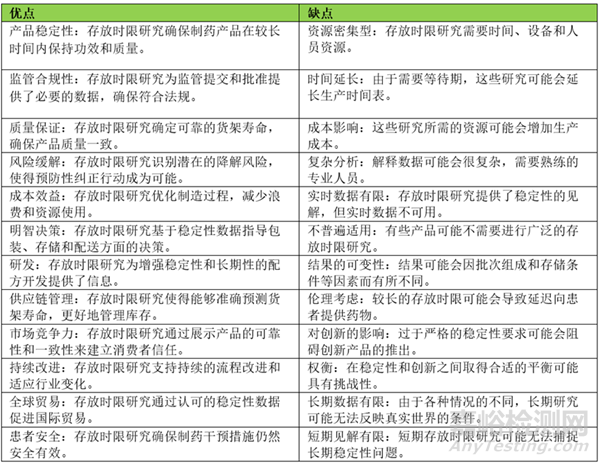
存放時限研究在制藥行業(yè)中的優(yōu)點和缺點
存放時限研究是指在制藥行業(yè)進行的一系列受控實驗�,旨在評估產(chǎn)品在一定時間范圍內(nèi)的穩(wěn)定性和可行性。這些研究在確保產(chǎn)品完整性�、監(jiān)管合規(guī)性、優(yōu)化生產(chǎn)流程���、風(fēng)險緩解����、質(zhì)量控制�、明智決策、研發(fā)����、供應(yīng)鏈管理、市場競爭力����、持續(xù)改進、全球覆蓋和創(chuàng)新信心方面發(fā)揮著關(guān)鍵作用���。
存放時限穩(wěn)定性研究流程
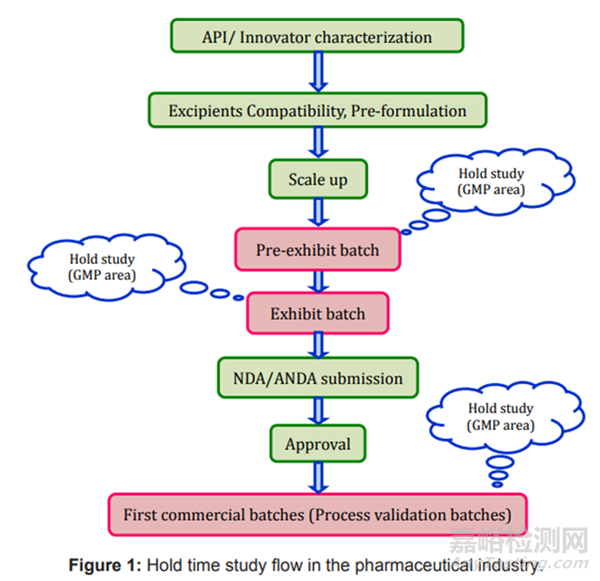
圖1存放時限研究流程圖
存放時限研究在產(chǎn)品開發(fā)階段���、放大階段和商業(yè)驗證階段進行���。在開始存放時限研究之前,制劑科學(xué)家需要選擇關(guān)鍵階段����、時間點和測試項目。流程如圖1所示���?��?砂凑找韵虏襟E進行:
i.選擇關(guān)鍵步驟;
ii.保持研究時間點和測試���;
iii.保持研究方案�;
iv.保持研究分析���;
v.保持研究報告���;
vi.保持研究結(jié)果評估。
依照劑型制定的研究階段
主要的存放時限研究階段包括混合���、攪拌����、潤滑�、粘合劑溶液、包衣溶液����、未包衣片劑、包衣片劑�、填充膠囊、糖漿溶液�、注射用粉末、液體注射劑����、散裝乳霜/軟膏/凝膠。
選擇存放時限穩(wěn)定性研究條件非常重要����。這些條件與制造區(qū)域/存放區(qū)域的條件相同,根據(jù)劑型的制造工藝�,可以確定存放時限穩(wěn)定性研究階段。表1總結(jié)了所有制藥劑型的存放時限研究階段和研究時間要求�。
表1 不同劑型及制劑階段存放時限研究匯總
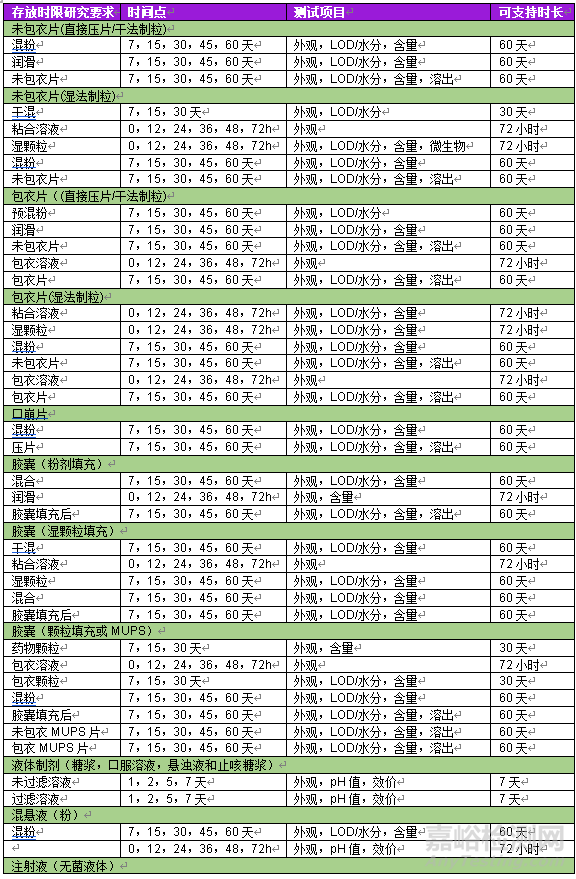
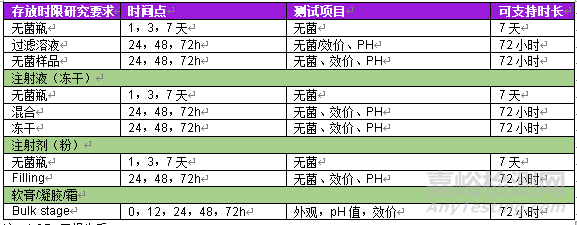
注:LOD=干燥失重
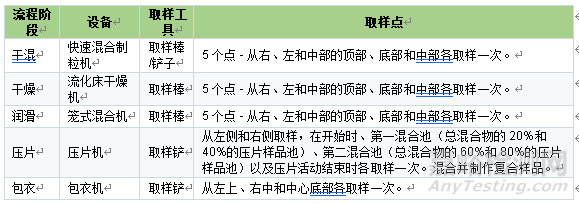
表1 不同制劑階段推薦取樣方式
1. 片劑
通常,片劑有兩種類型,即未包衣片劑和包衣片劑(薄膜包衣或腸溶包衣)�。
1.1. 未包衣片劑
未包衣片劑采用直接壓片法和濕法造粒法制造。直接壓片法是制造片劑的簡單和成本效益的方法����,因為它需要的加工階段比濕法造粒和輥壓成型等其他技術(shù)少。大多數(shù)API(活性藥物成分)由于缺乏流動性�、和潤滑性,無法直接壓制成所需的片劑�。
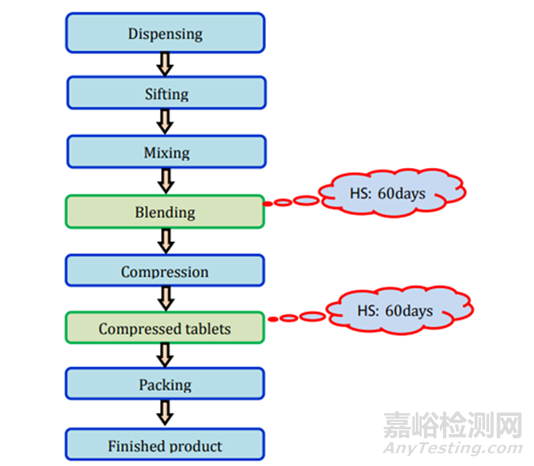
直接壓片/干法制粒:所需的測試和時間點列在表2中,存放時限研究的要求見圖2����。
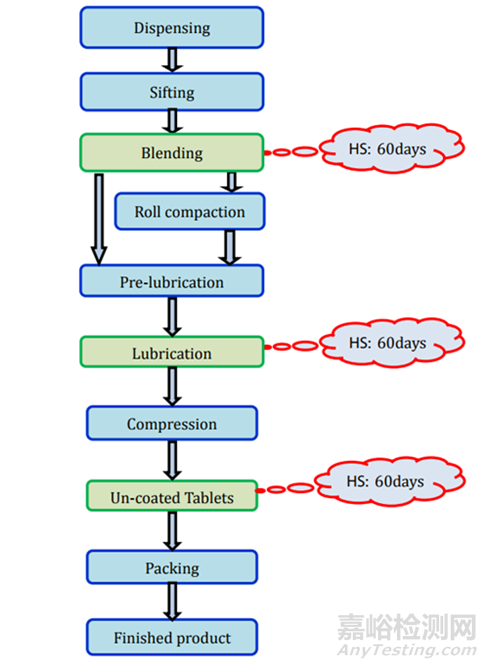
圖2未包衣片(直接壓片/干法制粒)制劑過程及存放時限研究要求
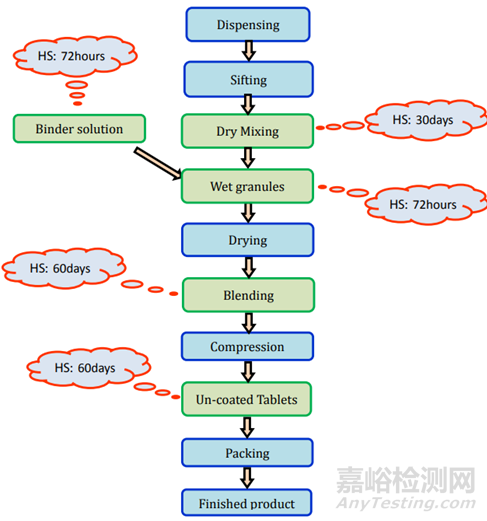
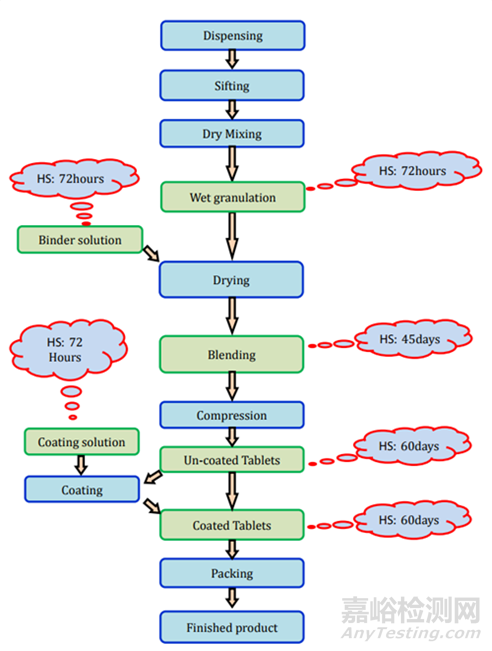
濕法制粒:制造工藝的詳細信息和存放時限研究細節(jié)在圖3和表2中表示。
圖3未包衣片(濕顆粒)制劑過程及存放時限研究要求
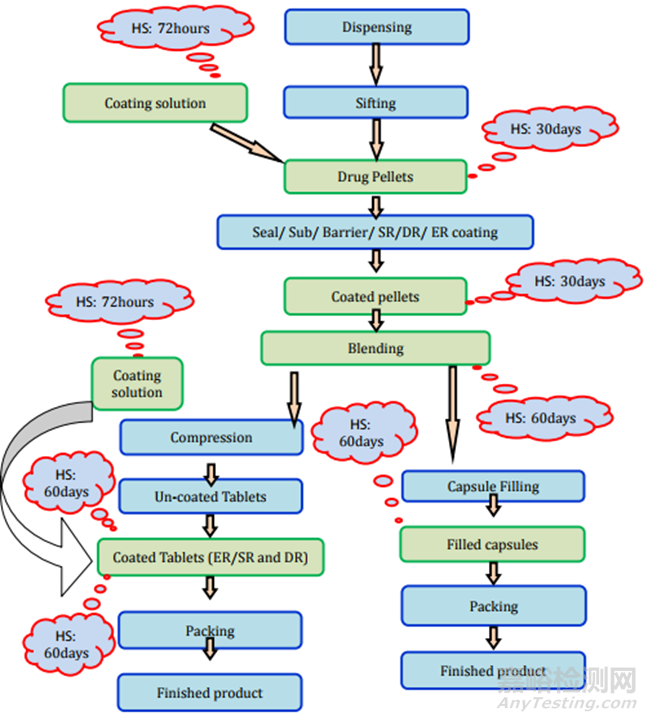
1.2. 包衣片
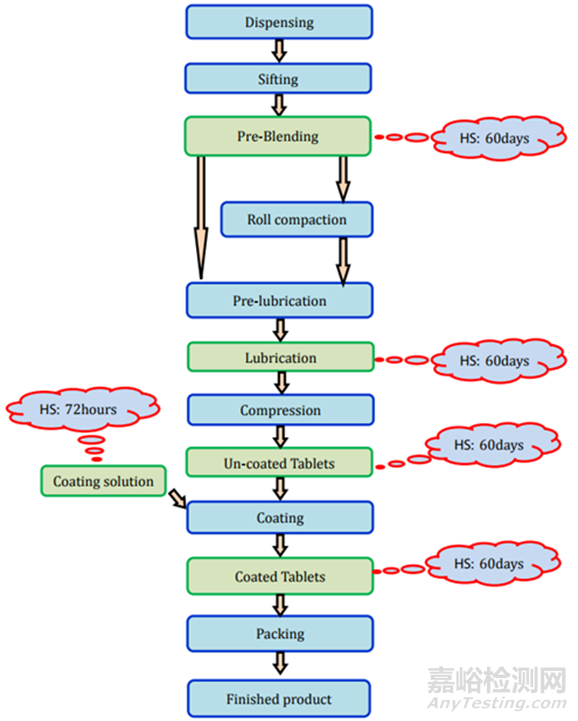
這類片劑也可以通過直接壓片/干法造粒和濕法造粒工藝制造���。直接壓片/干法造粒方法的片劑制造過程和存放時限穩(wěn)定性要求見圖3���。濕法造粒制造過程和存放時限研究要求見圖4。
圖4包衣片(濕顆粒)制劑過程及存放時限研究要求
2. 可分散片劑/口崩片
可分散片劑通常在給藥給患者之前在水或其他液體中分散����。這種藥物產(chǎn)品適用于吞咽固體劑型(如片劑或膠囊)存在困難的患者。制造過程和存放時限研究要求見表2和圖2~6����。
圖5包衣片(直接壓片/干法制粒)制劑過程及存放時限研究要求
圖6可分散片劑/口崩片制劑過程及存放時限研究要求
3. 膠囊
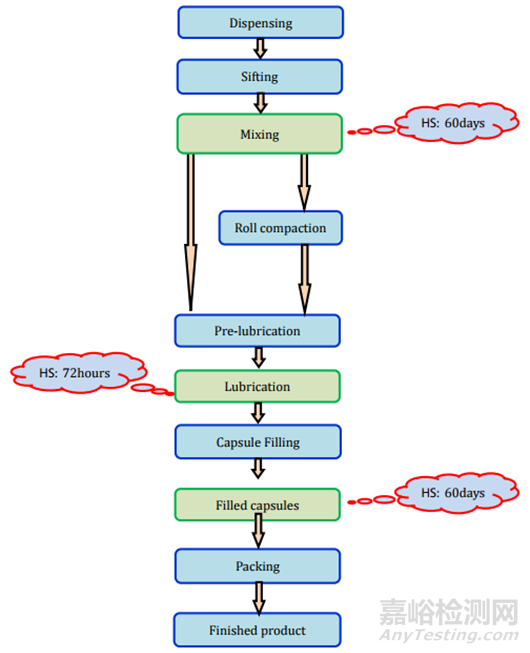
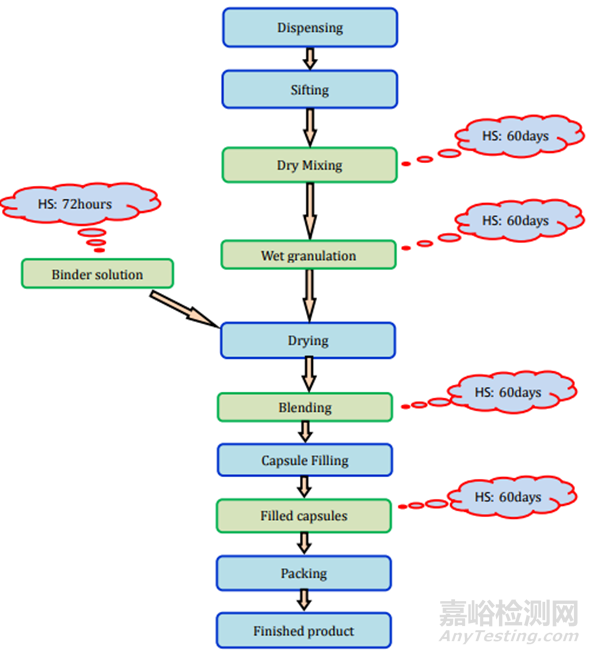
膠囊可以填充粉末�、顆粒����、微粒����、片劑、迷你片劑等�。主要有兩種類型的膠囊:1.硬殼膠囊,通常用于干燥的粉末成分或微小顆粒�;2.軟殼膠囊,主要用于油和溶解或懸浮在油中的活性成分���。所有類型膠囊的制造過程和存放時限研究要求見表2和圖7-9���。
圖7膠囊(粉劑填充)制劑過程及存放時限研究要求
圖8膠囊(濕顆粒)制劑過程及存放時限研究要求
圖9膠囊(顆粒/MUPS)制劑過程及存放時限研究要求
4. 混懸劑
混懸劑是不溶性或溶解性差的藥物在各種治療應(yīng)用中的首選和廣泛接受的劑型?��;鞈覄╅L期以來一直被用于制備口服���、局部和腸道制劑中的不溶性和溶解性差的藥物�。
圖10-16中表示了適當(dāng)?shù)姆治龇椒ê蛢x器(色譜儀�、粘度計、粒徑分析儀等)必須使用來正確表征混懸劑配方����。
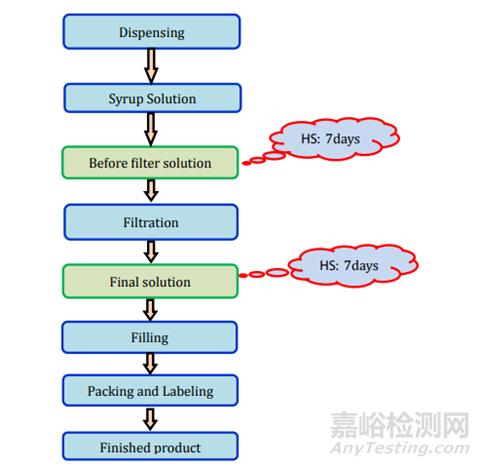
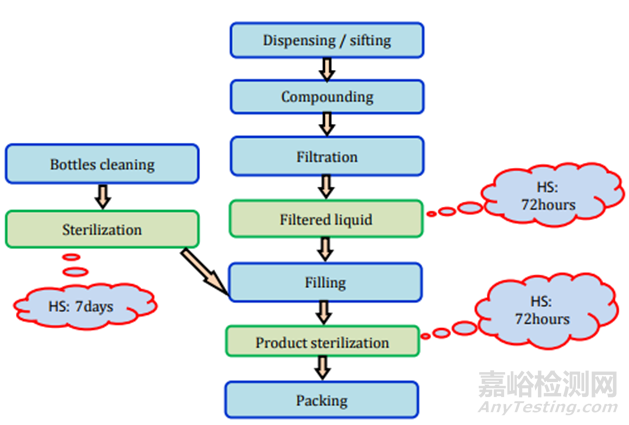
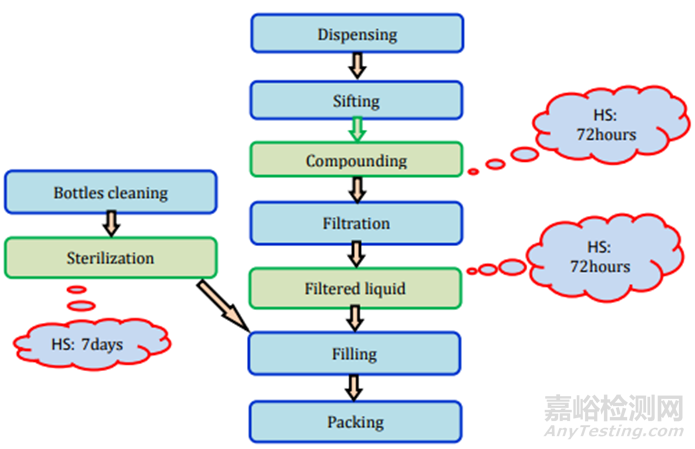
圖10液體制劑過程及存放時限研究要求
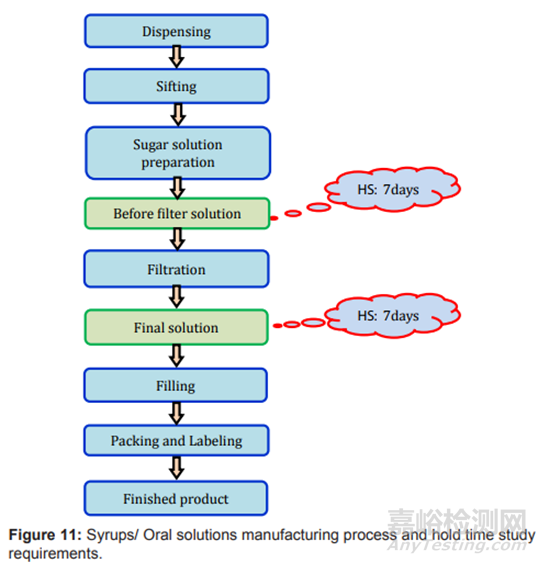
圖11制劑過程及存放時限研究要求
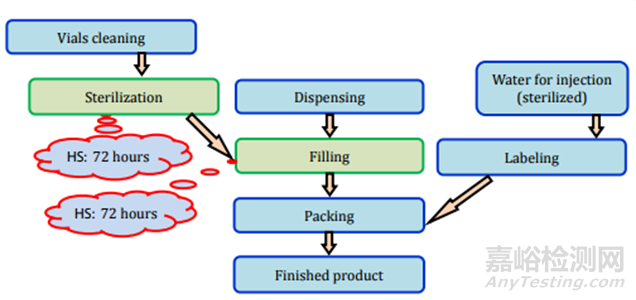
圖12注射(無菌液體)制劑過程及存放時限研究要求
圖13注射(液體)制劑過程及存放時限研究要求
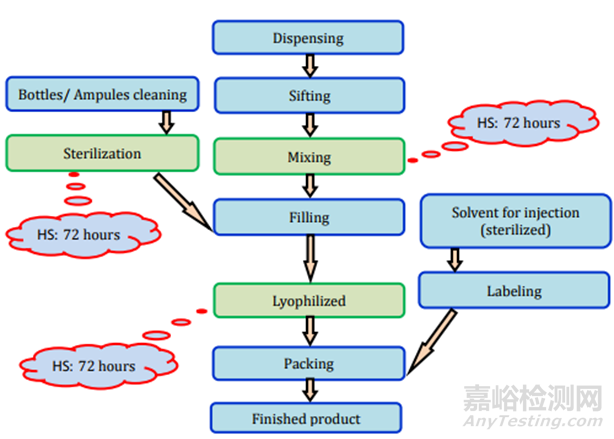
圖14注射(粉末)制劑過程及存放時限研究要求
圖15注射(凍干)制劑過程及存放時限研究要求
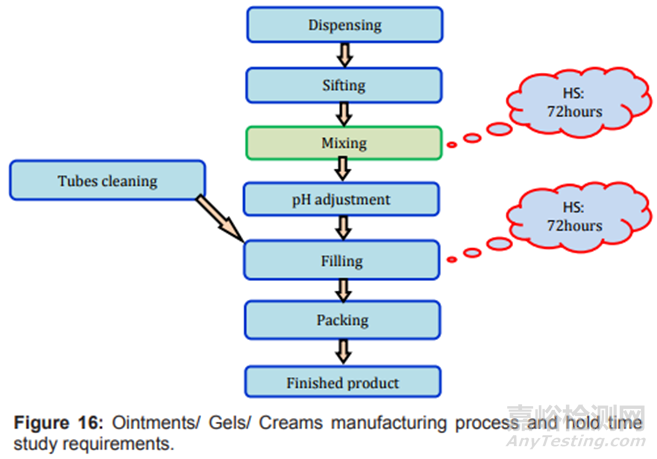
圖16制劑過程及存放時限研究要求
存放時限研究提供了每個在生產(chǎn)過程階段的質(zhì)量再保證。存放時限穩(wěn)定性研究是每個藥品制造階段的穩(wěn)定性建立工具�。在藥品產(chǎn)品開發(fā)中,存放時限穩(wěn)定性是建立在制存放時限的重要工具���。存放時限穩(wěn)定性是評估產(chǎn)品制造中每個階段的���。保持穩(wěn)定性研究可以展示混合或散裝階段在進行下一個階段加工之前適合保持多長時間。在適當(dāng)?shù)那闆r下����,應(yīng)該建立每個生產(chǎn)階段完成的時間限制,以確保藥品產(chǎn)品的質(zhì)量�。存放時限穩(wěn)定性研究結(jié)果應(yīng)該符合產(chǎn)品質(zhì)量標(biāo)準(zhǔn)。存放時限研究應(yīng)該只進行存儲容器的包裝���。如果劑型在散裝容器中存放超過30天�,應(yīng)該在指定條件下生成實時穩(wěn)定性數(shù)據(jù)����,以證明與市場包裝中的劑型具有可比性的穩(wěn)定性���。
建議和結(jié)論
保持研究評估在GMP條件下制造新產(chǎn)品起著重要作用?;诖娣艜r限研究的建立和貨架壽命,可以制定產(chǎn)品的生產(chǎn)計劃����。
參考資料
[1]https://www.linkedin.com/pulse/hold-time-study-shouvik-mondal
[2]Useni Reddy Mallu*, Arunkanth Krishnakumar Nair, Sridhar Bandaru and Jonna Sankaraiah, Hold Time Stability Studies in Pharmaceutical Industry: Review
[3]Huma Ali1*, Abdul Majid Khatri1, Ashish Jain1, Ravi Modi1, Alpesh Patel1, Standard Practice of sampling, storage and Holding Time for Pharmaceutical Tablet and Injection during manufacturing process
[4]WHO TRS 992 “Annex 4 General guidance on hold-time studies”
[5] Hold time study in Pharma 2023