眾所周知���,藥物進(jìn)入人體試驗(yàn)之前需要開展大量非臨床動(dòng)物研究�。各指導(dǎo)原則對(duì)于安全性研究中的動(dòng)物數(shù)量也有明確建議���。不過���,目前的趨勢(shì)是世界各地監(jiān)管機(jī)構(gòu)或協(xié)會(huì)大都在努力減少動(dòng)物的使用。當(dāng)然����,前提是不失其科學(xué)性。比如EMA在Directive 2010/63/EU中����,規(guī)定了動(dòng)物的替代(replacement)、減少(reduction)和優(yōu)化(refinement)原則���,即著名的“3R”原則����,旨在加強(qiáng)對(duì)動(dòng)物的保護(hù)。FDA也出臺(tái)了Modernization Act 2021�,允許使用新的替代方法評(píng)估藥物安全性。
正是基于減少動(dòng)物使用的原則����,虛擬對(duì)照(virtual control groups)的概念被引入安全性評(píng)價(jià)試驗(yàn)中,并用于取代平行對(duì)照組(concurrent control groups)���。所謂的平行對(duì)照組通常指給予稀釋藥物用的溶媒或其它溶劑的陰性對(duì)照組���,一般占毒理研究的25%的動(dòng)物數(shù)量����。虛擬對(duì)照的依據(jù)則主要來源于歷史對(duì)照數(shù)據(jù)。但是�,虛擬對(duì)照的使用是有很大挑戰(zhàn)的,如果試驗(yàn)相關(guān)協(xié)變量不能得到充分控制���,有可能對(duì)毒理研究結(jié)果造成影響�。
2023年�,徠博科(Labcorp)團(tuán)隊(duì)就虛擬對(duì)照替代平行對(duì)照可行性這一主題進(jìn)行了研究。選取了13周和52周重復(fù)給藥毒性試驗(yàn)作為樣本���,因?yàn)檫@個(gè)階段已經(jīng)有了部分人體數(shù)據(jù)�,且Vehicle對(duì)照已經(jīng)基本確定。另外���,考慮到非人靈長(zhǎng)類(Non-human primates, NHP)的全球短缺���,關(guān)注度最高,主要收集的是非人靈長(zhǎng)類動(dòng)物的安全性數(shù)據(jù)����。調(diào)查之初,研究團(tuán)隊(duì)首先提出了3個(gè)問題:
1)NHP毒理試驗(yàn)中����,什么樣的毒理學(xué)終點(diǎn)只有在平行對(duì)照存在的情況才能評(píng)估�?
2)如果把平行對(duì)照數(shù)據(jù)從整體試驗(yàn)中移除,會(huì)出現(xiàn)什么樣的挑戰(zhàn)����?
3)如果不參照平行對(duì)照數(shù)據(jù),給藥組的數(shù)據(jù)應(yīng)該如何評(píng)估���?
帶著這3個(gè)問題�,研究團(tuán)隊(duì)從近3年在徠博科開展的20項(xiàng)NHP研究中收集數(shù)據(jù),并進(jìn)行了分析���。納入的毒理學(xué)參數(shù)包括:臨床觀察�、體重�、眼科檢查、體溫����、血壓、心電圖���、尿液分析����、血常規(guī)����、血生化���、凝血����、免疫細(xì)胞亞群、細(xì)胞因子/趨化因子�、T細(xì)胞依賴的抗體反應(yīng)(TDAR)、器官重量�、大體解剖觀察、組織病理學(xué)檢查等����。
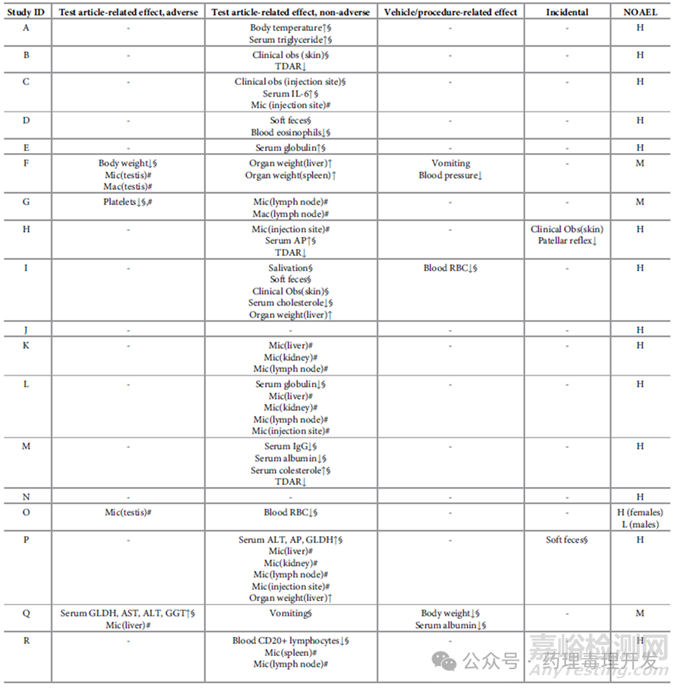
20項(xiàng)研究中,有2項(xiàng)未見任何毒理學(xué)異常發(fā)現(xiàn)�,予以剔除。剩余18項(xiàng)研究中�,有4項(xiàng)出現(xiàn)了供試品相關(guān)的不良反應(yīng),研究ID分別為F�、G、O�、Q,如下表所示���。
這些供試品相關(guān)的毒性發(fā)現(xiàn)最后均用于NOAEL的判定�,那么問題來了,如果不參照平行vehicle對(duì)照數(shù)據(jù)����,這些毒性表現(xiàn)可以發(fā)現(xiàn)嗎?
供試品相關(guān)的不良反應(yīng)
F試驗(yàn)����,高劑量3只動(dòng)物在給藥末期的體重與陰性對(duì)照相比,出現(xiàn)降低����。不過,如果與藥前值對(duì)比����,依然能確定這3只動(dòng)物體重降低。高劑量組雄性動(dòng)物大體解剖和病理學(xué)檢查發(fā)現(xiàn)睪丸異常���。這些異常通過歷史病理對(duì)照數(shù)據(jù),依然可以識(shí)別出來���。
G試驗(yàn)����,高劑量2只動(dòng)物與平行vehicle對(duì)照相比,出現(xiàn)血小板降低�。即使沒有平行對(duì)照,該結(jié)果依然可以通過與藥前值���、歷史對(duì)照數(shù)據(jù)對(duì)比發(fā)現(xiàn)���。
O試驗(yàn),中劑量和高劑量組動(dòng)物發(fā)現(xiàn)睪丸大體解剖和病理學(xué)檢查的異常����,其中高劑量的毒性反應(yīng)比之中劑量更為嚴(yán)重。不過���,即使沒有平行對(duì)照�,這些異常通過歷史病理對(duì)照數(shù)據(jù)也可以進(jìn)行判斷����。
Q試驗(yàn),與平行vehicle對(duì)照相比���,高劑量組動(dòng)物谷氨酸脫氫酶�、天冬氨酸氨基轉(zhuǎn)移酶,丙氨酸氨基轉(zhuǎn)移酶和γ-谷氨酰轉(zhuǎn)移酶升高�。即使沒有平行對(duì)照,以上毒理學(xué)發(fā)現(xiàn)���,依然可以通過藥前值和歷史對(duì)照數(shù)據(jù)識(shí)別出來���。而且,病理發(fā)現(xiàn)這些動(dòng)物同時(shí)伴有肝內(nèi)膽管肥大和增生�,也可以輔助判斷。
以上介紹了供試品相關(guān)的不良反應(yīng)�,再看下供試品相關(guān)的非不良反應(yīng)判定情況。
18項(xiàng)研究中����,如果不參照平行對(duì)照組數(shù)據(jù),大部分的非不良反應(yīng)依然可以檢出�。只有器官重量改變、TDAR是例外的����。
F試驗(yàn),高劑量組的肝臟���、脾臟重量與陰性對(duì)照相比是升高的���。不過,由于未在鏡檢中發(fā)現(xiàn)與器官重量增加相關(guān)的異常����,未被視為不良反應(yīng)。如果沒有平行陰性對(duì)照���,只能與歷史對(duì)照組數(shù)據(jù)比對(duì)����,但未獲得充分的器官重量歷史對(duì)照數(shù)據(jù)���。I和P研究中也遇到了同樣的問題����。
TDAR主要用于檢測(cè)免疫功能包括抗原攝取�、遞呈、輔助性T細(xì)胞功能�、B細(xì)胞激活和抗體產(chǎn)生。通過采用標(biāo)準(zhǔn)抗原如KLH進(jìn)行免疫���,然后檢測(cè)免疫球蛋白IgM����、IgG。B研究中�,與平行陰性對(duì)照相比,給藥組免疫后的IgG水平下降���,考慮到與供試品的作用機(jī)制相關(guān)�,未被定為不良反應(yīng)�。如果不參照平行對(duì)照數(shù)據(jù),TDAR的異常結(jié)果無法判定�。這點(diǎn)在H、M���、S研究中同樣存在����。
Vehicle或操作引起的毒性表現(xiàn)
F試驗(yàn)發(fā)現(xiàn)陰性對(duì)照3只雄性動(dòng)物�、中劑量1只雄性動(dòng)物、高劑量4雄3雌出現(xiàn)嘔吐�,考慮到平行陰性對(duì)照也有同樣發(fā)現(xiàn),嘔吐判定為vehicle相關(guān)的���。而嘔吐這類反應(yīng)是沒有歷史對(duì)照數(shù)據(jù)的�,如果沒有平行對(duì)照,本試驗(yàn)中的嘔吐原因是無法解釋的����。F試驗(yàn)還發(fā)現(xiàn)雄性動(dòng)物(包括陰性對(duì)照)收縮壓�、舒張壓和平均動(dòng)脈壓輕度降低,最后判定為頻繁操作引起����,動(dòng)物適應(yīng)操作后有所好轉(zhuǎn)。如果沒有平行對(duì)照�,這一心血管發(fā)現(xiàn)可能會(huì)歸類為供試品相關(guān)。
I試驗(yàn)發(fā)現(xiàn)紅細(xì)胞計(jì)數(shù)����、紅細(xì)胞壓積和血紅蛋白濃度下降,鑒于陰性組有同樣發(fā)現(xiàn)���,最后判定為毒代動(dòng)力學(xué)頻繁采血所致����。如果無平行對(duì)照����,很難定性這一異常與頻繁操作有關(guān)���。
Q試驗(yàn)中,幾乎所有的動(dòng)物(包括vehicle對(duì)照組)均出現(xiàn)體重降低���,4周后體重趨于穩(wěn)定����,并在隨后幾周體重恢復(fù)增長(zhǎng)�。最后將這一異常歸因于每天2次的頻繁操作導(dǎo)致的動(dòng)物應(yīng)激反應(yīng)。如果未設(shè)置vehicle對(duì)照組�,體重下降可能會(huì)被認(rèn)為與供試品相關(guān)。同理�,該試驗(yàn)中所有組動(dòng)物均出現(xiàn)白蛋白降低,也是需要借助平行陰性對(duì)照進(jìn)行析因���。
偶發(fā)毒性發(fā)現(xiàn)
有些毒性發(fā)現(xiàn)既不是vehicle相關(guān)的���,也不是頻繁的動(dòng)物操作所致。比如H試驗(yàn)可見動(dòng)物皮膚變色�,平行設(shè)置的vehicle對(duì)照組和給藥組均有發(fā)現(xiàn),故不認(rèn)為是供試品相關(guān)的���,因不影響動(dòng)物整體健康狀態(tài)����,具體發(fā)生原因也未做明確歸因。如果未設(shè)置vehicle對(duì)照�,這一結(jié)果的解釋就要困難很多。同理�,P試驗(yàn)中可見vehicle對(duì)照組和給藥組一過性軟便,也是需要參照vehicle數(shù)據(jù)查找原因���。
移除平行對(duì)照數(shù)據(jù)后的統(tǒng)計(jì)分析
雖然重復(fù)給藥的樣本量較小,對(duì)于一些程度較輕的毒性變化�,統(tǒng)計(jì)效力往往是不夠的。但無論ICH����,還是OECD相關(guān)指導(dǎo)原則,依然建議采用統(tǒng)計(jì)學(xué)方法進(jìn)行毒理學(xué)分析����。常用的統(tǒng)計(jì)方法是先進(jìn)行fix-effect ANOVA,再采用Dunnett’s test進(jìn)行組間成對(duì)分析�。假如去掉平行對(duì)照數(shù)據(jù)進(jìn)行統(tǒng)計(jì),比如與藥前值進(jìn)行對(duì)比�,則建議采用mixed-design ANOVA方法進(jìn)行統(tǒng)計(jì)。采用fix-effect ANOVA/Dunnett’s test統(tǒng)計(jì)發(fā)現(xiàn)的22個(gè)具有統(tǒng)計(jì)學(xué)差異的指標(biāo),82%可以通過mixed-design ANOVA檢出���,18%不能檢出的原因與指標(biāo)變化程度輕且伴隨個(gè)體間高度變異等有關(guān)���。
總結(jié)
1)供試品相關(guān)的不良反應(yīng):供試品相關(guān)的不良反應(yīng)對(duì)于NOAEL的確定非常關(guān)鍵。4項(xiàng)發(fā)現(xiàn)供試品相關(guān)不良反應(yīng)的研究中����,即使沒有平行陰性對(duì)照,通過藥前值或者歷史對(duì)照數(shù)據(jù)���,依然可以準(zhǔn)確獲得NOAEL����。
2)供試品相關(guān)的非不良反應(yīng):很多供試品相關(guān)的效應(yīng)是non-adverse的����,人體風(fēng)險(xiǎn)低,也不影響NOAEL的確定����。絕大多數(shù)的non-adverse反應(yīng)在沒有平行陰性對(duì)照的情況下,依然是可以檢出的����。當(dāng)然����,器官重量和TDAR例外����。
3)Vehicle或操作引起的異常發(fā)現(xiàn):很多動(dòng)物的指標(biāo)異常在vehicle對(duì)照可同時(shí)發(fā)現(xiàn),或與操作導(dǎo)致的動(dòng)物應(yīng)激反應(yīng)有關(guān)�,或與過度采血有關(guān),亦或者其它可能原因���。如果去掉對(duì)照組,對(duì)于這些反應(yīng)的歸因可能會(huì)存在挑戰(zhàn)�。不過,徠博科研究團(tuán)隊(duì)認(rèn)為����,這些異常情況并不罕見,已經(jīng)有足夠經(jīng)驗(yàn)幫助判斷����,即使沒有平行設(shè)置的陰性對(duì)照,也可以對(duì)Vehicle或操作引起的異常數(shù)據(jù)進(jìn)行解釋�。
4)偶發(fā)性毒性:其實(shí)����,平行設(shè)置陰性對(duì)照組最主要的一個(gè)原因是用于解釋一些不可控的偶發(fā)性的異常指標(biāo)���。比如文中提及的動(dòng)物皮膚異?;蛘哕洷闱闆r�。離開平行對(duì)照,這類終點(diǎn)的解讀會(huì)有些難度���。當(dāng)然���,徠博科團(tuán)隊(duì)依然認(rèn)為如果積累足夠多的歷史對(duì)照數(shù)據(jù),這些情況也是可以解決的���。
總之���,考慮到涉及NOAEL制定的供試品相關(guān)的不良反應(yīng)、絕大多數(shù)供試品相關(guān)的非不良反應(yīng)均可以通過虛擬對(duì)照達(dá)到目的���,徠博科這篇文章的結(jié)論是regulatory(sub)chronic NHP toxicity studies represent a good starting point to implement virtual control groups–rather than concurrent control groups—in nonclinical safety testing�,即采用虛擬對(duì)照對(duì)于NHP重復(fù)給藥毒性研究是可行的�。
當(dāng)然���,本文并不是鼓勵(lì)NHP一般毒理研究中不設(shè)置vehicle對(duì)照,相反���,這種方案設(shè)計(jì)����,個(gè)人理解�,幾乎百分百會(huì)被監(jiān)管機(jī)構(gòu)退回,起碼現(xiàn)階段應(yīng)該是這樣的���。
不過���,減少動(dòng)物的使用是大趨勢(shì),徠博科團(tuán)隊(duì)的這項(xiàng)前瞻性研究是很有意義的�,但這項(xiàng)結(jié)論成立是有前提的����。首先,樣本量太少����,僅回溯20項(xiàng)研究得出的結(jié)論有一定代表性���,但不一定絕對(duì)客觀,也不宜過度解讀���。其次����,即使這項(xiàng)結(jié)論客觀�,還是有一些毒性發(fā)現(xiàn)比如vehicle導(dǎo)致的,更別提很多新藥采用的vehicle溶媒并不普遍�,沒太多背景數(shù)據(jù)可參考。缺少平行陰性對(duì)照����,使得很多毒性終點(diǎn)的判定頗具挑戰(zhàn)。最后���,歷史對(duì)照數(shù)據(jù)是可以很大程度上作為虛擬對(duì)照數(shù)據(jù)����,用于彌補(bǔ)平行對(duì)照缺失引發(fā)的問題�,但這里面同樣有問題,一是國(guó)內(nèi)有多少機(jī)構(gòu)有歷史對(duì)照數(shù)據(jù)積累�,二是歷史對(duì)照數(shù)據(jù)是否可靠(對(duì)質(zhì)量體系的考驗(yàn))����,三是歷史對(duì)照數(shù)據(jù)是否足夠多(對(duì)項(xiàng)目數(shù)量的考驗(yàn))�,四是歷史對(duì)照數(shù)據(jù)是否全面,是否囊括了大部分毒理學(xué)指標(biāo)���。藥前值數(shù)據(jù)就更不必說了�,對(duì)于一次性的數(shù)據(jù)比如器官重量���、病理等的解釋是愛莫能助的����,還涉及一些統(tǒng)計(jì)效力問題�。
作為藥理毒理研究大軍的一份子,我們保留對(duì)現(xiàn)有監(jiān)管尺度和原則認(rèn)知的同時(shí)����,也需要捕捉國(guó)際同行對(duì)個(gè)別問題理解的變化。有挑戰(zhàn)并不可怕�,問題終究是用來解決的���,對(duì)歷史對(duì)照數(shù)據(jù)的充分重視其實(shí)就是個(gè)不錯(cuò)的起點(diǎn)�。