加拿大醫(yī)療器材2019年市場(chǎng)規(guī)模約68億美元��,于全球醫(yī)療器材市場(chǎng)排名第九��,在八大工業(yè)國(guó)中排名第四��,僅次于美國(guó)��、德國(guó)及法國(guó)��,在全球醫(yī)療器材市場(chǎng)上占有重要地位��。
根據(jù)加拿大統(tǒng)計(jì)局?jǐn)?shù)據(jù)顯示��,2020年加拿大醫(yī)療器材(含防疫用品)之進(jìn)口總額達(dá)130億2,301萬(wàn)美元��,較上年大幅成長(zhǎng)45.98%��;主要進(jìn)口來(lái)源國(guó)及占比依序?yàn)橹袊?guó)(32.81%)��、美國(guó)(32.64%)、墨西哥(5.27%)��、德國(guó)(4.10%)��、馬來(lái)西亞(2.71%)��、愛(ài)爾蘭(2.42%)��、日本(1.88%)、英國(guó)(1.43%)��、越南(1.26%)和新加坡(1.19%)��。根據(jù)中國(guó)海關(guān)總署進(jìn)出數(shù)據(jù)顯示��,截止2021年,中國(guó)出口海外的醫(yī)療器械總出口額為847.3億美元��,同比下降31.5%��。美國(guó)仍然是中國(guó)醫(yī)療器械的最大出口國(guó)��,中國(guó)出口美醫(yī)療器械總共211億美元��,占全球出口總額的24.9%��。其次出口金額最多的地區(qū)分別是德國(guó)��,英國(guó)��,日本��,中國(guó)香港��,荷蘭��,印度��,加拿大��,法國(guó)��。據(jù)易訊數(shù)據(jù)平臺(tái)的消息��,2023年全球醫(yī)療器械貿(mào)易涉及到:155 個(gè)目的國(guó)/地區(qū)��、167952 次交易次數(shù)��、8108個(gè)采購(gòu)商��、10123 個(gè)供應(yīng)商��。
加拿大按產(chǎn)品風(fēng)險(xiǎn)程度將醫(yī)療器械分為四個(gè)(I, II, III, IV)風(fēng)險(xiǎn)等級(jí),所有風(fēng)險(xiǎn)等級(jí)的醫(yī)療器械在加拿大銷(xiāo)售,都必須申請(qǐng)醫(yī)療器械營(yíng)業(yè)許可證Medical Device Establishment Licence(MDEL),而II類(lèi), III類(lèi)和IV類(lèi)的醫(yī)療器械則需要申請(qǐng)醫(yī)療器械注冊(cè)證New Medical Device Licence(NMDL), I類(lèi)的醫(yī)療器械豁免醫(yī)療器械注冊(cè)證��。
一 ��、醫(yī)療器械營(yíng)業(yè)許可證(MDEL)
1��、誰(shuí)需要申請(qǐng)MDEL?
根據(jù)加拿大法規(guī)要求��,向加拿大進(jìn)口醫(yī)療器械��,或在加拿大銷(xiāo)售醫(yī)療器械的公司都必須申請(qǐng)醫(yī)療器械營(yíng)業(yè)許可證(MDEL)��,
以下幾種情況可以豁免:
(1)零售商��,
(2)醫(yī)療保健單位��,
(3)在加拿大銷(xiāo)售自己名下取得醫(yī)療器械注冊(cè)證的II類(lèi), III類(lèi)和IV類(lèi)的醫(yī)療器械的制造商(注:如果是銷(xiāo)售別的公司名下取得醫(yī)療器械注冊(cè)證的II類(lèi), III類(lèi)和IV類(lèi)的醫(yī)療器械的制造商��,也必須申請(qǐng)MDEL��。
(4)I類(lèi)醫(yī)療器械的制造商通過(guò)持有醫(yī)療器械營(yíng)業(yè)許可證(MDEL)的公司在加拿大銷(xiāo)售醫(yī)療器械��,可以不用申請(qǐng)MDEL��。
申請(qǐng)者向加拿大監(jiān)管機(jī)構(gòu)提交 MDEL申請(qǐng)表格��,加拿大監(jiān)管機(jī)構(gòu)在約120天左右完成審核��,批復(fù)MDEL��。
2��、MDEL的有效期與年度許可證審查(ALR)
MDEL沒(méi)有注明有效期��,加拿大衛(wèi)生部每年 12 月將 ALR(年度許可證審查) 包發(fā)送給存檔的機(jī)構(gòu)聯(lián)系人,您必須盡快在每年的 4 月 1 日之前通過(guò)電子郵件發(fā)送您完成的 ALR申請(qǐng)包��,即使信息沒(méi)有更改��,并交付適用的申請(qǐng)費(fèi)用��,MDEL才能繼續(xù)有效��,否則MDEL會(huì)被取消��。MDEL被取消后��,在加拿大的器械銷(xiāo)售活動(dòng)則會(huì)被禁止��。MDEL被取消��,MDEL持有者必須重新申請(qǐng)并交費(fèi)��,才能重新取得新的MDEL��。
更改通知:
根據(jù)條例第48條��,當(dāng)更改許可證持有人的名稱(chēng)或地址,或更改聯(lián)系人的名字,職位,和電話(huà)號(hào)碼時(shí),許可證持有人須在15天內(nèi)通知加拿大衛(wèi)生部��。這些信息要發(fā)到加拿大衛(wèi)生部的MDEL負(fù)責(zé)部門(mén),之后,會(huì)發(fā)放一個(gè)更新的MDEL許可證;
3��、醫(yī)療器械合規(guī)周期和費(fèi)用
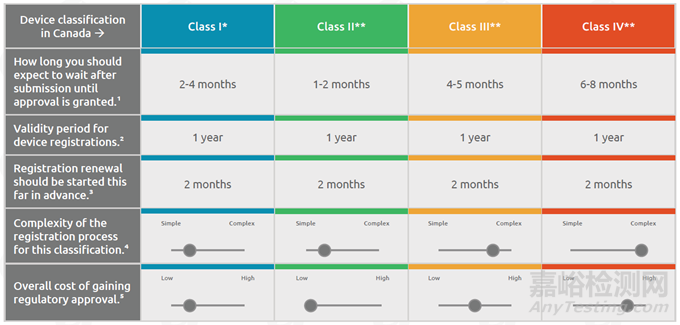
關(guān)于醫(yī)療器械企業(yè)需要出口到加拿大��,合規(guī)需要的周期��、費(fèi)用以及復(fù)雜程度的概況請(qǐng)見(jiàn)表��。
合規(guī)周期
收費(fèi)要求和收費(fèi)標(biāo)準(zhǔn):
新申請(qǐng)和年度審核申請(qǐng)都是要交費(fèi)的,而在這期間��,申請(qǐng)MDEL更改��,可以不用交費(fèi)的��。
對(duì)于新持有MDEL��,還沒(méi)超過(guò)一日歷年的MDEL持有者��,費(fèi)用可以延遲至第一日歷年年底��。
MDEL 的當(dāng)前費(fèi)用為 5,060 美元��。
如果您符合小型企業(yè)的資格��,您有資格獲得 25% 的費(fèi)用減免。目前注冊(cè)小型企業(yè)應(yīng)支付的費(fèi)用為 3,795 美元��。
小型企業(yè)的資格認(rèn)定標(biāo)準(zhǔn)是:
員工人數(shù)少于 100 人的任何企業(yè)��,包括其關(guān)聯(lián)公司��,或年總收入在 30,000 至 500 萬(wàn)加元之間��。申請(qǐng)人在提交 ALR 申請(qǐng)之前必須在加拿大衛(wèi)生部注冊(cè)為小型企業(yè)。您必須通過(guò)藥品和醫(yī)療器械小型企業(yè)申請(qǐng)門(mén)戶(hù)完成注冊(cè)��。
請(qǐng)注意��,公司的小型企業(yè)身份在注冊(cè)后 1 年到期��。
如果您之前在我們這里注冊(cè)為小型企業(yè)��,并且您仍然符合定義��,則在提交 ALR 申請(qǐng)之前��,您需要確保身份有效或更新��。
如果您的唯一標(biāo)識(shí)符自上次注冊(cè)以來(lái)發(fā)生了變化��,您還需要重新注冊(cè)��。
如果您在提交 2024 年 ALR 申請(qǐng)時(shí)不再持有小型企業(yè)身份��,我們將開(kāi)具全額費(fèi)用的發(fā)票��。
一旦開(kāi)具��,全額費(fèi)用金額的發(fā)票將不會(huì)被重新訪(fǎng)問(wèn)��。無(wú)論您的小型企業(yè)狀態(tài)未來(lái)發(fā)生任何變化,它仍將支付��。
請(qǐng)注意��,小企業(yè)注冊(cè)和續(xù)簽過(guò)程最多可能需要 2 周時(shí)間��。盡早開(kāi)始以確保在提交 ALR 申請(qǐng)之前完成它非常重要��。
4��、新醫(yī)療器械注冊(cè)New Medical Device Licence (NMDL)
按加拿大醫(yī)療器械法規(guī),II類(lèi), III類(lèi)和IV類(lèi)的醫(yī)療器械則需要申請(qǐng)醫(yī)療器械注冊(cè)證New Medical Device Licence(NMDL), I類(lèi)的醫(yī)療器械豁免醫(yī)療器械注冊(cè)證��。
其風(fēng)險(xiǎn)等級(jí)的劃分原則和方法類(lèi)似于歐盟CE認(rèn)證,都是根據(jù)產(chǎn)品的與人體接觸程度, 接觸時(shí)間,有源.無(wú)源等情況進(jìn)行分類(lèi).
新醫(yī)療器械注冊(cè)需要提供的資料根據(jù)產(chǎn)品風(fēng)險(xiǎn)等級(jí)不同,要求提供的資料也不同,II類(lèi)器械需要的資料相對(duì)簡(jiǎn)單��。
新醫(yī)療器械注冊(cè)需要提供質(zhì)量管理體系證書(shū),從2019年一月一日起,強(qiáng)制要求要有MDSAP證書(shū)��。
與醫(yī)療器械營(yíng)業(yè)許可證(MDEL)的申請(qǐng)一樣,新醫(yī)療器械注冊(cè)證(NMDL)的 申請(qǐng)是需要付費(fèi)和年費(fèi)的.費(fèi)用的交付也同樣樣是可以延期和減免的.費(fèi)用的減免額根據(jù)公司在過(guò)去一年里產(chǎn)品在加拿大銷(xiāo)售額來(lái)定��。
醫(yī)療器械注冊(cè)證也是需要年度收費(fèi)的, 每年8月份��,加拿大衛(wèi)生部會(huì)給持有II��,III��,IV類(lèi)產(chǎn)品注冊(cè)證的制造商發(fā)出年度注冊(cè)單證更新的通知和相 關(guān)資料.制造商要按照收到的通知和相關(guān)資料要求,繳費(fèi)和提交要求的資料.