摘要:分析蘭索拉唑腸溶制劑抽檢中溶出度異常產(chǎn)品的原因并提出改進建議��。按照法定標準對抽檢制劑進行檢驗,一批產(chǎn)品的溶出度低于限度�,其他項目均符合規(guī)定?�?紤]到本品對酸����、堿不穩(wěn)定,結(jié)合對生產(chǎn)企業(yè)飛行檢查的結(jié)論��,設計實驗考察該批次產(chǎn)品溶出度異常的原因�,包括高溫高濕環(huán)境對溶出度����、含量和有關物質(zhì)的影響��;2h 抗酸實驗對溶出度的影響�;利用激光紅外成像系統(tǒng)進行片芯成像及包衣層厚度測定����;有關物質(zhì)色譜條件優(yōu)化����;利用軌道阱高分辨質(zhì)譜進行雜質(zhì)來源分析等����。研究發(fā)現(xiàn)����,流通環(huán)節(jié)貯存不當和產(chǎn)品包衣工藝差是引起該批次溶出度低的原因�。流通環(huán)節(jié)可能出現(xiàn)的高溫高濕環(huán)境引起制劑中崩解劑功效下降�,主藥難以完全釋放����;包衣液不能均勻包裹于片芯��,引起隔離層薄且厚度不一��,繼而影響其保護主藥防止酸降解的效果����;兩者共同造成該批次產(chǎn)品溶出度偏低����。蘭索拉唑腸溶制劑總體質(zhì)量較好�,但部分企業(yè)處方和工藝需要優(yōu)化;流通環(huán)節(jié)需要嚴格按照規(guī)定控制溫濕度����。
蘭索拉唑是日本武田制藥株式會社研制的質(zhì)子泵抑制藥,其抑制胃酸分泌作用及抗幽門螺旋桿菌作用較強��,在治療消化性潰瘍疾病方面具有顯著療效�。從國家藥品不良反應監(jiān)測系統(tǒng)數(shù)據(jù)庫中查詢到蘭索拉唑腸溶片和腸溶膠囊存在皮疹����、瘙癢、肝功能異常�、過敏性休克����、血小板減少等不良反應。目前蘭索拉唑腸溶片收載于《中華人民共和國藥典》(以下簡稱《中國藥典》)和《英國藥典》�,蘭索拉唑腸溶膠囊收載于《中國藥典》��、《美國藥典》、《日本藥典》和《英國藥典》�。天津武田和日本武田的蘭索拉唑腸溶膠囊均為國家藥品監(jiān)督管理局公布的參比制劑�,本研究以天津武田生產(chǎn)的腸溶膠囊為原研制劑進行相關研究工作��。
根據(jù)法定標準對在全國范圍內(nèi)抽取的蘭索拉唑腸溶片和腸溶膠囊進行檢驗�,發(fā)現(xiàn)H企業(yè)一批樣品在pH6.8 磷酸鹽緩沖液中的溶出度低于限度,其他項目均符合標準規(guī)定����。根據(jù)能量守恒原則,推測企業(yè)存在低限投料的可能��,或者有其他降解產(chǎn)物在法定檢驗中未檢出。結(jié)合H局對H企業(yè)飛行檢查的結(jié)論,在探索性研究過程中,采用激光紅外成像技術(shù)考察該企業(yè)不同批次產(chǎn)品片芯及包衣噴涂的均勻性����,利用正交分析技術(shù)優(yōu)化現(xiàn)行藥典方法中有關物質(zhì)的色譜條件,結(jié)合LC-Orbitrap/HRMS 及多中心切割2D-LC-HRMS 技術(shù),對本品雜質(zhì)來源進行系統(tǒng)歸屬,最終認為流通環(huán)節(jié)貯存不當和產(chǎn)品包衣工藝差是導致該批次產(chǎn)品在pH6.8磷酸鹽緩沖液中溶出度偏低的原因,本研究工作可以較好地推進本品仿制藥一致性評價的進程。
1�、 材 料
1.1 藥品與試劑
蘭索拉唑(批號100709-201705�,含量99.6%)��、蘭索拉唑雜質(zhì)Ⅰ(批號510046-201401)����、蘭索拉唑雜質(zhì)Ⅱ(批號 510047-201401)����、蘭索拉唑雜質(zhì)Ⅲ(批號510048-201401)��、蘭索拉唑雜質(zhì)Ⅳ(批號510049-201401)(中國食品藥品檢定研究院);蘭索拉唑雜質(zhì)C(批號S17041902,含量99.94%)、蘭索拉唑雜質(zhì)F(批號S17110601,含量99.3%)(江蘇奧賽康藥業(yè)有限公司);蘭索拉唑腸溶片和蘭索拉唑腸溶膠囊為抽樣樣品��。乙腈、三乙胺(德國默克公司)��;甲酸��、甲醇(美國賽默飛世爾公司)�;其他試劑均為市售分析純。
1.2 儀 器
LC-20AB 高效液相色譜儀��、UV-2600 紫外分光光度計(日本島津公司)����;1260 Infinity Ⅱ高效液相色譜儀、708-DS 溶出儀、850-DS 溶出自動取樣器����、8700 LDIR 激光紅外成像系統(tǒng)(美國安捷倫公司);Ultimate 3000-QExactive Orbitrap 液質(zhì)聯(lián)用(美國賽默飛世爾公司)��。
2����、 方 法
2.1 法定檢驗方法
本次抽樣的蘭索拉唑腸溶片法定標準主要為《中國藥典》2015年版二部;蘭索拉唑腸溶膠囊法定標準主要為《中國藥典》2015年版第一增補本����,少數(shù)樣品執(zhí)行國家藥品監(jiān)督管理局標準。
2.2 探索性研究方法
對蘭索拉唑腸溶片溶出度異常產(chǎn)品的原因進行了不同層面的探究��,包括高溫高濕環(huán)境對該品種溶出度�、含量和有關物質(zhì)結(jié)果的影響;2 h抗酸實驗對溶出度結(jié)果的影響�;利用激光紅外成像系統(tǒng)對溶出度異常批次樣品進行片芯成像以及包衣層厚度的測定�;優(yōu)化有關物質(zhì)色譜條件以分離出更多雜質(zhì)����;對該批次產(chǎn)品中的雜質(zhì)進行來源分析等。
3�、 法定檢驗結(jié)果與討論
在法定檢驗中發(fā)現(xiàn)H企業(yè)一批產(chǎn)品溶出度低于限度要求,該批次為本研究的重點����。通過調(diào)研����,H企業(yè)生產(chǎn)的190301批次蘭索拉唑腸溶片于2019年4月26日生產(chǎn)入庫,后分別于2019年5月14日�、5月26日分兩次發(fā)往J企業(yè),2019 年 6 月28日由J企業(yè)發(fā)往Y公司��,再由Y公司分銷1件(300 盒)產(chǎn)品至 S 公司�,即本次檢驗溶出度異常產(chǎn)品的抽樣場所。
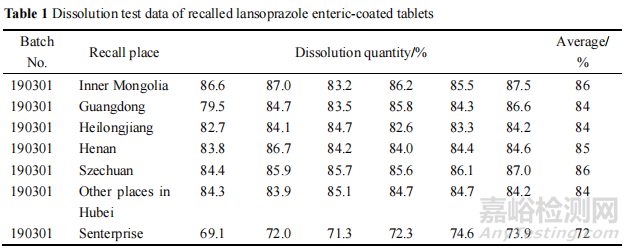
本次法檢報告公示之后��,H 企業(yè)迅速展開該批次產(chǎn)品的召回工作��,并將從全國各地召回的產(chǎn)品送至 H 省院進行檢驗�,結(jié)果見表 1����,可知該批次從其他省市召回的產(chǎn)品溶出度項目均合格��,從 S 藥業(yè)召回的產(chǎn)品溶出度項目仍然低于限度(限度為 80%)�,結(jié)果比本次檢測結(jié)果更低��。H局對 H 企業(yè)進行了飛行檢查��,調(diào)查其批生產(chǎn)記錄等資料����,均未發(fā)現(xiàn)重大問題,初步認為市場貯存不當是導致產(chǎn)品不合格的主要原因�,市場貯存中未達到規(guī)定的遮光,密封�,置陰涼(不超過 20 ℃)干燥處保存的要求,因而對溶出度的結(jié)果造成了影響����。
4、 探索性研究結(jié)果與討論
4.1 高溫高濕環(huán)境條件對產(chǎn)品關鍵質(zhì)量屬性的影響
為了確證 H 局的調(diào)查結(jié)果����,本研究考察了高溫高濕條件對產(chǎn)品關鍵質(zhì)量屬性的影響�,將原研制劑和 H 企業(yè)的一批次產(chǎn)品在高溫高濕即溫度 40 ℃��、相對濕度 75%(RH 75%)的貯存條件下放置5天后�,采用法定檢驗的標準檢查溶出度、含量和有關物質(zhì)����,并與放置在規(guī)定的陰涼(不超過20 ℃)干燥貯存條件下的同批次樣品檢驗結(jié)果進行比較。結(jié)果見表2—4��。



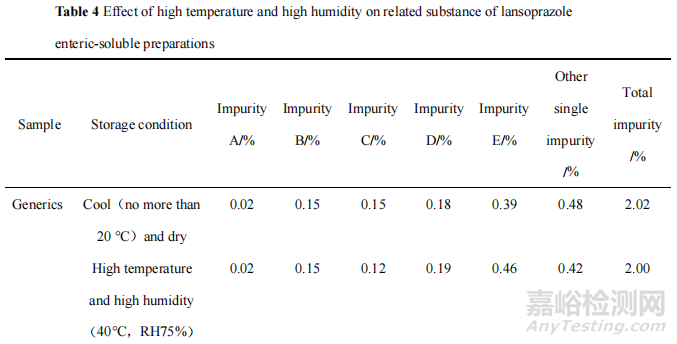

數(shù)據(jù)表明��,在高溫(40 ℃)和高濕(RH 75%)環(huán)境中放置后����,蘭索拉唑腸溶片溶出度明顯降低����,含量和有關物質(zhì)卻無顯著變化。推測在高溫高濕環(huán)境中����,水分會引起片芯中的崩解劑膨脹,因而在溶出度試驗中��,崩解劑功效下降,造成溶出度結(jié)果偏低����。這進一步證明市場貯存不當可能是導致該產(chǎn)品溶出度異常的原因之一。
4.2 產(chǎn)品包衣層工藝對溶出度結(jié)果的影響
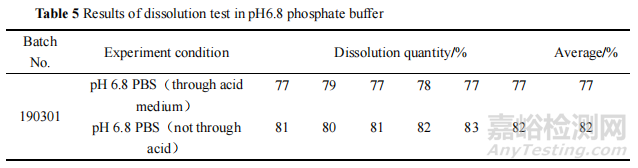
對該批次樣品在酸介質(zhì)中的溶出量進行檢測��,發(fā)現(xiàn)其在酸介質(zhì)中經(jīng) 2 h 始終未溶出��,性狀也無明顯變化��。將該批次腸溶片直接置于 pH 6.8 磷酸鹽緩沖液中進行溶出度試驗�,結(jié)果該批次樣品的溶出度結(jié)果符合標準規(guī)定。表明該批次樣品雖然沒有在酸介質(zhì)中溶出����,但是法定檢驗方法中前期抗酸 2 h 的步驟對最終的溶出度結(jié)果有影響,提示本品包衣層存在缺陷�。結(jié)果見表 5。
通過 8700 LDIR 激光紅外成像系統(tǒng)對該批次樣品切片后的片芯進行成像��,并與輔料單組分成像結(jié)果進行比較�。結(jié)果顯示片芯中含有蘭索拉唑、甘露醇��、低取代羥丙甲纖維素、碳酸氫鈉和羧甲淀粉鈉��,與廠家提供的處方一致����。并將激光紅外成像結(jié)果計算得到的各組分平均面積占比與廠家提供的處方含量進行對比,兩者有輕微差異�,這可能由于得到的切片不是最中間面導致的,說明企業(yè)在生產(chǎn)過程中確實按處方投料����。
再通過 8700 LDIR 激光紅外成像系統(tǒng),利用隔離層和腸溶層特征峰的不同對包衣進行成像����,成像后利用軟件標尺測量隔離層包衣與腸溶層包衣厚度的方法,測定本次抽到的 H企業(yè)不同批次樣品的包衣厚度��。
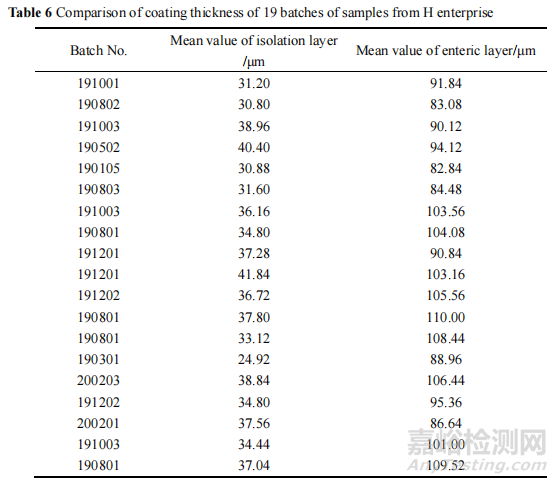
結(jié)果顯示該批次(190301)的隔離層是所有樣品中最薄的�,平均厚度僅為24.92 μm��,其他批次樣品隔離層平均厚度在 30.80~41.84 μm 之間�。各批次樣品的腸溶層平均厚度在82.84~110.00μm 之間,測定結(jié)果見表 6�。
此外,在成像圖發(fā)現(xiàn) 190301 批樣品的隔離層厚度不均一,部分偏薄����,部分偏厚,且個別地方存在隔離層斷層現(xiàn)象����,其厚度及完整性均較差。調(diào)研得知�,隔離層在該制劑中具有兩個主要作用:一是隔離主藥與腸溶衣層防止直接接觸引起主藥降解;二是修飾片芯邊角��,提高腸溶性能��。推測隔離層的厚薄不一易引起主藥遇酸降解��,導致溶出度下降��。另一方面�,由于隔離層薄,溶出度試驗中的鹽酸溶液會滲透進片芯����,造成片芯中的崩解劑迅速膨脹,再轉(zhuǎn)移至 pH 6.8 磷酸鹽緩沖液后�,崩解劑的崩解效果大打折扣,導致主藥釋放不完全,引起溶出度下降����。綜上所述,隔離層薄引起酸降解和崩解劑效果差可能是導致該產(chǎn)品溶出度不合格的另一個因素����。
4.3 利用多中心切割 2D-LC-HRMS 和 LC-Orbitrap/HRMS 技術(shù)對溶出度不合格批次降解情況的探索
根據(jù)上述研究中的推測,該批次產(chǎn)品的主藥應該有降解�,且為酸降解,非高溫高濕降解�。但在法檢中,該批次的含量和有關物質(zhì)均符合標準規(guī)定����。最大單雜含量為 0.4%(限度為0.5%),總雜含量為 0.8%(限度為 2.0%)��,為了進一步探究該產(chǎn)品的降解情況�,我們做了以下探索性研究。
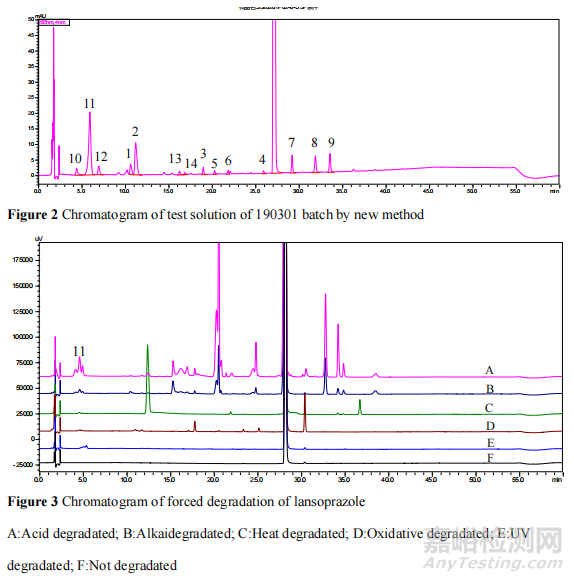
4.3.1 基于 2D-LC-HRMS 對蘭索拉唑腸溶片中法檢發(fā)現(xiàn)的主要雜質(zhì)進行研究采用ThermoUltimate 液相與 Thermo Q-ExativeOrbitrap 質(zhì)譜聯(lián)用技術(shù)�,一維色譜條件同《中國藥典》有關物質(zhì)項下方法,二維色譜條件采用 0.1%甲酸水-乙腈為流動相�,梯度洗脫��。按照《中國藥典》規(guī)定,相對保留時間 0.25 之前的色譜峰忽略不計����,結(jié)果顯示,總計得到 9 個雜質(zhì)�,編號為 1~9,其中峰 1 在該色譜條件下的紫外譜圖中未能完全分離��,但質(zhì)譜提取離子流圖可以實現(xiàn)有效分離����,故標記為雜質(zhì) 1 和 2,詳見圖 1����。通過與已知雜質(zhì)的保留時間和質(zhì)譜數(shù)據(jù)比較,歸屬了 5 個色譜峰為已有對照品的已知雜質(zhì)�,分別為歐洲藥典雜質(zhì) D、E����、A、B�、C,在圖中色譜峰編號依次為 1�、2����、6����、7、9��,剩下的未知雜質(zhì)為 3��、4����、5、8�。

4.3.2 有關物質(zhì)色譜條件的優(yōu)化根據(jù)上述研究結(jié)果可知,《中國藥典》的方法無法分離雜質(zhì) D和 E�,且規(guī)定相對保留時間 0.25 之前的色譜峰忽略不計,對本次抽檢的 H 企業(yè)所有樣品的色譜圖進行對比����,發(fā)現(xiàn)相對保留時間 0.25 之前的色譜峰并完全不一致,其中 190301 批的色譜峰明顯大于其他批次����,推測有部分降解產(chǎn)物隨輔料峰一并在相對保留時間0.25之前流出����。因此我們通過正交設計優(yōu)化了有關物質(zhì)測定方法����,并對溶出度異常樣品進行了測定�。結(jié)果顯示,優(yōu)化后的方法將《中國藥典》中未能分開的雜質(zhì) D 和雜質(zhì) E 分開了����,而且無論是檢出雜質(zhì)個數(shù)還是雜質(zhì)總量都明顯大于《中國藥典》方法。溶出度異常批次的總雜�,從 0.84%變成 4.84%,最大單雜從 0.35%變成2.14%����,色譜圖見圖 3,結(jié)果證實有降解雜質(zhì)未被發(fā)現(xiàn)����。
4.3.3 基于 LC-Orbitrap/HRMS 對二維質(zhì)譜系統(tǒng)中未檢出雜質(zhì)進行研究在“4.3.2”優(yōu)化后的有關物質(zhì)方法基礎上,采用高效液相色譜——高分辨軌道阱質(zhì)譜聯(lián)用(LC-Orbitrap/HRMS)技術(shù)��,建立了兼容質(zhì)譜檢測器的檢測方法����。一共檢出雜質(zhì) 14 個�,其中 5 個為歐洲藥典雜質(zhì)D�、E、A��、B��、C����;9 個為未知雜質(zhì),未知雜質(zhì)中 4 個與利用 2D-LC-HRMS 技術(shù)檢出的結(jié)果一致�,5 個為該條件下新檢出雜質(zhì)(命名為雜質(zhì) 10-14)。根據(jù)蘭索拉唑原料強制降解實驗結(jié)果��,原料藥合成工藝以及文獻資料[1-5]��,對雜質(zhì)來源進行分析����。發(fā)現(xiàn) H 企業(yè)溶出度不合格產(chǎn)品中新出現(xiàn)的最大單雜(雜質(zhì) 11)為酸降解雜質(zhì),詳見圖 2 和圖 3��。該結(jié)果進一步證實了我們對隔離層薄引起酸降解的推測��。
5、 小 結(jié)
本次研究采用激光紅外成像技術(shù)��、多中心切割 2D-LC-HRMS 等技術(shù)�,結(jié)合異常批次樣品的自身特性以及調(diào)研結(jié)果,從不同維度設計試驗����,解析溶出度偏低的原因�,包括外部環(huán)境因素以及產(chǎn)品自身問題。對于研究中得出的導致隔離層薄的原因����,是隔離層噴霧工藝參數(shù)設置不佳或是隔離層材料選擇不優(yōu)造成,目前還未能得出結(jié)論��。由于蘭索拉唑腸溶片目前未有通過仿制藥質(zhì)量和療效一致性評價的產(chǎn)品����,可見該品種在研發(fā)中對輔料和工藝的篩選是具有挑戰(zhàn)和技術(shù)難度的。
因目前的檢驗方法未能很好地分離和檢出部分雜質(zhì)�,后通過正交設計優(yōu)化的有關物質(zhì)方法證實了該產(chǎn)品主藥有酸降解的現(xiàn)象,更加互補驗證了該批次產(chǎn)品隔離層薄�,引起了主藥降解的情況。雖然本次研究發(fā)現(xiàn)的問題無致命安全隱患����,但也存在一定的風險����,因此建議提高該品種標準����,主要是有關物質(zhì)方法,上報藥典會����;同時建議經(jīng)營企業(yè)在藥品流通過程中嚴格按照藥品規(guī)定的儲存條件進行;建議生產(chǎn)企業(yè)對影響本產(chǎn)品質(zhì)量的因素如投料量�、包衣工藝、包衣材料選擇等進一步深入研究��,嚴把原料��、生產(chǎn)工藝關��,特別是改進不合理的工藝參數(shù)�。
產(chǎn)品質(zhì)量是仿制藥一致性評價的核心,仿制藥的質(zhì)量應與原研藥在成分�、藥效、安全性、穩(wěn)定性等方面保持一致��,以確?���;颊呤褂梅轮扑幠軌颢@得與原研藥相同的療效和安全性。為了保證藥品質(zhì)量和穩(wěn)定性��,仿制藥的生產(chǎn)工藝應與原研藥相似��,否則可能因為工藝差異影響藥物療效和安全����。本研究采用了多種技術(shù)開展研究工作��,可以較好地推進本品仿制藥質(zhì)量和療效一致性評價的進程��。多中心切割 2D-LC-HRMS 技術(shù)在藥物雜質(zhì)譜研究中已經(jīng)得到了廣泛應用�,在評價仿制藥質(zhì)量中正發(fā)揮著重要作用。另一項關鍵技術(shù)——激光紅外成像技術(shù)可以協(xié)助進行處方分析��,對不同來源的輔料也具有一定區(qū)分能力��,其在仿制藥一致性評價中的應用將大為可觀��。采用多種技術(shù)從不同維度對仿制藥的產(chǎn)品質(zhì)量、處方工藝等進行深入研究�,可以全面分析對比仿制藥和原研藥的質(zhì)量屬性,找到影響產(chǎn)品質(zhì)量的主要參數(shù)��,改進仿制藥生產(chǎn)工藝�。
參考文獻: