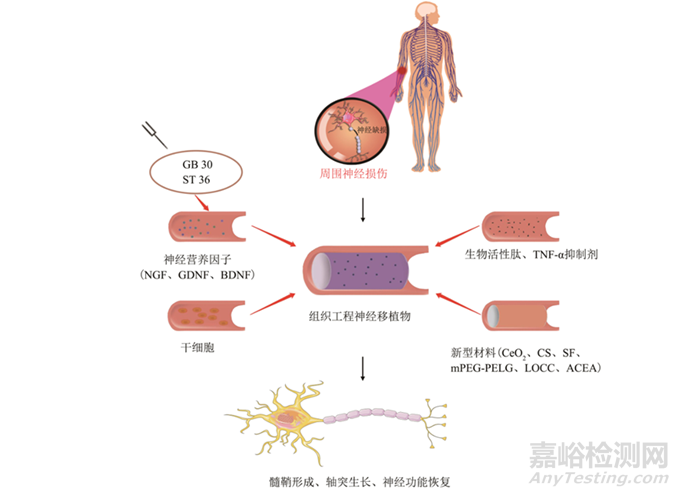
外周神經(jīng)損傷修復的技術(shù)路線
外周神經(jīng)損傷發(fā)生后����,軸突具有一定的再生能力����,通過特定的方法使受損神經(jīng)與遠端組織重新建立突觸聯(lián)系�,并提供適當?shù)姆椒ù龠M軸突再生從而加速其修復。外周神經(jīng)系統(tǒng)修復的方法很多�����,目前主要有外科治療��,包括常規(guī)縫合�����、神經(jīng)移植�、神經(jīng)移位等;非外科輔助治療����,包括干細胞移植�、神經(jīng)營養(yǎng)因子(neurotrophin,NT)�、新型材料����、生物電刺激等����,如圖所示。
圖 周圍神經(jīng)損傷后再生與修復的潛在方法1
(1)常規(guī)縫合
周圍神經(jīng)損傷后�����,在沒有神經(jīng)缺損的情況下可以通過顯微外科手術(shù)進行神經(jīng)外膜縫合/束膜縫合�,這也是無缺損情況下的首選治療方案。
目前常用的神經(jīng)縫合方式是神經(jīng)外膜縫合和神經(jīng)束膜縫合2����,在此基礎(chǔ)上形成了神經(jīng)外膜 + 束膜縫合法。不同縫合方式的選擇需要根據(jù)神經(jīng)損傷的部位�、時間、有無神經(jīng)缺損的情況綜合考慮����,以達到最佳的治療效果,從而改善患者的預后����。
① 神經(jīng)兩端應(yīng)于無張力下縫合����,在有張力下縫合神經(jīng)是危險的����,因為在有張力下縫合神經(jīng)外膜易造成縫合口處形成空隙,瘢痕形成����,影響神經(jīng)再生?���;蛲饽け凰浩疲窠?jīng)束散開����,再生神經(jīng)易穿越縫合口裂隙,形成膨大的假性神經(jīng)瘤�����,此外在有張力的情況下縫合神經(jīng)����,將影響神經(jīng)的血液循環(huán),如圖所示���。
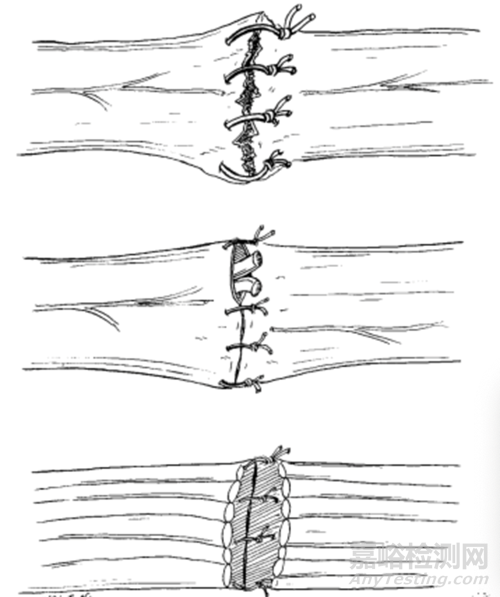
圖 神經(jīng)縫合常見的錯誤(上:神經(jīng)對合粗糙�,縫線過粗����;中:神經(jīng)外膜上的血管未精確對合,神經(jīng)束外露���;下:神經(jīng)在有張力下縫合神經(jīng)外膜���,其內(nèi)的神經(jīng)束向兩端回縮,神經(jīng)斷端間形成問隙)
② 減少神經(jīng)斷端的縫線����,神經(jīng)縫線過多將引起異物反應(yīng),使瘢痕組織增生�,縫合的要求以神經(jīng)或神經(jīng)束對合良好為準,不應(yīng)過密�����。
③ 神經(jīng)縫合需處置于血液循環(huán)良好的軟組織基床中,尤其是長段神經(jīng)處于游離狀態(tài)作縫合或進行游離神經(jīng)移植����,神經(jīng)的血液來源依賴于周圍軟組織基床,小部分來源于兩端神經(jīng)組織�。
(4)精確對合神經(jīng)束,縫合時損傷神經(jīng)的近遠端神經(jīng)束�,必需做到精確對合,才能保證近端的神經(jīng)纖維有效地�、數(shù)目盡可能多地向遠端神經(jīng)內(nèi)膜管生長。由于神經(jīng)下內(nèi)的支持組織占神經(jīng)干截面30%~70%���,只有神經(jīng)束的精確對合才能保證這一點��。
(2)神經(jīng)移植
當周圍神經(jīng)損傷后存在缺損���,不能實現(xiàn)無張力縫合,因此可選擇神經(jīng)移植的方法����,神經(jīng)移植術(shù)包括自體神經(jīng)移植術(shù)、異體神經(jīng)移植術(shù)【有文獻提到510(k)一般5cm以上的神經(jīng)缺損會選擇自體神經(jīng)移植】���。
自體神經(jīng)移植是治療周圍神經(jīng)長段缺損的首選方法�,其主要是以感覺和運動相對次要的周圍神經(jīng)為原料,切取并移植到神經(jīng)缺損處行斷端吻合修復周圍神經(jīng)缺損��。但是在實際操作過程中�,自體神經(jīng)移植面臨諸多問題,如自體神經(jīng)移植體來源極少�����,無法滿足長段神經(jīng)缺損的需求����,并且所切取的神經(jīng)多為感覺神經(jīng)��,很難與修復神經(jīng)內(nèi)部結(jié)構(gòu)相匹配�����,極易引發(fā)供體區(qū)神經(jīng)瘤的形成和感覺����、運動功能的喪失;同時由于存在 2 個吻合口�,進一步增加了神經(jīng)再生的難度,影響神經(jīng)功能的恢復3����。
異體神經(jīng)移植相比于自體神經(jīng)移植來講具有神經(jīng)來源充足這一最大的優(yōu)勢����,但如何抑制移植后的免疫排斥反應(yīng)是其面臨的最大的問題���,研究證明引起免疫排斥反應(yīng)的主要物質(zhì)是施旺細胞和髓鞘成分�����,為了去除這些物質(zhì)減少免疫排斥反應(yīng)�,最經(jīng)典的方法是化學去細胞法��,有實驗表明此法可以將許旺細胞和髓鞘成分全部清除����,達到降低異體移植神經(jīng)引起免疫排斥反應(yīng)的目的。通過化學去細胞可以明顯降低其抗原性�,但是仍然保留引導神經(jīng)再生的功能,臨床應(yīng)用較多�,效果良好。
(3)人工神經(jīng)導管4
人工神經(jīng)導管是目前常見的治療方案�����,其作為軸突引導通道,可以連接被切斷的神經(jīng)的間隙��,以促進神經(jīng)元的重新連接�。此外,神經(jīng)導管可以作為外部環(huán)境的物理屏障和再生軸突穿過間隙損傷的物理引導�,同時還能夠保留受損神經(jīng)殘端分泌的自然釋放的神經(jīng)生長因子,并減少瘢痕組織形成成纖維細胞對損傷部位的侵襲����。
人工神經(jīng)導管其在材料上需要滿足以下要求:①滲透性�����,在導管血管化之前��,營養(yǎng)物質(zhì)和氧氣需要擴散到周圍神經(jīng)損傷后修復部位來確保支持細胞的活性����;②相容性,人工神經(jīng)導管應(yīng)具有良好的組織相容性�����,避免對周圍組織和軸突再生造成機械損傷��;③腫脹,局部腫脹可能會阻塞管道�,阻礙管道內(nèi)的神經(jīng)再生,或者直接損傷管道中再生的神經(jīng)�����;④降解性��,理想的人工神經(jīng)導管應(yīng)該在軸突從殘端通過間隙重新支配遠端神經(jīng)通路前保持完整�����,然后逐漸降解�����,如果降解速度太快�,可能會導致腫脹和局部炎癥;如果降解速度太慢�,導管可能會壓迫神經(jīng),導致慢性免疫排斥反應(yīng)��。
(4)干細胞移植5
誘導外源干細胞分化為施萬細胞或施萬細胞的前體細胞6���,加速髓鞘重建��,同時這些細胞可釋放多種神經(jīng)營養(yǎng)因子�,促進軸突延伸,提高髓鞘形成和神經(jīng)的存活�。如有研究將牙髓干細胞( dental pulp stem cells,DPSCs)分化的神經(jīng)譜系細胞(neural lineage cells��,NLCs)移植到具有10 mm坐骨神經(jīng)缺損的免疫缺陷大鼠模型中��,移植2周后�����,NLCs分化成類施萬細胞����,移植12周后類施萬細胞存活����,軸突生長、髓鞘重新形成��、神經(jīng)電生理活性增強��、腓腸肌萎縮改善��。
(5)神經(jīng)營養(yǎng)因子(neurotrophin,NT)
神經(jīng)營養(yǎng)因子在促進周圍神經(jīng)損傷的修復中起了積極的作用�,其聯(lián)合干細胞比單獨干細胞更有利于周圍神經(jīng)再生和功能恢復。常見的神經(jīng)因子包括神經(jīng)生長一因子�、膠質(zhì)細胞源性神經(jīng)營養(yǎng)因子、腦源性神經(jīng)營養(yǎng)因子等���。
神經(jīng)生長因子(nerve growth factor�,NGF)能刺激神經(jīng)再生��,它是神經(jīng)元分化����、促進突起生長和突觸連接的關(guān)鍵調(diào)節(jié)因子;
膠質(zhì)細胞源性神經(jīng)營養(yǎng)因子(glial cell line-derived neurotrophic factor��,GDNF)能夠促進神經(jīng)的修復���;
腦源性神經(jīng)營養(yǎng)因子(brain-derived neurotrophic factor�,BDNF)是神經(jīng)系統(tǒng)發(fā)育所需的營養(yǎng)因子��,在自然發(fā)生的細胞死亡期間����,缺乏BDNF營養(yǎng)支持的神經(jīng)元就會丟失7�����。
參考文獻:
[1] 肖雨,翁秋燕,邵磊,等.周圍神經(jīng)損傷后再生與修復機制研究進展[J].生物化學與生物物理進展, 2022(007):049.
[2] KUBOTA S, NISHIURA Y, HARA Y, et al.Functional and morphological effects of indirect gradual elongation of peripheral nerve: clcctrophysiological and morphological changes at different elongation rate. Hand Surg. 2011;16(2): 105-111.
[3] DIESNER SB, RHIEM K, STEWEN K, et al. Peripheral nerve regeneration across 14-mm gaps: a comparison of autograft and entubulation repair methods in the rat. J Reconstr Microsur. 1993;9(05):349-358.
[4] 資料來源:中國骨與關(guān)節(jié)損傷雜志2021年3月第36卷第3期�、醫(yī)脈通
[5] 肖雨,翁秋燕,邵磊,薛陽,吳璨,郭蕾,牛艷芳,鮑曉明,徐淑君.周圍神經(jīng)損傷后再生與修復機制研究進展[J].生物化學與生物物理進展,2022,49(7):1243-1250
[6] Ramachandran S, Midha R. Recent advances in nerve repair[J]. Neurol India, 2019, 67(Supplement): S106-S114
[7] de León A, Gibon J, Barker PA. NGF-dependent and BDNF-dependent DRG sensory neurons deploy distinct degenerative signaling mechanisms. eNeuro, 2021, 8(1): ENEURO.0277-20.2020