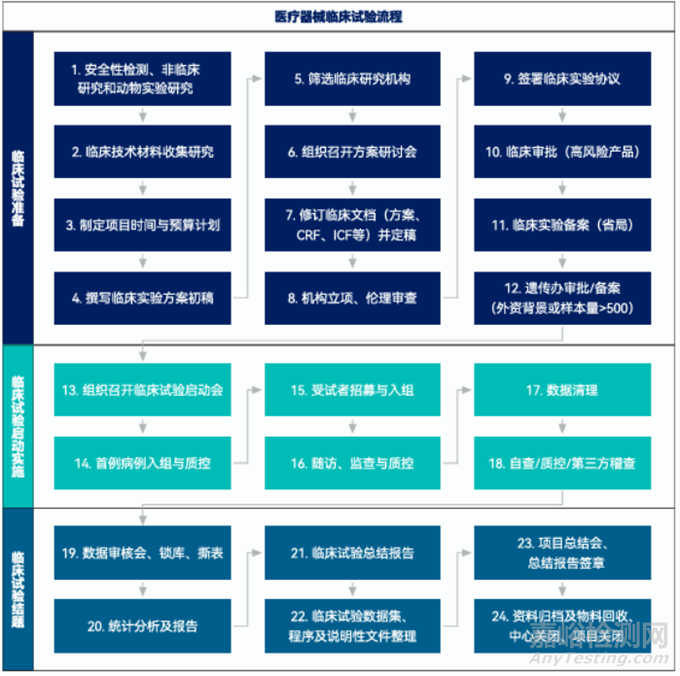
醫(yī)療器械臨床試驗是基于“醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范”(行業(yè)也稱醫(yī)療器械GCP)及相關法規(guī)開展的以驗證醫(yī)療器械產(chǎn)品的安全性和有效性的研究活動。醫(yī)療器械臨床試驗主要包括臨床試驗準備階段�����、臨床試驗實施階段和臨床試驗結(jié)題階段三個階段�����,本文從醫(yī)療器械臨床試驗流程中各節(jié)點主要工作進行了解析���。
階段一��、臨床試驗準備
1.醫(yī)療器械臨床前安全性驗證
醫(yī)療器械臨床試驗前需先通過安全性驗證��,包括產(chǎn)品檢測���、動物實驗及其它非臨床研究���。
2.臨床技術資料收集研究
3.制定項目時間和預算計劃
4.撰寫臨床試驗方案初稿
5.臨床試驗機構篩選
醫(yī)療器械臨床試驗應在已備案的醫(yī)療器械臨床試驗機構中開展。
6.組織召開方案研討會
7.修訂臨床文檔(方案���、CRF��、ICF���、IB等)并定稿
8.立項和倫理審查
9.與臨床試驗機構簽署臨床研究協(xié)議
10.涉及高風險醫(yī)療器械,臨床試驗前應申請臨床試驗審批
11.省局備案臨床試驗
12.涉及外資背景的申辦方或CRO或樣本量大于500的還應申請人類遺傳資源備案或?qū)徟?/span>
階段二:臨床試驗啟動實施
13.組織召開臨床試驗啟動會
14.首例入組并完成質(zhì)控
15.受試者招募與入組
16.隨訪���、監(jiān)查與質(zhì)控
17.入組結(jié)束��,數(shù)據(jù)清理
18.數(shù)據(jù)自查��、質(zhì)控或第三方稽查
階段三:臨床試驗結(jié)題歸檔
19.數(shù)據(jù)審核��、鎖庫��,必要時召開數(shù)據(jù)審核會
20.統(tǒng)計分析及報告
21.臨床試驗小結(jié)及總結(jié)報告
22.臨床試驗遞交數(shù)據(jù)整理�����,包括原始數(shù)據(jù)集���、分析數(shù)據(jù)集���、程序代碼和說明性文件等
23.項目總結(jié)會,報告簽章
24.資料歸檔及物料回收��,項目關閉及中心關閉