2024年3月15日,SafeGuard Surgical 宣布 FDA 授予其 LeakGuard™ 可生物降解支架“突破性器械”的稱號���。
這意味著 FDA 承認(rèn)可生物降解支架有潛力明顯改善嚴(yán)重或危及生命疾病的現(xiàn)有治療方法,加快了產(chǎn)品的開發(fā)和審查�����,為全球數(shù)百萬患者帶來了希望���。
產(chǎn)品研發(fā)背景
目前結(jié)腸手術(shù)成本較高,手術(shù)效果不盡如人意�,且并發(fā)癥概率不低。
美國每年有超過 600,000例結(jié)腸手術(shù)�����,通常需要進行腸切除術(shù)�,然后通過吻合術(shù)重新連接腸道的健康部分�,以確保連續(xù)性;
6% ~ 30% 的手術(shù)發(fā)生結(jié)直腸漏�,死亡率介于10% ~ 50%�����;
發(fā)生結(jié)直腸漏之后���,住院費用增加 17,000 美元�,平均每位患者需支付 50,000 美元費用���;
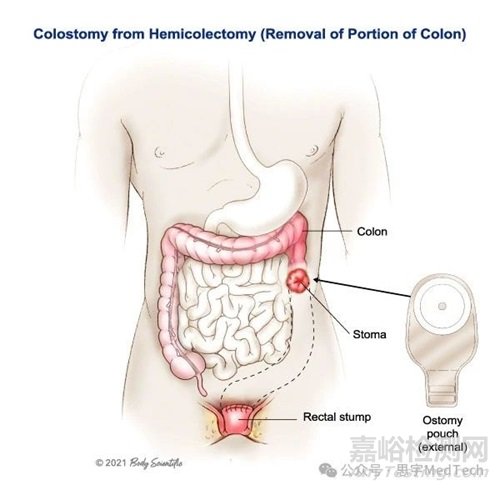
近 70% 的直腸手術(shù)均使用廢物袋���,昂貴且會對生活質(zhì)量產(chǎn)生負(fù)面影響;
回腸造口術(shù)的并發(fā)癥率為 17%�����,失敗率為 10%�����;
結(jié)腸造口術(shù)
結(jié)直腸癌是一種全球流行病。結(jié)直腸漏仍然是最常見的并發(fā)癥之一�。然而,除了結(jié)腸造口袋外�����, FDA 之前沒有批準(zhǔn)其他的方法來保護患者�。
產(chǎn)品介紹
SafeGuard Surgical 開發(fā)了在手術(shù)時放置的LeakGuard™ 可生物降解支架�,作為手術(shù)泄漏的屏障���,這是唯一不需要移除或二次手術(shù)的解決方案�。
手術(shù)期間穿過吻合口插入���;
采用環(huán)保可生物降解材料�;
無需二次手術(shù)�����;
LeakGuard™ 是第一個也是唯一一個采用清潔技術(shù)和可擴展的可持續(xù)供應(yīng)鏈實現(xiàn)零碳足跡和無生態(tài)廢物的手術(shù)解決方案�。這將促進醫(yī)療保健行業(yè)的綠色革命�。
這款支架已經(jīng)獲得專利���,使用醫(yī)用級聚合物保護患者免受結(jié)直腸漏�。
LeakGuard 的潛在市場空間(TAM)為 45 億美元�����,每年用于處理 60 萬例結(jié)腸病例���,復(fù)合年增長率為 13%���。
而且,結(jié)腸切除術(shù)的手術(shù)市場仍在不斷擴大�����,預(yù)計到 2026 年將超過全膝關(guān)節(jié)置換術(shù)���。
關(guān)于 SafeGuard Surgical
SafeGuard Surgical 是一家醫(yī)療技術(shù)公司,致力于為外科患者開發(fā)拯救生命和可持續(xù)的解決方案���。
此次FDA宣布突破性認(rèn)定的同時,SafeGuard Surgical 又宣布了有一個好消息�。SafeGuard Surgical 已經(jīng)獲得 A 輪融資,著名醫(yī)療保健投資者和企業(yè)家 Tom Pepin領(lǐng)投���。
SafeGuard Surgical 總裁兼首席執(zhí)行官表示:“我們很高興雙方能合作�����,我相信,他的領(lǐng)導(dǎo)力和資源將有助于將LeakGuard迅速推向市場�。”