摘 要 / Abstract
新修訂《藥品管理法》全面實施藥品上市許可持有人(MAH)制度,并將其作為基本制度��、核心制度貫穿《藥品管理法》��。本文系統(tǒng)梳理了MAH 及相關(guān)主體在藥品全生命周期全環(huán)節(jié)享有的權(quán)利、應(yīng)當(dāng)履行的積極責(zé)任及應(yīng)當(dāng)承擔(dān)的消極責(zé)任�,并以藥品委托生產(chǎn)為例����,分析了MAH 及相關(guān)主體責(zé)任義務(wù)落實情況��,為MAH 及相關(guān)主體明晰自身的主體責(zé)任、落實相關(guān)義務(wù)提供參考�,以保障藥品質(zhì)量安全��。
The implementation of the newly revised Drug Administration Law comprehensively incorporates the system of marketing authorization holder (MAH) and positions it as a foundational and central element within the framework of the law. This article systematically examines the rights, proactive responsibilities, and passive obligations enjoyed and assumed by MAH and relevant entities throughout the entire pharmaceutical lifecycle. Using drug contract manufacturing as an illustrative case, it scrutinizes the implementation of responsibilities and obligations by MAH and relevant entities. The aim is to provide guidance for clarifying primary responsibilities and fulfilling relevant obligations, ensuring the quality and safety of pharmaceuticals.
關(guān) 鍵 詞 / Key words
藥品上市許可持有人 �;相關(guān)主體;主體責(zé)任;責(zé)權(quán)利分析����;委托生產(chǎn)
marketing authorization holder; relevant entities; main responsibility; analysis of responsibilities and rights;
2019 年修訂的《藥品管理法》全面實施藥品上市許可持有人(marketing authorization holder,MAH)制度,并將其作為基本制度�、核心制度,貫穿于《藥品管理法》��。由MAH 將產(chǎn)品推向市場�,對藥品的安全性��、有效性����、質(zhì)量可控性負(fù)責(zé)�,承擔(dān)全生命周期的主體責(zé)任,其他主體基于環(huán)節(jié)承擔(dān)相應(yīng)的責(zé)任��。新修訂《藥品管理法》實施后��,相關(guān)系列規(guī)章�、規(guī)范性文件進(jìn)一步明確規(guī)定了MAH 及相關(guān)主體的責(zé)任及權(quán)益。本文系統(tǒng)梳理MAH及相關(guān)主體的責(zé)權(quán)利關(guān)系�, 為MAH 及相關(guān)主體更好地落實主體責(zé)任提供參考,以實現(xiàn)全面保障藥品質(zhì)量安全��。
1�、MAH 及相關(guān)主體享有的權(quán)利
《藥品管理法》明確了MAH享有的權(quán)利。對于藥品研制��、生產(chǎn)、經(jīng)營�、使用等環(huán)節(jié)主體,基于環(huán)節(jié)從事相應(yīng)的活動��,并未明顯新增權(quán)利��。MAH 主要具有以下4 項權(quán)利[1]����。
(1)MAH 可以將產(chǎn)品推向市場。無論MAH 為藥品生產(chǎn)企業(yè)抑或是研制機(jī)構(gòu)��,均可以自主將產(chǎn)品推向市場,并對藥品的安全性��、有效性����、質(zhì)量可控性負(fù)責(zé)��。這也是區(qū)別于“捆綁制”管理下MAH 最核心�、最基本的權(quán)利。
(2)MAH 可以選擇自主生產(chǎn),也可以選擇委托生產(chǎn)�。MAH制度實施前��,委托生產(chǎn)必須發(fā)生在藥品生產(chǎn)企業(yè)之間��、必須在產(chǎn)能不足的條件下進(jìn)行����。MAH 制度實施后,無論是上市申請時,或者產(chǎn)品上市后�,MAH 均可以選擇委托生產(chǎn)�。MAH 自行生產(chǎn)應(yīng)當(dāng)取得藥品生產(chǎn)許可證����,委托生產(chǎn)應(yīng)當(dāng)委托符合條件的藥品生產(chǎn)企業(yè)��。MAH 與受托方之間應(yīng)當(dāng)簽訂委托協(xié)議和質(zhì)量協(xié)議,約定雙方的權(quán)利、義務(wù)�。
(3)MAH 可以選擇自行銷售����,也可以委托銷售。MAH 制度下,當(dāng)MAH 具備從事藥品經(jīng)營活動應(yīng)當(dāng)具備的條件時����,可以自行銷售持有的藥品����;當(dāng)MAH 委托銷售時,應(yīng)當(dāng)委托藥品經(jīng)營企業(yè)�。MAH 與受托方之間應(yīng)當(dāng)簽訂委托協(xié)議和質(zhì)量協(xié)議,約定雙方的權(quán)利�、義務(wù)。
(4)MAH 可以轉(zhuǎn)讓藥品上市許可。MAH 制度下�, 進(jìn)一步明確了藥品上市許可的物權(quán)歸屬��。MAH 可以依據(jù)《藥品上市后變更管理辦法(試行)》[2] 的規(guī)定,依法轉(zhuǎn)讓藥品上市許可����,由受讓方對轉(zhuǎn)讓后藥品的安全性����、有效性��、質(zhì)量可控性負(fù)責(zé)��。
2、MAH 及相關(guān)主體應(yīng)當(dāng)履行的積極責(zé)任
2.1 MAH 及相關(guān)主體的法律關(guān)系
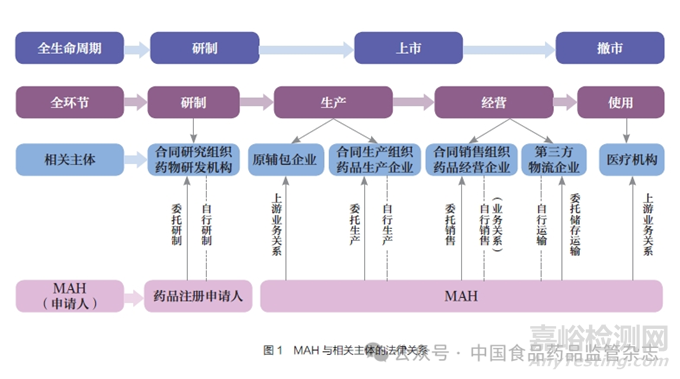
法律關(guān)系即法律規(guī)范在調(diào)整人們的行為過程中所形成的具有法律上權(quán)利義務(wù)形式的社會關(guān)系�。MAH 制度下,MAH 與相關(guān)主體的法律關(guān)系主要為上下游業(yè)務(wù)關(guān)系和委托合同關(guān)系。
(1)在傳統(tǒng)模式下,當(dāng)MAH自行研制����、生產(chǎn)��、銷售時,MAH與相關(guān)主體為上下游業(yè)務(wù)關(guān)系。此時MAH 需要遵循藥品研制��、生產(chǎn)��、經(jīng)營等環(huán)節(jié)責(zé)任��,同時還應(yīng)當(dāng)履行對上下游供應(yīng)商的定期審計義務(wù)��,確保上下游供應(yīng)商滿足全流程追溯�、藥物警戒等要求�,還應(yīng)要求供應(yīng)商持續(xù)向MAH 反饋藥品質(zhì)量缺陷、投訴信息,并協(xié)助藥品召回管理等。
(2) 在委托模式下,MAH采用委托研制(此時為藥品上市許可申請人)�、生產(chǎn)����、銷售時�,MAH 與相關(guān)主體之間主要為委托合同關(guān)系�,如圖1 所示�。委托合作前,MAH 應(yīng)當(dāng)對受托方的質(zhì)量保證能力、風(fēng)險管理能力進(jìn)行評估����,簽訂委托協(xié)議和質(zhì)量協(xié)議��,明確雙方的責(zé)任義務(wù)。委托過程中��,MAH 應(yīng)當(dāng)結(jié)合受托方質(zhì)量管理體系情況�、履行協(xié)議約定義務(wù)情況等,基于風(fēng)險加強(qiáng)對受托方的管理����,定期開展現(xiàn)場審核�,確保持續(xù)合規(guī)����。
2.2 MAH 應(yīng)當(dāng)具體履行的積極責(zé)任
在賦予MAH 政策紅利的同時,《藥品管理法》也對MAH 落實全生命周期��、全過程主體責(zé)任提出了新要求��。此外��,2022 年12 月,國家藥監(jiān)局發(fā)布《藥品上市許可持有人落實藥品質(zhì)量安全主體責(zé)任監(jiān)督管理規(guī)定》[3]�,對MAH 全生命周期質(zhì)量管理的要求進(jìn)行了抽提��、整合與系統(tǒng)化,以指導(dǎo)督促M(fèi)AH 盡責(zé)履職,依法落實質(zhì)量主體責(zé)任�。
具體而言,MAH 應(yīng)當(dāng)從質(zhì)量管理體系搭建及關(guān)鍵崗位人員配備��、全過程質(zhì)量管理要求��、內(nèi)部質(zhì)量管理機(jī)制構(gòu)建3 個層面落實全生命周期主體責(zé)任�。
(1)搭建質(zhì)量管理體系并配備關(guān)鍵崗位人員�。MAH 應(yīng)當(dāng)建立健全藥品質(zhì)量管理體系����,涵蓋藥品非臨床研究����、臨床試驗、生產(chǎn)經(jīng)營��、上市后研究�、不良反應(yīng)監(jiān)測及報告等全生命周期,并持續(xù)改進(jìn)質(zhì)量管理體系�,確保所生產(chǎn)的藥品符合預(yù)定用途和注冊要求。此外�,機(jī)構(gòu)與人員是MAH 質(zhì)量管理體系搭建的核心。MAH 應(yīng)當(dāng)設(shè)立職責(zé)清晰的管理機(jī)構(gòu)����,配備與生產(chǎn)經(jīng)營規(guī)模相適應(yīng)、數(shù)量足夠��、具有相應(yīng)資質(zhì)的管理人員��;設(shè)置獨立的質(zhì)量管理部門�,履行全過程質(zhì)量管理職責(zé)。關(guān)鍵崗位人員包括企業(yè)負(fù)責(zé)人��、生產(chǎn)管理負(fù)責(zé)人、質(zhì)量管理負(fù)責(zé)人����、質(zhì)量受權(quán)人、藥物警戒負(fù)責(zé)人����,其中企業(yè)負(fù)責(zé)人、生產(chǎn)管理負(fù)責(zé)人����、質(zhì)量管理負(fù)責(zé)人、質(zhì)量受權(quán)人應(yīng)當(dāng)為全職人員�。
(2)落實全生命周期、全過程質(zhì)量管理要求��。MAH 應(yīng)當(dāng)落實全生命周期�、全過程質(zhì)量管理要求,建立并實施藥品追溯制度�、藥物警戒制度、藥品召回制度��;應(yīng)當(dāng)嚴(yán)把原輔包供應(yīng)商審核關(guān)�、生產(chǎn)檢驗放行關(guān)、上市放行關(guān)�、儲存運(yùn)輸關(guān);應(yīng)當(dāng)加強(qiáng)上市后管理��,建立藥品上市后變更控制體系��,制定藥品上市后風(fēng)險管理計劃��,完善藥品安全事件處置方案����,建立短缺藥品停產(chǎn)報告制度。當(dāng)MAH 采用委托生產(chǎn)��、委托儲存運(yùn)輸?shù)?�,?yīng)當(dāng)加強(qiáng)對受托方的管理����,定期審核受托方的質(zhì)量管理體系,確保質(zhì)量管理體系的銜接性和持續(xù)合規(guī)�。
(3)MAH 應(yīng)當(dāng)加強(qiáng)內(nèi)部質(zhì)量管理機(jī)制構(gòu)建。MAH 應(yīng)當(dāng)構(gòu)建“每批管控����、季度分析、年度報告�、定期自檢或內(nèi)審�、持續(xù)培訓(xùn)”的質(zhì)量管理機(jī)制�,持續(xù)改進(jìn)藥品質(zhì)量管理體系。具體而言��,MAH 應(yīng)當(dāng)確保每批放行的產(chǎn)品生產(chǎn)��、檢驗過程合規(guī)�,偏差、變更以及潛在的質(zhì)量風(fēng)險均已得到調(diào)查和處理�;應(yīng)當(dāng)結(jié)合產(chǎn)品風(fēng)險定期組織對生產(chǎn)管理、質(zhì)量管理等情況的回顧分析�,原則上每個季度不少于一次對重復(fù)性風(fēng)險和新出現(xiàn)風(fēng)險的研判;應(yīng)當(dāng)指定專職人員負(fù)責(zé)年度報告工作��,持續(xù)完善內(nèi)部報告管理制度����;應(yīng)當(dāng)定期進(jìn)行自檢或者內(nèi)審,監(jiān)控藥品質(zhì)量管理規(guī)范實施情況�,確保質(zhì)量體系的持續(xù)適用和有效;應(yīng)當(dāng)持續(xù)開展培訓(xùn)����,定期評估培訓(xùn)效果,確保所有人員持續(xù)具備相應(yīng)的知識和技能。
2.3 相關(guān)主體應(yīng)當(dāng)具體履行的積極責(zé)任
藥品研制�、生產(chǎn)、經(jīng)營����、使用環(huán)節(jié)等相關(guān)主體應(yīng)當(dāng)遵循相應(yīng)環(huán)節(jié)的管理要求�,持續(xù)符合《藥物非臨床研究質(zhì)量管理規(guī)范》《藥物臨床試驗質(zhì)量管理規(guī)范》《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)》《藥品經(jīng)營質(zhì)量管理規(guī)范》等規(guī)定,確保合規(guī)����。受托從事藥品研制、生產(chǎn)��、經(jīng)營活動時����,應(yīng)當(dāng)履行協(xié)議約定的義務(wù), 接受MAH 的定期審核�,并按照審核發(fā)現(xiàn)的缺陷落實整改,積極采取相應(yīng)的糾正和預(yù)防措施�。受托方發(fā)現(xiàn)重大質(zhì)量問題,應(yīng)當(dāng)立即向委托方和所在地藥品監(jiān)督管理部門報告��,并主動采取風(fēng)險控制措施����。
3����、MAH 及相關(guān)主體應(yīng)當(dāng)承擔(dān)的消極責(zé)任
消極責(zé)任指應(yīng)當(dāng)由當(dāng)事人承擔(dān)的消極法律后果��,包括民事責(zé)任��、行政責(zé)任和刑事責(zé)任��。
3.1 民事責(zé)任
根據(jù)《民法典》《藥品管理法》規(guī)定����,因藥品質(zhì)量缺陷致人損害,受害人可以向MAH��、生產(chǎn)企業(yè)請求賠償�,也可以向經(jīng)營企業(yè)、醫(yī)療機(jī)構(gòu)請求賠償��。首先接到受害人賠償請求的一方�,應(yīng)當(dāng)承擔(dān)先行賠付的義務(wù),此后再依法追償��。即對外����,MAH����、生產(chǎn)企業(yè)�、經(jīng)營企業(yè)、醫(yī)療機(jī)構(gòu)依法承擔(dān)連帶責(zé)任��,并且實行首負(fù)責(zé)任制�;對內(nèi)����,依據(jù)《民法典》《產(chǎn)品質(zhì)量法》等劃分各自的責(zé)任。值得注意的是����,MAH 作為事實意義上的生產(chǎn)者,應(yīng)當(dāng)對產(chǎn)品缺陷致人損害承擔(dān)無過錯責(zé)任����,其中《產(chǎn)品質(zhì)量法》規(guī)定的法定免責(zé)事由除外,包括“未將產(chǎn)品投入流通的�;產(chǎn)品投入流通時,引起損害的缺陷尚不存在的�;將產(chǎn)品投入流通時的科學(xué)技術(shù)水平尚不能發(fā)現(xiàn)缺陷的存在的”三類情況�,即狹義的藥品不良反應(yīng)應(yīng)為產(chǎn)品投入流通時尚不能發(fā)現(xiàn)的缺陷�,屬于法定免責(zé)事由。
3.2 行政責(zé)任和刑事責(zé)任
在行政責(zé)任和刑事責(zé)任方面����,不存在連帶之說法。針對行政責(zé)任����,MAH、生產(chǎn)企業(yè)�、經(jīng)營企業(yè)、醫(yī)療機(jī)構(gòu)都應(yīng)當(dāng)基于《藥品管理法》《藥品注冊管理辦法》《藥品生產(chǎn)監(jiān)督管理辦法》《藥品經(jīng)營和使用質(zhì)量監(jiān)督管理辦法》等藥事法律規(guī)章中規(guī)定的責(zé)任義務(wù)承擔(dān)相應(yīng)的行政責(zé)任����;針對刑事責(zé)任,MAH����、生產(chǎn)企業(yè)、經(jīng)營企業(yè)�、醫(yī)療機(jī)構(gòu)應(yīng)當(dāng)基于《刑法》的規(guī)定,在滿足犯罪構(gòu)成要件的情況上�,承擔(dān)相應(yīng)的刑事責(zé)任。需要注意的是��,當(dāng)MAH 和受托生產(chǎn)企業(yè)、經(jīng)營企業(yè)之間為委托關(guān)系時��,MAH 應(yīng)當(dāng)履行對受托方的監(jiān)督義務(wù)����,即“管理責(zé)任”,在違反上述“管理責(zé)任”的情況下�,MAH 可能需要承擔(dān)藥事法律規(guī)章中對應(yīng)的行政責(zé)任,也可能涉嫌《刑法》中規(guī)定的幫助犯��。
4�、MAH 及相關(guān)主體責(zé)任落實現(xiàn)狀及相關(guān)思考——以藥品委托生產(chǎn)為例
4.1 委托生產(chǎn)過程中MAH 與受托方的責(zé)權(quán)利分析
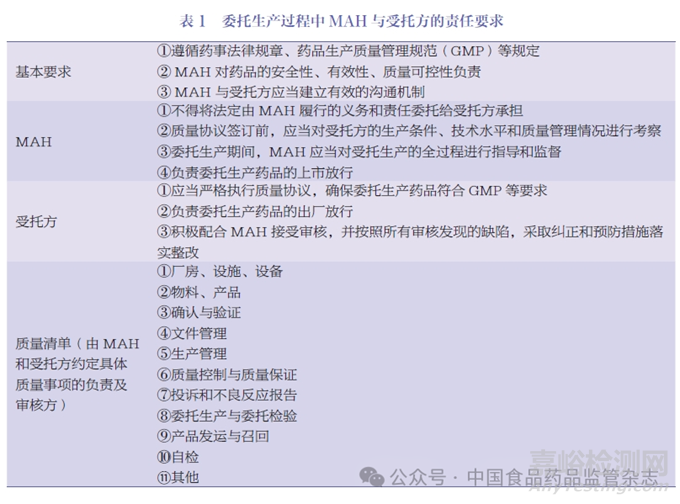
MAH 制度下,藥品委托生產(chǎn)進(jìn)一步放開��,即MAH 可以選擇自行生產(chǎn)��,也可以委托生產(chǎn)����?���;谒幤肺猩a(chǎn)管理的重要性,《藥品管理法》進(jìn)一步要求國務(wù)院藥品監(jiān)督管理部門加強(qiáng)行政指導(dǎo)����,發(fā)布藥品委托生產(chǎn)質(zhì)量協(xié)議相關(guān)指南��,指導(dǎo)�、監(jiān)督MAH 和受托生產(chǎn)企業(yè)履行藥品質(zhì)量保證義務(wù)����。隨后國家藥監(jiān)局正式發(fā)布了《藥品委托生產(chǎn)質(zhì)量協(xié)議指南(2020 年版)》《藥品委托生產(chǎn)質(zhì)量協(xié)議模板(2020 年版)》,其詳細(xì)規(guī)定了MAH��、受托方的基本要求����,見表1。
4.2 委托生產(chǎn)過程中MAH 與受托方責(zé)任落實情況
現(xiàn)階段藥品委托生產(chǎn)實際執(zhí)行中尚存在以下幾點問題��。
4.2.1 相關(guān)政策執(zhí)行中精細(xì)化管理有待進(jìn)一步提高
《藥品管理法》從夯實MAH的主體責(zé)任��、保障藥品質(zhì)量安全的角度����,要求執(zhí)行生產(chǎn)放行和上市放行雙放行管理,然而����,其一��,當(dāng)MAH 自行生產(chǎn)時����,是否需要雙放行����,實踐執(zhí)行中不夠明確;其二�,當(dāng)MAH 和受托生產(chǎn)企業(yè)為執(zhí)行同一質(zhì)量管理體系的集團(tuán)公司或者為長期緊密合作的合作伙伴時,雙放行管理是否可以適當(dāng)優(yōu)化有待進(jìn)一步探討[4]����。再者,在放行標(biāo)準(zhǔn)方面����,《藥品生產(chǎn)監(jiān)督管理辦法》規(guī)定:藥品生產(chǎn)企業(yè)應(yīng)當(dāng)建立藥品出廠放行規(guī)程����,明確出廠放行的標(biāo)準(zhǔn)、條件����,符合標(biāo)準(zhǔn)�、條件的����,經(jīng)質(zhì)量受權(quán)人簽字后方可出廠放行。MAH 應(yīng)當(dāng)建立藥品上市放行規(guī)程�,對藥品生產(chǎn)企業(yè)出廠放行的藥品檢驗結(jié)果和放行文件進(jìn)行審核,經(jīng)質(zhì)量受權(quán)人簽字后方可上市放行��。然而實踐中關(guān)于MAH 的上市放行審核標(biāo)準(zhǔn)執(zhí)行不一�,例如部分MAH在上市放行時僅審核受托方的放行記錄即簽字放行,部分MAH則對受托方的批記錄��、偏差管理文件進(jìn)行詳細(xì)審核后簽字放行等�。
4.2.2 MAH 自身管理能力有待加強(qiáng)
MAH 制度下,研發(fā)機(jī)構(gòu)����、藥品經(jīng)營企業(yè)通過獲得B 類藥品生產(chǎn)許可證均可以成為MAH,但其中部分MAH 缺乏對產(chǎn)品研發(fā)信息��、工藝條件的了解��,可能造成研發(fā)到生產(chǎn)階段的技術(shù)轉(zhuǎn)移問題��;部分MAH 缺乏質(zhì)量管理經(jīng)驗,存在對藥品生產(chǎn)企業(yè)過度指揮����、過度干預(yù)等情況。另外����,部分MAH 配備的關(guān)鍵人員缺乏相關(guān)經(jīng)驗、人員培訓(xùn)不到位��、崗位變更頻繁��,還存在質(zhì)量管理及藥物警戒人員配置較少��、兼任情況較多�、難以有效履行相關(guān)職責(zé)等現(xiàn)象[5-6]?���!端幤饭芾矸ā肥状螐姆蓪用婷鞔_了質(zhì)量受權(quán)人的放行職責(zé),但實踐中質(zhì)量受權(quán)人存在準(zhǔn)入標(biāo)準(zhǔn)較低����、質(zhì)量管理水平較低�、身兼數(shù)職、流動頻繁等情況����,造成了其能力不足����、話語權(quán)受限等問題[7]�。
4.2.3 MAH 與受托方質(zhì)量管理體系銜接不夠暢通
目前,我國MAH 制度執(zhí)行尚處于初級階段�,MAH 和受托方質(zhì)量管理體系存在一定的缺陷和銜接性不足等問題。例如��,沒有明確放行管理規(guī)程����、沒有定期對受托方進(jìn)行現(xiàn)場考核、缺少對受托方監(jiān)控的方式[8]����、未制定與受托企業(yè)進(jìn)行質(zhì)量信息溝通及處置的管理規(guī)程;未根據(jù)偏差的風(fēng)險規(guī)定偏差發(fā)生雙方的通知時限��、溝通程序��;未規(guī)定MAH 在接到受托生產(chǎn)企業(yè)變更申請后的處理流程等��。對于受托方而言,針對如何將雙方質(zhì)量協(xié)議中約定有特殊要求的事項納入其質(zhì)量管理體系方面存在不足��,包括偏差審批�、變更控制、檢驗結(jié)果偏差(OOS)結(jié)果處理及上市放行等質(zhì)量事項��。這也導(dǎo)致MAH 與受托方文件管理體系脫節(jié)��,未明確各自在質(zhì)量管理事項中的參與程度和批準(zhǔn)流程����,雙方文件各行其是,對相同問題的處理流程不統(tǒng)一�。例如,部分MAH 文件規(guī)定生產(chǎn)過程中發(fā)生偏差的�,需開展偏差調(diào)查形成調(diào)查報告,調(diào)查報告經(jīng)委托方審核簽字后方能關(guān)閉�,但受托方的偏差管理規(guī)定未對委托方職責(zé)進(jìn)行規(guī)定;部分MAH 規(guī)定按照變更控制級別確定審核程度��,但受托方文件未進(jìn)行相關(guān)規(guī)定[9]�。
4.2.4 其他方面
《藥品委托生產(chǎn)質(zhì)量協(xié)議指南(2020 年版)》從我國國情出發(fā),對委托生產(chǎn)中的質(zhì)量協(xié)議簽訂與執(zhí)行進(jìn)行了詳細(xì)規(guī)定��,為MAH 和受托方開展委托生產(chǎn)活動提供了良好的指導(dǎo)��。但目前,各方反映該指南存在法律地位不清晰��,在委托生產(chǎn)簽訂質(zhì)量協(xié)議時�,雙方不確定是否必須依照該指南起草質(zhì)量協(xié)議����。此外,該指南規(guī)定的部分內(nèi)容與實踐可能存在一定的沖突�,例如該指南規(guī)定MAH 應(yīng)負(fù)責(zé)物料供應(yīng)商的選擇、管理和審核�,但實踐中,相較于MAH 特別是研發(fā)機(jī)構(gòu)的MAH��,大型受托生產(chǎn)企業(yè)對不同委托方共用物料更為熟悉����,其可以提供物料供應(yīng)商合格目錄,由MAH進(jìn)行審核�。
4.3 相關(guān)建議
MAH 制度的精髓在于通過專業(yè)化分工和協(xié)作實現(xiàn)資源優(yōu)化配置[10]?���;诂F(xiàn)階段我國MAH 制度執(zhí)行時間尚短,MAH 與受托企業(yè)仍然存在相關(guān)不足的情況����,筆者探索性地提出幾點建議����,以期為相關(guān)部門完善MAH 制度提供參考�。
4.3.1 持續(xù)提升MAH 的質(zhì)量管理能力
MAH 應(yīng)當(dāng)主動提升質(zhì)量管理能力,配備符合要求的�、足夠數(shù)量的人員,加強(qiáng)對產(chǎn)品�、工藝的理解;應(yīng)當(dāng)認(rèn)真分析自身持有品種全生命周期中存在各種風(fēng)險要素�,充分考慮與產(chǎn)品質(zhì)量相關(guān)方(受托生產(chǎn)企業(yè)、藥品經(jīng)營企業(yè)����、監(jiān)管部門)的銜接、互動����、監(jiān)管等需求,不斷完善自身的質(zhì)量保障體系��、提升質(zhì)量管理水平�。各省(自治區(qū)�、直轄市)也應(yīng)當(dāng)進(jìn)一步細(xì)化對B 證MAH 的資質(zhì)要求�,組織能力提升培訓(xùn)班或者經(jīng)驗交流會����,為MAH 提供經(jīng)驗交流平臺。針對質(zhì)量受權(quán)人�,應(yīng)當(dāng)細(xì)化質(zhì)量受權(quán)人的資質(zhì)類別(例如分為化學(xué)藥品��、生物制品����、中藥等),重視質(zhì)量受權(quán)人的繼續(xù)教育����,督促質(zhì)量受權(quán)人持續(xù)學(xué)習(xí)和提升。
4.3.2 完善MAH 與受托方之間的溝通交流機(jī)制
在藥品委托生產(chǎn)活動中��,MAH 與受托方之間有效的協(xié)作和溝通交流至關(guān)重要��。MAH 和受托方應(yīng)當(dāng)細(xì)化質(zhì)量協(xié)議中質(zhì)量事項的責(zé)任分工�。當(dāng)藥品注冊申報信息發(fā)生變更、發(fā)現(xiàn)質(zhì)量風(fēng)險時�,MAH 應(yīng)當(dāng)及時通知受托方。受托方自身也有責(zé)任積極主動地識別潛在質(zhì)量問題�,向MAH 報告����,并展開質(zhì)量事故調(diào)查�、風(fēng)險分析、溝通和評估等系列舉措����。這種信息傳遞的雙向性有助于不斷改進(jìn)產(chǎn)品工藝性能、質(zhì)量狀態(tài)以及MAH 與受托方質(zhì)量管理體系的銜接性����。除此之外,MAH 與受托方可以定期舉辦質(zhì)量交流活動����,共同討論藥品委托生產(chǎn)中常見風(fēng)險、潛在隱患及解決方案�。
4.3.3 細(xì)化相關(guān)管理規(guī)定
隨著MAH 制度的推行,相關(guān)管理規(guī)定����、MAH 與受托方之間責(zé)任義務(wù)的劃分及落實等均需要在實踐中進(jìn)一步探索、完善����。例如�,在雙放行管理方面�,長期而言針對集團(tuán)內(nèi)委托生產(chǎn),可探索適當(dāng)簡化放行程序��,明確實行基于風(fēng)險的上市放行管理�;針對《藥品委托生產(chǎn)質(zhì)量協(xié)議指南(2020 年版)》,應(yīng)當(dāng)明確指南的指導(dǎo)性地位����,同時允許企業(yè)適當(dāng)調(diào)整指南事項����,包括在物料供應(yīng)商管理方面可以由具備成熟質(zhì)量體系的受托方提供部分共用物料供應(yīng)商目錄供MAH 審核等,以更好地適應(yīng)實際�。
5、結(jié) 語
MAH 制度的實施�,激發(fā)了醫(yī)藥行業(yè)創(chuàng)新活力、優(yōu)化了醫(yī)藥行業(yè)資源配置��。作為MAH����,在享受政策紅利的同時,更應(yīng)當(dāng)主動建立健全質(zhì)量保障體系�,加強(qiáng)對受托方的管理����;應(yīng)當(dāng)具有主人翁意識�、責(zé)任意識,積極承擔(dān)藥品全生命周期�、全過程質(zhì)量管理主體責(zé)任,形成“一方牽頭����、多方共擔(dān)”的良好局面�,切實履行對全過程相關(guān)主體的管理義務(wù),保證藥品質(zhì)量安全��。
參考文獻(xiàn)
[1] 謝金平, 孫圓圓, 彭楠, 等. 藥品上市許可持有人(MAH)制度對現(xiàn)行監(jiān)管制度的影響及銜接建議[J]. 中國衛(wèi)生政策研究,2018,11(12):1-6.
[2] 國家藥品監(jiān)督管理局. 國家藥監(jiān)局關(guān)于發(fā)布《藥品上市后變更管理辦法(試行)》的公告(2021 年第8 號) [EB/OL]. (2021-01-13) [2023-09-28].https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20210113142301136.html.
[3] 國家藥品監(jiān)督管理局. 國家藥監(jiān)局關(guān)于發(fā)布《藥品上市許可持有人落實藥品質(zhì)量安全主體責(zé)任監(jiān)督管理規(guī)定》的公告(2022 年第126 號)[EB/
OL]. (2022-12-29) [2023-09-28].https://www.nmpa.gov.cn/directory/web/nmpa/yaopin/ypggtg/20221229195805180.html.
[4] 邵蓉, 謝金平. 再談我國國情下藥品上市許可持有人制度[J]. 中國醫(yī)藥導(dǎo)刊,2022,24(8) :735-739.
[5] 張書卉. B 類藥品生產(chǎn)許可證核發(fā)檢查常見問題分析[J]. 上海醫(yī)藥,2022,43(3):63-66.
[6] 胡士高, 竇穎輝, 王浩. 安徽省藥品生產(chǎn)企業(yè)質(zhì)量受權(quán)人結(jié)構(gòu)現(xiàn)狀調(diào)研分析[J]. 安徽衛(wèi)生職業(yè)技術(shù)學(xué)院學(xué)報,2020,19(1):1-3.
[7] 應(yīng)宏鋒. “藥品質(zhì)量受權(quán)人制度” 的思考與實踐:激發(fā)藥品生產(chǎn)企業(yè)落實主體責(zé)任是監(jiān)管工作的 “牛鼻子”[J]. 中國食品藥品監(jiān)管,2019(6):10-15.
[8] 顏若曦, 曹軼, 俞佳寧, 等. 對藥品上市許可持有人檢查工作的調(diào)研分析[J]. 中國藥物評價,2022,39(1):83-86.
[9] 馬艷紅. 對MAH 委托生產(chǎn)的檢查重點及監(jiān)管難點分析[J]. 藥學(xué)與臨床研究,2022,30(2):184-186.
[10] 邵蓉, 謝金平. 變革中持續(xù)探索 探索中立足國情:再談我國藥品上市許可持有人制度[J]. 中國食品藥品監(jiān)管,2021(6):78-85.