前言:早些時(shí)日���,恰逢一個(gè)固體片劑品種(濕法制粒工藝)的中試放大生產(chǎn)���,在下班后的“圍爐夜話”上��,幾位制劑同仁對(duì)“粘合劑配制完畢后是否需要考察其存放時(shí)限”的問題展開了討論。一種觀點(diǎn)認(rèn)為:在大多數(shù)情況下���,粘合劑配制完成后即會(huì)加入至濕法制粒機(jī)中進(jìn)行后序的制粒工藝���,期間不會(huì)耽擱較多時(shí)間���,增加其存放時(shí)限考察只是徒增工作量罷了��;而另一種觀點(diǎn)則恰恰相反,認(rèn)為考察粘合劑存放時(shí)限實(shí)有必要���。我們無法避免生產(chǎn)期間突發(fā)情況的發(fā)生���,而一旦期間耽擱了較長(zhǎng)時(shí)間后,粘合劑漿液的性質(zhì)是否發(fā)生了變化���、是否還能繼續(xù)使用都是需要進(jìn)一步確認(rèn)的,主觀上的決定棄留是對(duì)物料的浪費(fèi)和對(duì)產(chǎn)品質(zhì)量的不負(fù)責(zé)……
盡管目前CDE并未發(fā)布關(guān)于對(duì)中間產(chǎn)品/待包裝產(chǎn)品存放時(shí)限針對(duì)性的指導(dǎo)原則�����,但隨著ICH相關(guān)指導(dǎo)原則在我國的逐步實(shí)施以及國際通用的研發(fā)控制理念的逐步推行���,我們亦可從國外各監(jiān)管機(jī)構(gòu)所出臺(tái)的相關(guān)文件指南中窺知一二:
1、中間產(chǎn)品及待包裝產(chǎn)品應(yīng)在到達(dá)下一步生產(chǎn)工序前保持其質(zhì)量屬性不變��,以避免對(duì)終產(chǎn)品產(chǎn)生不利影響�����;
2�����、生產(chǎn)過程中的每一種中間產(chǎn)品都應(yīng)制定貯存時(shí)限�����。貯存時(shí)限同包裝形式��、貯存條件等密切相關(guān)���,貯存時(shí)限應(yīng)根據(jù)驗(yàn)證結(jié)果確定,并采取有效的管理措施在日常生產(chǎn)過程中進(jìn)行控制��,避免超出貯存時(shí)限���;
3、任何延長(zhǎng)儲(chǔ)存或生產(chǎn)時(shí)間的情況均應(yīng)符合GMP要求���,如果過程中涉及到產(chǎn)品的運(yùn)輸和場(chǎng)地轉(zhuǎn)移��,還應(yīng)考慮到運(yùn)輸期間的持續(xù)時(shí)間和條件是否與設(shè)定的貯存條件偏離太多���,或由此帶來的影響;
4���、存放時(shí)限通常應(yīng)在產(chǎn)品上市前確定��,可使用中試或工藝驗(yàn)證期間的1個(gè)批次來驗(yàn)證�����。在涉及某些特殊產(chǎn)品提交上市許可申請(qǐng)時(shí)�����,須特別重視對(duì)其獨(dú)特的貯存方式/貯存時(shí)間進(jìn)行研究�����,提交的材料應(yīng)科學(xué)�����、全面��、嚴(yán)謹(jǐn)���、詳實(shí)��。
另外��,QBD理念要求我們應(yīng)將質(zhì)控具體到生產(chǎn)過程中的每一階段,以此來整體把握產(chǎn)品質(zhì)量�����。WHO有文件以口服固體包衣片劑為例���,提供了相關(guān)研究思路以供參考�����,如下:
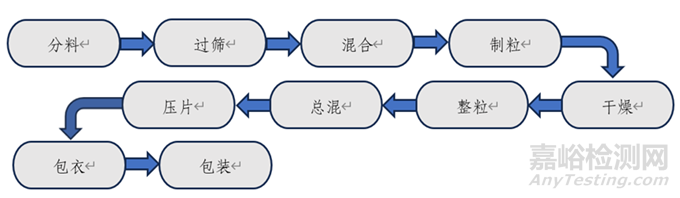
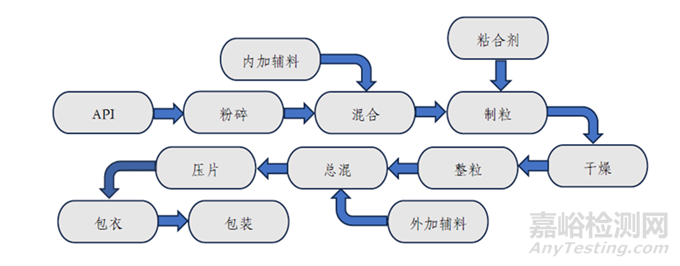
圖1.普通口服固體包衣片劑一般工藝流程
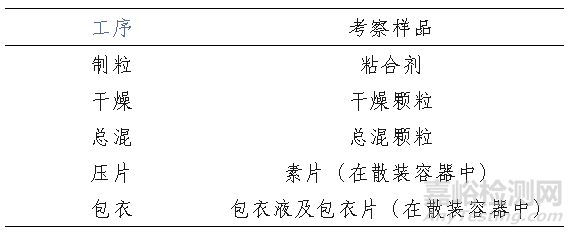
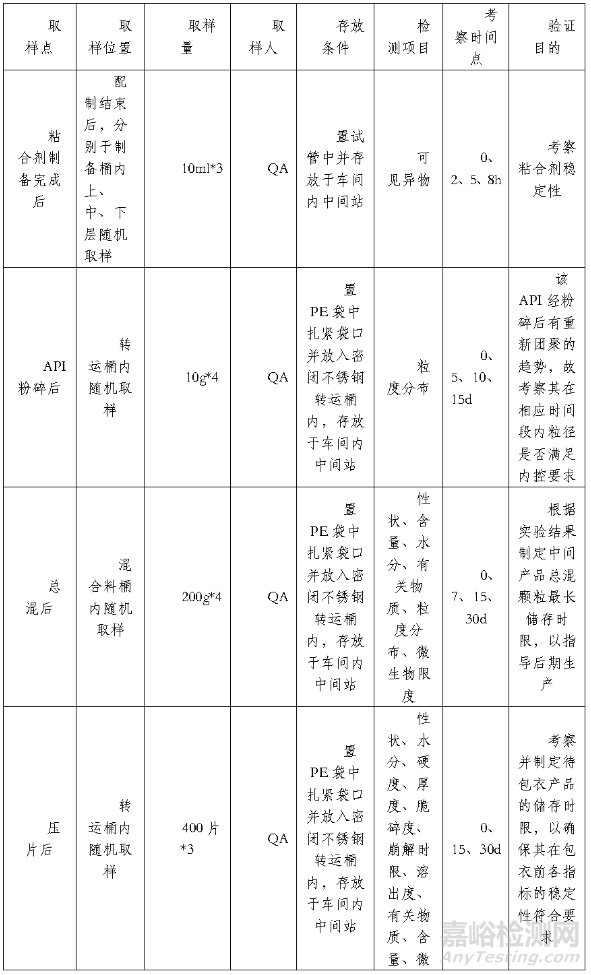
表1. 建議考察的工序及樣品
表2. 檢測(cè)項(xiàng)目及考察時(shí)間點(diǎn)
同樣地��,該研究思路可延伸至其他劑型�����,如液體制劑:
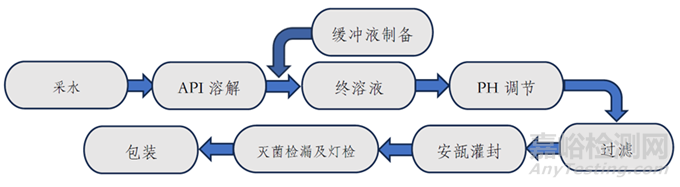
圖2. 小容量注射劑一般工藝流程
表3. 建議考察的工序及樣品
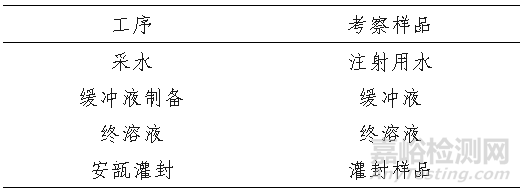
表4. 檢測(cè)項(xiàng)目及考察時(shí)間點(diǎn)
注意:以上所列考察工序���、項(xiàng)目�����、時(shí)間點(diǎn)等皆非強(qiáng)制性內(nèi)容,研發(fā)人員可根據(jù)物料的狀態(tài)和產(chǎn)品特性進(jìn)行合理的設(shè)計(jì)��。
在確定了存放時(shí)限考察的工序��、檢測(cè)項(xiàng)目��、時(shí)間點(diǎn)后�����,我們應(yīng)當(dāng)對(duì)樣品的取樣�����、存放�����、檢測(cè)給予必要的關(guān)注:
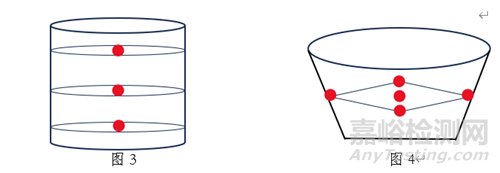
1.取樣:以普通口服固體包衣片劑為例���,其粘合劑樣品可參考圖3所示位置(紅色圓點(diǎn)處)取樣��,干燥后顆粒樣品可參考圖4所示位置(紅色圓點(diǎn)處)取樣��,素片樣品可從壓片全程中的前�����、中���、后期及壓片機(jī)的左、右站口分別取樣等���?�?傊?�,取樣應(yīng)以具體品種的特性為前提��,并兼顧代表性�����、能真實(shí)反應(yīng)樣品的實(shí)際儲(chǔ)存情況���,同時(shí)取樣量應(yīng)滿足考察的需求�����。
2.存放:樣品存放的環(huán)境條件應(yīng)與暫存區(qū)域或生產(chǎn)工序的條件相同���。例如上述顆粒與素片可在其所在生產(chǎn)車間的中間站內(nèi)進(jìn)行存放考察,過程中所用的容器也應(yīng)與生產(chǎn)過程中所用的包裝相同或等效���,同時(shí)要注意避免過度包裝,如:整粒后的下步工序?yàn)榭偦?�,整粒后顆粒在轉(zhuǎn)移過程中是置于雙層聚乙烯袋中并放入不銹鋼物料桶中遮光保存���,那么在進(jìn)行存放時(shí)限考察時(shí)也應(yīng)采用相同條件進(jìn)行考察���。另外,如果考慮到實(shí)際生產(chǎn)過程中存在最差存放情況的可能�����,可用恒溫恒濕箱來模擬最惡劣的儲(chǔ)存條件��,而對(duì)于易氧化產(chǎn)品,也應(yīng)考慮到存放樣品容器的頂部空間�����、體積大小對(duì)物料性質(zhì)的影響��。如果有任何過程中物料超過規(guī)定保存時(shí)間�����,應(yīng)按照偏差管理的SOP進(jìn)行處理���,并按規(guī)范進(jìn)行檢驗(yàn)���,之后才能放行至下一步。
3.檢測(cè):應(yīng)對(duì)研究所用的分析方法進(jìn)行全面的方法學(xué)驗(yàn)證��,以保證其能完全滿足樣品的檢測(cè)需求��。如果數(shù)據(jù)顯示在截至貨架期的中間時(shí)間點(diǎn)有不利趨勢(shì)或變化模式���,則應(yīng)考慮對(duì)同批成品進(jìn)行長(zhǎng)期穩(wěn)定性測(cè)試��。
筆者欲引一過往生產(chǎn)實(shí)例���,以期增進(jìn)對(duì)上訴理解:
圖3. YYDS片生產(chǎn)工藝流程圖
表5. YYDS片存放時(shí)限考察
參考文獻(xiàn)
1.SOP for hold time study in pharmaceuticals
2.藥品生產(chǎn)過程中中間產(chǎn)品/待包裝產(chǎn)品存放時(shí)限的技術(shù)要求及審評(píng)考慮
3.Hold-time study for pharmaceutical tablet during manufacturing process:An innovative step
4.Standard practice of sampling, storage and holding time for pharmaceutical tablet and injection during manufacturing process
5.WHO:General guidance on hold-time studies