一、定義 根據(jù)《醫(yī)療器械分類規(guī)則》第三條
有源醫(yī)療器械指�,任何依靠電能或者其他能源,而不是直接由人體或者重力產(chǎn)生的能量�,發(fā)揮其功能的醫(yī)療器械�。
二、分類 根據(jù)《醫(yī)療器械分類規(guī)則》第五條
依據(jù)影響醫(yī)療器械風(fēng)險(xiǎn)程度的因素�,醫(yī)療器械可以分為以下幾種情形:
(一)根據(jù)結(jié)構(gòu)特征的不同�,分為無(wú)源醫(yī)療器和有源醫(yī)療器械�。
(二)根據(jù)不同的結(jié)構(gòu)特征和是否接觸人體,醫(yī)療器的使用形式包括:
有源接觸人體器械:能量治療器械�、診斷監(jiān)護(hù)器械�、液體輸送器械、電離輻射器械�、植入器械�、其他有源接觸人體器械。
有源非接觸人體器械:臨床檢驗(yàn)儀器設(shè)備�、獨(dú)立軟件�、醫(yī)療器械消毒滅菌設(shè)備、其他有源非接觸人體器械�。
(三)根據(jù)不同的結(jié)構(gòu)特征、是否接觸人體以及使用形式�,醫(yī)療器械的使用狀態(tài)或者其產(chǎn)生的影響包括以下情形:
有源接觸人體器械:根據(jù)失控后可能造成的損傷程度分為輕微損傷、中度損傷�、嚴(yán)重?fù)p傷�。
有源非接觸人體器械:根據(jù)對(duì)醫(yī)療效果的影響程度分為基本不影響�、輕微影響、重要影響�。
2�、有源醫(yī)療器械企業(yè)選址與基礎(chǔ)設(shè)施
根據(jù)《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》第三章廠房與設(shè)施及有源醫(yī)療設(shè)備的特點(diǎn)
有源醫(yī)療器械選址規(guī)劃注意事項(xiàng):(來(lái)源網(wǎng)絡(luò))
1、盡可能遠(yuǎn)離城市生活區(qū)
2�、周邊無(wú)強(qiáng)污染源�,且遠(yuǎn)離較強(qiáng)干擾區(qū)域
(如砼加工區(qū)域�、垃圾處理廠�、強(qiáng)噪聲、強(qiáng)震動(dòng)�、變電站�、軍事等衛(wèi)星接收設(shè)施群、動(dòng)物養(yǎng)殖基地.屠宰基地�、其他可能影響產(chǎn)品生產(chǎn)和質(zhì)量控制的因素或環(huán)境等)
3、廠區(qū)布局應(yīng)合理
1.至少做到生產(chǎn)�、質(zhì)量控制、倉(cāng)儲(chǔ)�、辦公�、生活區(qū)域相對(duì)獨(dú)立
2.人流、物流分開
3.降低交叉往復(fù)造成的干擾
4.路面硬化�,減少裸露泥土地面
5.合理綠化�,避免種植飄絮、產(chǎn)生花粉等的植物
有源醫(yī)療器械注冊(cè)對(duì)生產(chǎn)場(chǎng)地有什么要求?
一�、有源醫(yī)療器械注冊(cè)對(duì)生產(chǎn)場(chǎng)地的要求:
1.所有區(qū)塊都要明確標(biāo)識(shí):
有醒目的區(qū)域標(biāo)識(shí)牌�。面積大小與生產(chǎn)規(guī)模、品種相適應(yīng)即可�。生產(chǎn)環(huán)境應(yīng)當(dāng)整潔�、符合產(chǎn)品質(zhì)量需要�。
2.倉(cāng)庫(kù)常規(guī)要求:
a)有待驗(yàn)區(qū)、合格區(qū)�、不合格�、退貨/召回區(qū)。分區(qū)明顯�,有明顯標(biāo)識(shí),可用有顏色的膠帶紙做區(qū)分�。統(tǒng)一標(biāo)準(zhǔn):合格品和待發(fā)貨品區(qū)為綠色、不合格品區(qū)為紅色�、待驗(yàn)區(qū)和退貨區(qū)為黃色�。b)庫(kù)房?jī)?nèi)有必要的溫濕度測(cè)定儀、陰涼庫(kù)應(yīng)有溫濕度調(diào)控設(shè)備�、有地墊�、貨架,避光�、通風(fēng)設(shè)施�、防火、防蟲鼠�、防霉潮�、防污染�、通風(fēng)排水設(shè)施�,適當(dāng)照明及消防設(shè)施。窗簾避光�,掛溫濕度儀,掛捕蚊燈�,捕鼠籠。
3.庫(kù)房特殊要求:依據(jù)產(chǎn)品特性做好相應(yīng)措施�。如特殊電子類材料是否有溫濕度控制要求�。
二、有源醫(yī)療器械注冊(cè)對(duì)生產(chǎn)區(qū)�、檢驗(yàn)區(qū)要求:
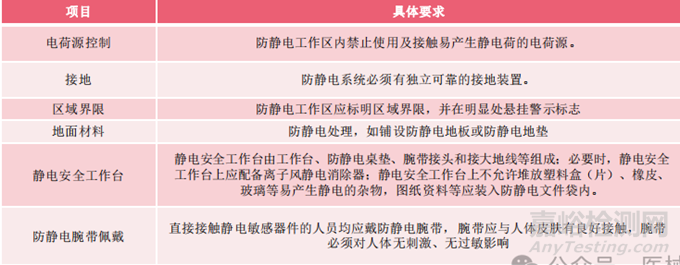
設(shè)置靜電保護(hù)區(qū)域:包括電子料存儲(chǔ)和接收發(fā)放區(qū)域�、電子料來(lái)料檢驗(yàn)區(qū)域、電子料焊接區(qū)域�、電子板卡調(diào)試檢驗(yàn)區(qū)域�、涉及電子料的裝配作業(yè)區(qū)域涉及電子料的維修區(qū)域。
2.防靜電要求:
三�、其它要求:
考慮到部分有源醫(yī)療器械包含了特殊功能�、性能�、無(wú)菌組件等,企業(yè)在準(zhǔn)備醫(yī)療器械注冊(cè)場(chǎng)地時(shí)�,還應(yīng)該關(guān)注產(chǎn)品生產(chǎn)和儲(chǔ)存需要的其它條件�。一般情況下,可對(duì)照產(chǎn)品技術(shù)要求和說明書分析�、識(shí)別場(chǎng)地要求。
3�、有源醫(yī)療器械的命名、單元?jiǎng)澐值?/strong>
一�、關(guān)于有源醫(yī)療器械命名的法規(guī):
《醫(yī)療器械通用名稱命名規(guī)則》
《醫(yī)療器械通用名稱命名指導(dǎo)原則》
《醫(yī)用康復(fù)器械通用名稱命名指導(dǎo)原則》
《中醫(yī)器械通用名稱命名指導(dǎo)原則》《放射治療器械通用名稱命名指導(dǎo)原則》
《呼吸�、麻醉和急救器械通用名稱命名指導(dǎo)原則》
《婦產(chǎn)科、輔助生殖和避孕器械通用名稱命名指導(dǎo)原則》
二�、關(guān)于有源醫(yī)療器械單元?jiǎng)澐值姆ㄒ?guī):
《醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則》(一�、有源醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則)
三�、醫(yī)療器械注冊(cè)單元?jiǎng)澐謱?shí)例:
1.磁共振設(shè)備、CT機(jī)�、X射線類設(shè)備�、監(jiān)護(hù)儀、心電圖機(jī)�、內(nèi)窺鏡、激光治療機(jī)宜劃分為不同的注冊(cè)單元�。2.半導(dǎo)體激光設(shè)備�、二氧化碳激光設(shè)備、Nd:YAG激光設(shè)備宜劃分為不同的注冊(cè)單元�。3.空氣加壓氧艙與氧氣加壓氧艙宜劃分為不同的注冊(cè)單元�。4.Q開關(guān)Nd:YAG激光治療儀與長(zhǎng)脈沖Nd:AG激光治療儀�,雖工作物質(zhì)和波長(zhǎng)都相同�,但因輸出能量及輸出方式的差異導(dǎo)致性能參數(shù)�、預(yù)期用途不同時(shí)�,宜劃分為不同的注冊(cè)單元�。5.用于不同適用范圍的心臟射頻消融導(dǎo)管宜劃分為不同的注冊(cè)單元。6.不同適用范圍的內(nèi)窺鏡�,如關(guān)節(jié)鏡與鼻竇鏡、宮腔鏡與腹腔鏡等�,宜劃分為不同的注冊(cè)單元�。7.血液透析設(shè)備與配合使用的耗材(透析管路、透析器�、灌流器等)宜劃分為不同的注冊(cè)單元�。
單元?jiǎng)澐峙c公司經(jīng)營(yíng):密切相關(guān)、生死攸關(guān)�,單元?jiǎng)澐譀Q定公司的存亡,需要優(yōu)秀的注冊(cè)人員
單元?jiǎng)澐峙c產(chǎn)品上市后管理:涉及到不良事件和召回處理流程�,建議型號(hào)規(guī)格要盡可能多覆蓋以免影響上市銷售
單元?jiǎng)澐值淖⒁馐马?xiàng)
1�、由功能和性能指標(biāo)共同決定:
2�、核心是功能;
3、不可出現(xiàn)子包含母。
單元?jiǎng)澐峙c研發(fā)過程管理(DHFIDMRIDHR):單元?jiǎng)澐值慕Y(jié)果應(yīng)作為項(xiàng)目立項(xiàng)輸入和策劃輸入:
單元?jiǎng)澐峙c樣品樣機(jī):
1�、每個(gè)規(guī)格型號(hào)都要有樣機(jī)送檢
2�、注意樣品樣機(jī)的覆蓋和樣品樣機(jī)真實(shí)性問題
(注:樣品3批檢是藥品的,器械不存在)
單元?jiǎng)澐峙c抽檢�、不良事件等:要正確認(rèn)知和面對(duì),發(fā)現(xiàn)缺陷引發(fā)設(shè)計(jì)變更�,產(chǎn)生新的DMR和DHF
思考總結(jié):
1、單元?jiǎng)澐值闹匾?公司經(jīng)營(yíng)�、上市后管理�、外部檢查
2、單元?jiǎng)澐质枪井a(chǎn)品注冊(cè)的戰(zhàn)略決策�,為什么?
3�、同一單元,研發(fā)生產(chǎn)過程管理如何保持真實(shí)合法
4�、單元?jiǎng)澐植町惻c注冊(cè)文檔
有源醫(yī)療器械檢測(cè)的項(xiàng)目:
一�、電磁兼容
二�、生物相容性
三、安規(guī)
制造商如何確定設(shè)備的基本性能?
首先�,制造商需要確認(rèn)該設(shè)備是否有適用的專用安全標(biāo)準(zhǔn)�,如果有適用的專用安全標(biāo)準(zhǔn)�,則制造商需要查看專用安全標(biāo)準(zhǔn)中是否規(guī)定了基本性能,若專用安全標(biāo)準(zhǔn)中對(duì)該類設(shè)備規(guī)定了基本性能�,則制造商認(rèn)定的基本性能至少應(yīng)包括專用安全標(biāo)準(zhǔn)中規(guī)定的基本性能。除專用安全標(biāo)準(zhǔn)中規(guī)定的基本性能外�,制造商通過風(fēng)險(xiǎn)管理過程可認(rèn)定更多的基本性能�。
如果該設(shè)備沒有適用的專用安全標(biāo)準(zhǔn)或?qū)S冒踩珮?biāo)準(zhǔn)中沒有規(guī)定基本性能,則制造商通過風(fēng)險(xiǎn)管理過程認(rèn)定哪些性能是基本性能或者認(rèn)定該設(shè)備沒有基本性能�。(基本性能:與基本安全不相關(guān)的臨床功能的性能,其喪失或降低到超過制造商規(guī)定的限值會(huì)導(dǎo)致不可接受的風(fēng)險(xiǎn)�。)
有源醫(yī)療器械電磁兼容檢測(cè)
相關(guān)標(biāo)準(zhǔn):YY 9706.102
1.有源非植入設(shè)備EMC標(biāo)準(zhǔn):
YY 9706.102-2021(idtIEC 60601-1-2)醫(yī)用電氣設(shè)備 第1-2部分:基本安全和基本性能的通用要求 并列標(biāo)準(zhǔn):電磁兼容 要求和試驗(yàn)(國(guó)際標(biāo)準(zhǔn)最新版:IEC60601-1-2/AMD1)2.有源植入設(shè)備EMC標(biāo)準(zhǔn):
GB16174.1(idtISO14708-1)手術(shù)植入物 有源植入式醫(yī)療器械第1部分:安全�、標(biāo)記f和制造商所提供信息的通用要求(國(guó)際標(biāo)準(zhǔn)最新版:ISO14708-1)IS0 14117 Active implantable medical devices-Electromagnetic compatibility-EMCtest protocols for implantable cardiac pacemakers, implantable cardioverter defibrillatorsand cardiac resynchronization devices(有源植入式醫(yī)療器械 電磁兼容性 植入式心臟起搏器�、植入式心律轉(zhuǎn)復(fù)除顫器和心臟再同步器械的電磁兼容測(cè)試細(xì)則)
電磁兼容送檢資料:
1、送檢樣品及附件:主機(jī)�,包括產(chǎn)品配套使用的附件(注冊(cè)單元中全部配件),如互聯(lián)電纜�、腳踏開關(guān)�、適配器�、電腦、測(cè)試軟件�。
2�、測(cè)試工裝:樣品按照運(yùn)行模式工作所需的實(shí)驗(yàn)裝置(包括模擬器)�,且在其實(shí)驗(yàn)過程中不應(yīng)引入額外的電磁騷擾�。若EUT為附件(如壓力傳感器、血氧探頭等)�,需提供符合EMC標(biāo)準(zhǔn)要求的輔助主機(jī)和輔助設(shè)備�。
3、技術(shù)要求:一般要包括符合電磁兼容通用標(biāo)準(zhǔn)及相關(guān)專用標(biāo)準(zhǔn)
4�、使用�、技術(shù)說明書:應(yīng)包括電磁兼容標(biāo)準(zhǔn)中規(guī)定的相關(guān)內(nèi)容。
5�、EMC檢測(cè)報(bào)告
6�、電磁兼容資料審查表
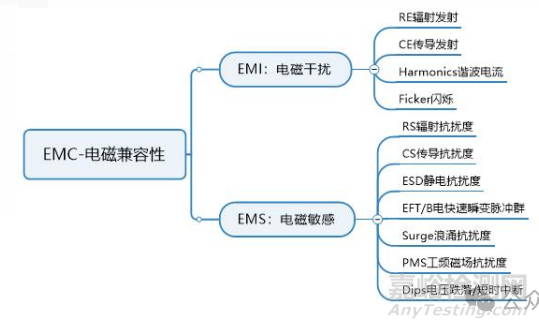
醫(yī)療器械的電磁兼容測(cè)試主要分為兩部分,EM:電磁干擾測(cè)試樣機(jī)本身對(duì)外的一個(gè)電磁輻射,EMS:電磁抗擾測(cè)試樣機(jī)是否能承受一定的外界電磁干擾�。
電磁兼容(EMC)測(cè)試項(xiàng)目有:輻射騷擾、傳導(dǎo)騷擾�、諧波電流\電壓波動(dòng)�、靜電放電、輻射抗干擾�、電快速瞬變?nèi)好}沖�、浪涌�、傳導(dǎo)抗干擾�、工頻磁場(chǎng)�、電壓跌落和中斷。
二�、有源醫(yī)療器械生物相容性測(cè)試
相關(guān)標(biāo)準(zhǔn):IS010993�、GB/T16886
生物相容性測(cè)試項(xiàng)目:
1�、細(xì)胞毒性試驗(yàn):GBIT 16886.5&ISO 10993-5醫(yī)療器械生物學(xué)評(píng)價(jià)第5部分:體外細(xì)胞毒性試驗(yàn)
2、皮膚刺激試驗(yàn):GB/T 16886.10&ISO 10993-10
醫(yī)療器械生物學(xué)評(píng)價(jià)第10部分:刺激與遲發(fā)型超敏反應(yīng)試驗(yàn)
3�、致敏試驗(yàn):GBIT 16886.10&ISO 10993-10
醫(yī)療器械生物學(xué)評(píng)價(jià)第10部分:刺激與遲發(fā)型超敏反應(yīng)試驗(yàn)
三�、有源醫(yī)療器械安規(guī)檢測(cè)
相關(guān)標(biāo)準(zhǔn):GB 9706.1�、GB16174.1
1.有源非植入設(shè)備安規(guī)標(biāo)準(zhǔn):
GB 9706.1(idt IEC 60601-1,ED3.1)醫(yī)用電氣設(shè)備的安全要求 第1部分:通用要求(國(guó)際標(biāo)準(zhǔn)最新版:IEC60601-1)
2.有源植入設(shè)備安規(guī)標(biāo)準(zhǔn):
GB16174.1(idt ISO14708-1)手術(shù)植入物 有源植入式醫(yī)療器械 第1部分:安全�、標(biāo)記和制造商所提供信息的通用要求(國(guó)際標(biāo)準(zhǔn)最新版:ISO14708-1)
安規(guī)及產(chǎn)品環(huán)境檢測(cè)項(xiàng)目有:
溫升測(cè)試�、耐壓測(cè)試、功率測(cè)試�、漏電流測(cè)試�、絕緣阻抗測(cè)試、跌落測(cè)試�、壽命測(cè)試�、漏電起痕測(cè)試�、灼熱絲測(cè)試�、針焰測(cè)試、燃燒測(cè)試�、低溫測(cè)試、高溫測(cè)試�、高低溫沖擊測(cè)試�、震動(dòng)測(cè)試、沖擊測(cè)試�、防水測(cè)試�、防塵測(cè)試等。
產(chǎn)品注冊(cè)檢驗(yàn)報(bào)告注意事項(xiàng):
1�、典型性型號(hào)選取(性能�、電氣安全、電磁兼容)
2�、電氣安全報(bào)告和電磁兼容報(bào)告關(guān)聯(lián)(整改)
3、完整包括所有附件類型
4�、與產(chǎn)品技術(shù)要求一致(指標(biāo)和試驗(yàn)方法)
5�、與IEC報(bào)告一致
6、電磁兼容報(bào)告內(nèi)容與說明書電磁兼容性能一致
有源醫(yī)療器械的使用期限研究應(yīng)貫穿整個(gè)產(chǎn)品生命周期,生產(chǎn)企業(yè)應(yīng)在生產(chǎn)研發(fā)過程中�,通過風(fēng)險(xiǎn)分析動(dòng)態(tài)考慮產(chǎn)品的使用期限;在注冊(cè)申請(qǐng)時(shí)�,按照相關(guān)法規(guī)要求在研究資料、說明書及標(biāo)簽樣稿中聲明有源醫(yī)療器械的使用期限�,同時(shí)應(yīng)在產(chǎn)品的風(fēng)險(xiǎn)分析資料中予以考慮。由于不同產(chǎn)品的使用期限的影響因素不同�,其使用期限的聲明并不限于用時(shí)間段來(lái)表示�,還可以用使用次數(shù)來(lái)表示�,也可以通過臨床使用情況將次數(shù)換算為時(shí)間段�。同時(shí),應(yīng)給出產(chǎn)品的使用環(huán)境條件�、使用頻率等影響因素�。一般情況下也應(yīng)提供關(guān)鍵部件的使用期限,如X射線計(jì)算機(jī)體層攝影設(shè)備,應(yīng)在明確該產(chǎn)品使用期限的同時(shí)�,明確其關(guān)鍵部件管組件在何種使用條件下的曝光次數(shù)。若產(chǎn)品發(fā)生與使用期限相關(guān)的變更時(shí)�,應(yīng)重新考慮各影響因素對(duì)使用期限的影響�。
有源醫(yī)療器械相關(guān)法規(guī):
《有源醫(yī)療器械使用期限注冊(cè)技術(shù)審查指導(dǎo)原則》
《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》
(一)有源醫(yī)療器械使用期限是指由醫(yī)療器械注冊(cè)申請(qǐng)人/注冊(cè)人通過風(fēng)險(xiǎn)管理保證產(chǎn)品安全有效使用的期限�,在該期限內(nèi)產(chǎn)品能夠維持其適用范圍�。
失效目期是使用期限的終止�,該時(shí)間節(jié)點(diǎn)之后�,醫(yī)療器的安全有效性將不能被保證。有源醫(yī)療器械使用期限自器械形成終產(chǎn)品之日起至失效日期止�,既要考慮器械投入使用之前的時(shí)間段�,也要考慮器械投入使用之后的時(shí)間段。
(二)有源醫(yī)療器械預(yù)期使用期限是指由醫(yī)療器械注冊(cè)申請(qǐng)人在上市前通過風(fēng)險(xiǎn)管理保證產(chǎn)品安全有效使用的預(yù)期期限�,在該期限內(nèi)產(chǎn)品能夠維持其適用范圍�。
1、有效期:是性能指標(biāo)有效�,是設(shè)計(jì)開發(fā)驗(yàn)證出來(lái)的,自開封日算�,不直接標(biāo)時(shí)間或幾年;
2�、使用期限:是設(shè)計(jì)開發(fā)驗(yàn)證出來(lái)的,投入使用開始算�,未開封未出廠都不屬于使用期限;一次性產(chǎn)品打開包裝即刻結(jié)束�、無(wú)菌產(chǎn)品滅菌日開始算,無(wú)菌屏障破壞結(jié)束�,有源醫(yī)療器械的某一安全相關(guān)特性或所聲稱的性能可能隨時(shí)間推移而退化,則該器械需提供“使用期限"
3�、失效日期:無(wú)法發(fā)揮效果的期限,是使用期限的終止�,無(wú)源醫(yī)療器多是失效日期。
4�、生產(chǎn)日期:可以是關(guān)鍵物料投料日期�、滅菌前后:滅菌批號(hào)和日期,訂單日期�、配料日期、包裝日期�、完工日期等自行制定�,不是絕對(duì)值,不與實(shí)際日歷日期對(duì)應(yīng);5�、生產(chǎn)批號(hào):追溯程序文件下級(jí)文件批與批號(hào)管理規(guī)定(涉密);批號(hào)不是必須的�,但要可追溯;批號(hào)組成�,制定規(guī)則,要有說法;批號(hào)日期與生產(chǎn)日期不一定對(duì)應(yīng);
6�、出廠日期:產(chǎn)品發(fā)出去的日期
7�、壽命期:制造商規(guī)定的醫(yī)療器械預(yù)期保持安全和有效使用的最長(zhǎng)時(shí)間,即器械無(wú)法達(dá)到預(yù)期用途之前的實(shí)際使用持續(xù)時(shí)間�。
6、有源醫(yī)療器械注冊(cè)申報(bào)資料要求與常見問題
產(chǎn)品基本信息
一�、產(chǎn)品名稱
二、管理類別
三�、注冊(cè)人名稱
四、注冊(cè)人住所
五�、生產(chǎn)地址
六�、代理人名稱
七、代理人住所
八�、代理人所在省/直轄市
一�、產(chǎn)品名稱
(涉及所有申報(bào)資料)
審查重點(diǎn):是否通用名、是否與境外上市證明一致
通用名稱應(yīng)包含一個(gè)核心詞及不超過三個(gè)特征詞�。核心詞應(yīng)包含基本技術(shù)原理�,如“超聲""激光”等“高頻”特征詞是對(duì)醫(yī)療器械使用部位、結(jié)構(gòu)特點(diǎn)�、技術(shù)特點(diǎn)或者材料組成等特定屬性的描述�。如“皮膚”"眼科”"經(jīng)顱""一次性使用"“單、雙極”"磁共振引導(dǎo)"“手持式""“綜合"“電腦”“數(shù)字化"�。盡量避免使用無(wú)意義用詞�,如“多功能
例子:
一次性使用內(nèi)窺鏡高頻手術(shù)器械。其中“一次性”為體現(xiàn)特異性的特征詞�,“內(nèi)窺鏡”為體現(xiàn)臨床使用的特征詞,無(wú)體現(xiàn)技術(shù)特點(diǎn)的特征詞�,“高頻手術(shù)器械”為核心詞
管理類別
申請(qǐng)表�、綜述資料�、注冊(cè)證編號(hào)
管理類別一般可參照分類目錄確定�,若產(chǎn)品不在分類目錄內(nèi)可向標(biāo)管中心申請(qǐng)分類界定也可以按照第三類申報(bào),在出審評(píng)報(bào)告時(shí)會(huì)給出產(chǎn)品的管理類別�。
三、注冊(cè)人名稱�、注冊(cè)人住所�、生產(chǎn)地址
申請(qǐng)表、境外上市證明�、生產(chǎn)企業(yè)資格證明、營(yíng)業(yè)執(zhí)照�、說明書OEM協(xié)議�、境外檢測(cè)報(bào)告�、省局體系核查報(bào)告一致!!
1�、外文相同地址在不同文件中的描述不同可出具解釋聲明�。
2、所有生產(chǎn)地址要在申報(bào)資料中全部列出�,不同地址生產(chǎn)部件不同�,如附件的生產(chǎn)分在多個(gè)地址的要全部分別列出。
3�、委托生產(chǎn)要按照規(guī)定在申報(bào)資料中明確列出�,包括說明書、生產(chǎn)場(chǎng)地信息;申報(bào)資料應(yīng)提交委托方和受托方簽署的委托生產(chǎn)合同�、受托方取得的受托生產(chǎn)醫(yī)療器械相應(yīng)生產(chǎn)范圍的生產(chǎn)許可證�。
7�、有源醫(yī)療器械注冊(cè)審核要點(diǎn)
審評(píng)要點(diǎn)
一、產(chǎn)品描述
二�、產(chǎn)品其他信息
三�、綜述資料
四、產(chǎn)品安全性�、有效性主要評(píng)價(jià)內(nèi)容
一�、產(chǎn)品描述、
1�、產(chǎn)品結(jié)構(gòu)及組成
申請(qǐng)表�、綜述資料�、研究資料�、檢測(cè)報(bào)告
1 新版注冊(cè)證與舊版相比,刪除了性能的描述
描述產(chǎn)品的實(shí)際組成部分�,不要寫“光學(xué)系統(tǒng)”“控制系統(tǒng)"“機(jī)械系統(tǒng)”�。可如此描述:眼科光學(xué)相千斷層掃描儀可描述為”該產(chǎn)品主要由光學(xué)主機(jī)�、電源部分、額托部分�、眼前節(jié)適配器(可選)�、非嵌入式軟件(如有)”。
3 不要寫“等“�。
4 是臨床評(píng)價(jià)資料同品種判定的重要依據(jù)�。
5 不同部分組成應(yīng)包括產(chǎn)品型號(hào)標(biāo)注。如:該產(chǎn)品由主機(jī)(WB91051C)�、雙踏板腳踏開關(guān)(WB50402W)及選配件單踏板腳踏開關(guān)(WB50403W)和電纜線(WA00014A)組成
6 以產(chǎn)品的綜述資料為依據(jù)�,描述實(shí)現(xiàn)產(chǎn)品臨床預(yù)期用途所必須的模塊,示意圖應(yīng)能全面反映各個(gè)結(jié)構(gòu)及組成�。
7 研究資料中應(yīng)全面評(píng)價(jià)產(chǎn)品組成的每個(gè)模塊�。容易遺漏的評(píng)價(jià)內(nèi)容有性能指標(biāo)(帶灌注功 能的高頻電刀)�、生物相容性�、消毒滅菌有效期。
若產(chǎn)品包含上位機(jī)軟件和下位機(jī)軟件�,軟件資料應(yīng)分別評(píng)價(jià)9�、檢測(cè)報(bào)告應(yīng)全面包括所有 部8件,尤其是選配件�。EMC報(bào)告還要包含配合使用的產(chǎn)品。
一�、產(chǎn)品描述
2�、產(chǎn)品適用范圍
申請(qǐng)表、綜述資料�、臨床評(píng)價(jià)資料�、說明書
可簡(jiǎn)要描述產(chǎn)品的工作原理,適用范圍應(yīng)與所提供的臨床評(píng)價(jià)資料中相應(yīng)內(nèi)容一致�,描述用 語(yǔ)應(yīng)規(guī)范且通順,表述應(yīng)準(zhǔn)確具體�,避免采用口語(yǔ)化的語(yǔ)言和寬泛的描述�,且應(yīng)符合臨床表述規(guī)范 如:本產(chǎn)品利用高頻電流對(duì)組織進(jìn)行切割和凝血。
特殊的使用環(huán)境應(yīng)明確(如家庭用理療設(shè)備)或有配合使用的計(jì)算機(jī)(眼科儀器)�、其他醫(yī)療器 械(電子內(nèi)窺鏡)�、藥物(光敏劑)等�,應(yīng)予以明確�,描述為"該產(chǎn)品與XXX配合使用,用于XXX"
禁忌癥如有必要需寫明�。
4 應(yīng)明確治療或診斷部位�。
例:內(nèi)窺鏡適用范圍的描述應(yīng)明確成像的部位,對(duì)于腹腔鏡�,描述為“用于腹部檢査和手術(shù)中觀察成像”5 對(duì)于進(jìn)口產(chǎn)品�,不應(yīng)超出原產(chǎn)國(guó)上市時(shí)所批準(zhǔn)的范圍,但可對(duì)其進(jìn)行適當(dāng)?shù)恼{(diào)整�。
6 臨床資料應(yīng)全面支持適用范圍。
例:帶灌注功能的高頻電刀�、低頻刺激器(失眠�、抑郁)
臨床評(píng)價(jià)資料核心思想是在正常使用條件下,產(chǎn)品可達(dá)到預(yù)期性能:與預(yù)期受益相比較�,產(chǎn)品的風(fēng)險(xiǎn) 可接受;產(chǎn)品的臨床性能和安全性均有適當(dāng)?shù)淖C據(jù)支持�。8 對(duì)于特殊的使用方式,可依據(jù)實(shí)際情況對(duì)適用范圍加以限定如等離子手術(shù)設(shè)備應(yīng)增加"在生理鹽水或.......環(huán)境下使用”�、大血管閉合設(shè)備還應(yīng)明確其能夠閉合血管的最大直徑。
一�、產(chǎn)品描述
3�、規(guī)格型號(hào)
申請(qǐng)表�、綜述資料�、檢測(cè)報(bào)告�、說明書�、產(chǎn)品技術(shù)要求
綜述資料體現(xiàn)不同規(guī)格型號(hào)之間的差異,最好是列表說明�。
要全面包含所有申報(bào)的規(guī)格型號(hào)�,不要遺漏附件
3所有規(guī)格型號(hào)應(yīng)在一個(gè)注冊(cè)單元中。(變更)
檢測(cè)要覆蓋所有規(guī)格型號(hào)�,可以選取具有典型性的產(chǎn)品檢測(cè)
5 產(chǎn)品技術(shù)要求的性能指標(biāo)要全面,可標(biāo)明某一型號(hào)適用
注冊(cè)證規(guī)格型號(hào)欄中會(huì)寫見產(chǎn)品技術(shù)要求的型號(hào)規(guī)格內(nèi)容9
7 每個(gè)型號(hào)的軟件版本都應(yīng)給出�。如有些低配型號(hào)用軟件屏蔽了部分功能
二�、產(chǎn)品其他信息
1、境外上市銷售的證明文件
2�、質(zhì)量體系審查結(jié)論
3�、其他需要說明的產(chǎn)品信息
4、符合性聲明
三�、綜述資料
產(chǎn)品基本信息�、研發(fā)參考產(chǎn)品
1、工作原理
2�、產(chǎn)品圖示�,應(yīng)當(dāng)給出設(shè)備的整體及前�、后面板的圖示及詳細(xì)說明�,明確體現(xiàn)面板上各按鍵、顯示�、插口及標(biāo)識(shí)符號(hào)的位置和名稱同時(shí)提供上述各項(xiàng)內(nèi)容的說明列表。
3�、研發(fā)背景和目的(常規(guī)成熟產(chǎn)品可不寫,如有改進(jìn)或新產(chǎn)品建議描寫�,主要是臨床意義�,所解決的臨床問題),產(chǎn)品區(qū)別于其他同類產(chǎn)品的特征�。(例如內(nèi)窺鏡視場(chǎng)角變大)
4、關(guān)鍵元器件和核心工藝�,給出設(shè)備整體的硬件結(jié)構(gòu)圖和元件圖�。
5、與已上市的前代產(chǎn)品對(duì)比�。尤其是對(duì)模塊獨(dú)立的產(chǎn)品來(lái)講,新的產(chǎn)品通常都是在前代產(chǎn)品的基礎(chǔ)上改進(jìn)而來(lái)�,這樣針對(duì)原有模塊和新的模塊提交綜述資料和研究資料就可以有所區(qū)別如:高頻電刀、超聲發(fā)生器�、手術(shù)器械的生物相容性。
6�、對(duì)于結(jié)構(gòu)組成中含有外購(gòu)附件的產(chǎn)品,應(yīng)給出外購(gòu)部分的上市證明�。
四、產(chǎn)品安全性有效性的主要評(píng)價(jià)內(nèi)容
1�、非臨床研究
2�、產(chǎn)品技術(shù)要求
3�、產(chǎn)品注冊(cè)檢驗(yàn)報(bào)告
4、臨床評(píng)價(jià)
5�、產(chǎn)品風(fēng)險(xiǎn)分析資料
6、產(chǎn)品說明書和標(biāo)簽樣稿
四�、產(chǎn)品安全性有效性的主要評(píng)價(jià)內(nèi)容
研究資料
1、非臨床研究
1 產(chǎn)品主要性能指標(biāo)研究
2動(dòng)物研究�、模擬使用研究
3 其他資料�、藥物相容性、藥械組合
1�、非臨床研究
1)產(chǎn)品主要性能指標(biāo)研究
一�、可進(jìn)行客觀判定的成品的功能性、安全性指標(biāo)以及與質(zhì)量控制相關(guān)的指標(biāo)�。對(duì)應(yīng)產(chǎn)品技術(shù)要求
1、以國(guó)家標(biāo)準(zhǔn)或行業(yè)標(biāo)準(zhǔn)為依據(jù)�。如果重復(fù)以最嚴(yán)格的為準(zhǔn)2、標(biāo)準(zhǔn)要求生產(chǎn)企業(yè)制定的指標(biāo)�,那要給出確定的值和制定的依據(jù)如:冷光源的光照均勻性指標(biāo)要求實(shí)測(cè)值不大于規(guī)定值的1.05倍3、對(duì)于沒有相關(guān)標(biāo)準(zhǔn)或標(biāo)準(zhǔn)中沒有要求的指標(biāo)應(yīng)給出制定依據(jù)和驗(yàn)證資料關(guān)注未發(fā)布的行業(yè)標(biāo)準(zhǔn)和技術(shù)指導(dǎo)原則�。4、安全要求:符合GB9706.1-2007�、XXXX、YY0505-2012等通用安全及專用安全的要求�。
1�、非臨床研究
1)產(chǎn)品主要性能指標(biāo)研究
二、生物相容性的研究
1�、對(duì)產(chǎn)品分析全面
覆蓋所有接觸人體的部分、接觸類型
使用者和患者
2�、對(duì)材料介紹清楚�,不僅包括名稱,還應(yīng)有成分�、不銹鋼牌號(hào)
3、提交完整版的試驗(yàn)報(bào)告�,提交實(shí)驗(yàn)室資質(zhì)�。
4、345號(hào)文對(duì)原材料的控制要求及檢驗(yàn)標(biāo)準(zhǔn)制造過程/工藝
同類產(chǎn)品中相同材料上市后臨床使用情況
總結(jié)結(jié)果
1�、非臨床研究
1)產(chǎn)品主要性能指標(biāo)研究
三�、消毒�、滅菌工藝研究( 與說明書相關(guān)內(nèi)容對(duì)應(yīng))
1�、生產(chǎn)企業(yè)滅菌:應(yīng)明確滅菌工藝(方法和參數(shù))和無(wú)菌保證水平(SAL),并提供滅菌確認(rèn)報(bào)告
2�、終端用戶滅菌:應(yīng)當(dāng)明確推薦的滅菌工藝(方法和參數(shù))及所推薦的滅菌方法確定的依據(jù):對(duì)可耐受兩次或多次滅菌的產(chǎn)品�,應(yīng)當(dāng)提供產(chǎn)品相關(guān)推薦的滅菌方法耐受性的研究資料。
3�、殘留毒性:如滅菌使用的方法容易出現(xiàn)殘留應(yīng)當(dāng)明確殘留物信息及采取的處理方法,并提供研究資料
4�、終端用戶消毒:應(yīng)當(dāng)明確推薦的消毒工藝(方法和參數(shù)以及所推薦消毒方法確定的依據(jù)�。
1�、非臨床研究
1)產(chǎn)品主要性能指標(biāo)研究
四、有效期�、包裝的研究
一次性無(wú)菌器械:貨架有效期
提供有效期內(nèi)產(chǎn)品無(wú)菌�、包裝完整性、保持性能指標(biāo)的證明資料�。可重復(fù)消毒滅菌器械:次數(shù)
不同消毒滅菌方法下器械可經(jīng)受的可重復(fù)使用次數(shù)�,需證明文件�。有源醫(yī)療器械:期限運(yùn)輸過程中包裝的保護(hù)
一定條件下,生產(chǎn)企業(yè)確認(rèn)產(chǎn)品可正常使用的期限�,并且在哪些條件下可以繼續(xù)使用,繼續(xù)使用的判斷理由和責(zé)任方有效期驗(yàn)證資料的差別。
1�、非臨床研究
1)產(chǎn)品主要性能指標(biāo)研究
五�、軟件資料
1、《醫(yī)療器械軟件注冊(cè)技術(shù)審查指導(dǎo)原則》
2�、應(yīng)當(dāng)給出縣關(guān)于軟件版本命名規(guī)則的聲明,明確軟件版本的全部字段及字段含義,確定軟件的完整版本和發(fā)布版本�。
3�、軟件的上市歷史要完整�,并與上市證明資料相對(duì)應(yīng)。
4�、對(duì)未封閉的風(fēng)險(xiǎn)應(yīng)列表說明并進(jìn)行風(fēng)險(xiǎn)收益的評(píng)估。
5�、提及的附件文件要全部提交
1�、非臨床研究
2)動(dòng)物研究、模擬使用研究
組織熱損傷的研究
1�、圖片要清晰�,不同模式之間要有區(qū)別:對(duì)損傷程度析,如尺寸�、顏色、深度�。
2�、組織類型要對(duì)應(yīng)實(shí)際應(yīng)用�。肌肉�、脂肪�、肝臟。
3�、覆蓋要全面:功率的最大輸出和最典型輸出
附件類型工作時(shí)間
4、與實(shí)際臨床應(yīng)用相同�。是表面燒灼還是穿刺燒灼
2�、產(chǎn)品技術(shù)要求
《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》
1�、格式、內(nèi)容參照以上文件
2�、產(chǎn)品技術(shù)要求中的性能指標(biāo)應(yīng)明確具體要求�,不應(yīng)以“見隨附資料””按供貨合同”等形式提供�。
3�、明確的指標(biāo)�,唯一的試驗(yàn)方法�,具有可重復(fù)性�。
4�、產(chǎn)品直接采用國(guó)家標(biāo)準(zhǔn)或行業(yè)標(biāo)準(zhǔn)的�,可以直接列明標(biāo)準(zhǔn)名稱及版本�,無(wú)須逐條引用。
5�、標(biāo)準(zhǔn)引用全面,注意標(biāo)準(zhǔn)更新版本�。
6�、產(chǎn)品型號(hào)/規(guī)格及其劃分說明”中明確軟件的名稱、型號(hào)規(guī)格發(fā)布版本和版本命名規(guī)則8�、性能指標(biāo)應(yīng)包括軟件的全部臨床功能9�、試驗(yàn)條件應(yīng)給出�,但不用編號(hào)
7、附錄產(chǎn)品主要安全特征要在正文中引用
8�、環(huán)境試驗(yàn)
9、電子版
3�、產(chǎn)品注冊(cè)檢驗(yàn)報(bào)告
1�、典型性型號(hào)選取(性能�、電氣安全�、電磁兼容)�。
2、電氣安全報(bào)告和電磁兼容報(bào)告關(guān)聯(lián)(整改)�。
3、完整包括所有附件類型�。
4�、與產(chǎn)品技術(shù)要求一致(指標(biāo)和試驗(yàn)方法)�。
5�、與IEC報(bào)告一致。
6�、電磁兼容報(bào)告內(nèi)容與說明書電磁兼容性能一致。
4�、臨床評(píng)價(jià)
1�、臨床評(píng)價(jià)應(yīng)對(duì)產(chǎn)品的適用范圍(如適用人群�、適用部位�、與人體接觸方式�、適應(yīng)癥、疾病的程度和階段�、使用要求�、使用環(huán)境等)�、使用方法、禁忌癥�、防范措施、警告等臨床使用信息進(jìn)行確認(rèn)�。
2�、注冊(cè)申請(qǐng)人通過臨床評(píng)價(jià)應(yīng)得出以下結(jié)論:在正常使用條件下,產(chǎn)品可達(dá)到預(yù)期性能,與預(yù)期受益相比較�,產(chǎn)品的風(fēng)險(xiǎn)可接受,產(chǎn)品的臨床性能和安全性均有適當(dāng)?shù)淖C據(jù)支持
5�、產(chǎn)品風(fēng)險(xiǎn)分析資料
產(chǎn)品風(fēng)險(xiǎn)分析資料是對(duì)產(chǎn)品的風(fēng)險(xiǎn)管理過程及其評(píng)審的結(jié)果予以記錄所形成的資料。
應(yīng)當(dāng)提供對(duì)于每項(xiàng)已判定危害的下列各個(gè)過程的可追溯性�。
1�、描述風(fēng)險(xiǎn)分析資料的情況。
2�、對(duì)產(chǎn)品上市可能帶來(lái)的風(fēng)險(xiǎn)進(jìn)行分析、評(píng)價(jià)�。
3、采取的合理的風(fēng)險(xiǎn)控制方案�,剩余風(fēng)險(xiǎn)是否在可接受范圍內(nèi)�。
4、并在產(chǎn)品說明書“注意事項(xiàng)”中對(duì)產(chǎn)品使用可能帶來(lái)的風(fēng)險(xiǎn)進(jìn)行了特殊說明�。
5、產(chǎn)品風(fēng)險(xiǎn)分析資料符合YY/T0316的要求�。
6、結(jié)論收益大于風(fēng)險(xiǎn)�。