非臨床安全性研究很重要的一個目的是確定藥物的毒性靶器官、毒性表現(xiàn)����,并發(fā)現(xiàn)可用于計算首次人體試驗(yàn)的劑量��,支持藥物臨床開發(fā)�����。NOAEL(No Observed Adverse Effect Level,未見明顯毒性反應(yīng)劑量)在健康成年志愿者首次臨床試驗(yàn)藥物最大推薦起始劑量估算過程中發(fā)揮主導(dǎo)作用��。除了NOAEL��,MABEL(minimal anticipated biological effect level)����、HNSTD(highest non-severely toxic dose)、STD10(severely toxic dose in 10% of the animals)也被用來作為某些藥物首次人體試驗(yàn)起始劑量的計算����。無論何種計算路徑��,對于非臨床研究中的異常發(fā)現(xiàn)是adverse�����、non-adverse的判定都是核心����,而這一鑒別又頗具挑戰(zhàn)�����,有時偏主觀��。本文結(jié)合FDA�����、Amgen�����、Gilead����、Celldex Therapeutics等團(tuán)隊最新觀點(diǎn)����,圍繞毒性反應(yīng)�����、NOAEL判定原則����、挑戰(zhàn)�����、案例進(jìn)行分享�����。
首先看下對于adverse effect的定義�����,來自兩個版本��。
European Society of Toxicologic Pathology: An adverse effect is a test item-related change in the morphology, physiology, growth, development, reproduction or life span of the animal model that likely results in an impairment of functional capacity to maintain homeostasis and/or an impairment of the capacity to respond to an additional challenge.
The Illustrated Dictionary of Toxicologic Pathology and Safety Science: adverse effects (in toxicology studies) are any changes related to treatment with a test substance that are considered as potentially harmful to the well-being of the test species, resulting in dysfunction, or negatively impacting the ability of an animal to thrive or develop normally.
兩個版本來源的定義描述不同��,但底層邏輯類似�����,首先是需要發(fā)現(xiàn)一些changes�����,或許是與平行對照比����,或者與歷史背景數(shù)據(jù)比����,或者通過劑量依賴性關(guān)系判定。其次����,需要對發(fā)現(xiàn)的changes進(jìn)行定性��,是否影響了動物的某些功能��、生長��、發(fā)育等等�����。
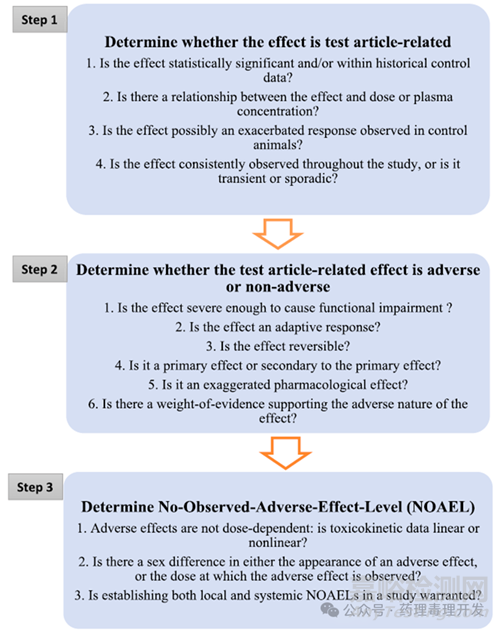
關(guān)于NOAEL的確定����,通常采用“三步法”��,如下圖所示�����。
第一步:確定是否是供試品相關(guān)的作用
關(guān)于這點(diǎn),可以從4個問題驅(qū)動��,輔助判斷����。
1��、是否在歷史對照數(shù)據(jù)范圍內(nèi)和/或具有統(tǒng)計學(xué)意義����?
對于定量數(shù)據(jù)�����,首先應(yīng)進(jìn)行統(tǒng)計學(xué)分析��,看下高劑量與對照組��、低劑量之間的統(tǒng)計學(xué)差異�����。尤其是嚙齒類動物�����,每組動物數(shù)量多�����,且遺傳同質(zhì)性好��,更適用于均值比較和統(tǒng)計分析。對于非嚙齒類動物�����,由于每組動物數(shù)量少��,個體動物發(fā)現(xiàn)有時比均值更有意義����。建議從總體證據(jù)考量發(fā)現(xiàn)的毒性����,而不是單一指標(biāo)的變化,比如肝臟生化指標(biāo)的變化是否伴隨大體解剖����、組織病理學(xué)檢查的異常�����。
當(dāng)然�����,并不是所有毒理學(xué)終點(diǎn)都可進(jìn)行統(tǒng)計運(yùn)算����,如組織病理學(xué)檢查中的發(fā)生率和嚴(yán)重程度通常不進(jìn)行統(tǒng)計分析����。類似這種情況�����,需要結(jié)合平行設(shè)置的對照組表現(xiàn)和歷史對照數(shù)據(jù)進(jìn)行結(jié)果判定����。這里就比較考驗(yàn)每個機(jī)構(gòu)歷史對照數(shù)據(jù)的質(zhì)量了����。
2�����、是否有劑量/暴露量-反應(yīng)關(guān)系?
雖然不絕對��,但絕大多數(shù)毒性發(fā)現(xiàn)����,如果無劑量或暴露量相關(guān)性,與供試品相關(guān)的可能性通常較低��。從藥代動力學(xué)角度�����,藥物暴露量(AUC或Cmax)隨著給藥劑量升高而升高,但涉及吸收或消除飽和�����,劑量和暴露量的升高不一定成比例�����。一般毒理研究中會伴隨毒代動力學(xué)研究����,可同時結(jié)合劑量/暴露量數(shù)據(jù)����,分析與毒性發(fā)生率����、嚴(yán)重程度的相關(guān)性����。特別提示兩點(diǎn)�����,有些毒性反應(yīng)如功能組合試驗(yàn)(functional observational batteries)����、心電圖����、血壓對血藥濃度更敏感����,建議結(jié)合Cmax分析。另外��,有些毒性如果僅在高劑量出現(xiàn)�����,低��、中劑量未見�����,且暴露量是線性增加的�����,也提示該毒性反應(yīng)為供試品相關(guān)��。
3��、給藥組的反應(yīng)是否比對照組觀察到的更嚴(yán)重��?
非臨床研究用動物通常都會有背景病變��,因這種病變的發(fā)生類型����、發(fā)生率和嚴(yán)重程度不同����,平行設(shè)置的對照組動物并不一定能客觀反映背景病變情況。舉個例子��,一項6個月SD大鼠重復(fù)給藥毒性試驗(yàn)中��,雌性動物觀察到頻率和嚴(yán)重程度均呈劑量相關(guān)性的腎上腺皮質(zhì)囊性變性��,雄性動物呈現(xiàn)類似發(fā)生率的多灶性腎上腺皮質(zhì)空泡化,平行設(shè)置的對照組動物未見類似病變�����。腎上腺異常是大鼠年齡相關(guān)性自發(fā)性病變�����,且SD大鼠發(fā)生率更高�����。最后結(jié)論是供試品有可能會加重大鼠腎上腺背景病變�����,但考慮到這一病變是大鼠自發(fā)性年齡相關(guān)改變,不視為毒性反應(yīng)(not considered adverse)。當(dāng)然��,這種結(jié)論的得出需要結(jié)合研究機(jī)構(gòu)的背景數(shù)據(jù)和大量文獻(xiàn)數(shù)據(jù)進(jìn)行討論。
4�����、這一反應(yīng)是在整個研究過程中一直存在��,還是一過性的或偶發(fā)的?
這個問題適用于研究過程中反復(fù)觀測的毒性終點(diǎn)����,比如臨床觀察、體重����、攝食量、臨床病理等��。如果某些臨床癥狀僅在個別動物出現(xiàn)��,并不是在整個研究中出現(xiàn)����,僅是偶發(fā)的,通常不認(rèn)為是供試品暴露引起的����。不過��,這個問題也需要辨證看��,不能將所有一過性�����、偶發(fā)性的毒性發(fā)現(xiàn)�����,均視為非給藥相關(guān)。尤其是臨床病理數(shù)據(jù)����,比如ALT和AST一過性升高,意味著可能的肝細(xì)胞損傷��,隨著給藥繼續(xù)�����,有可能肝細(xì)胞由變性進(jìn)展到壞死��,出現(xiàn)代償性肝細(xì)胞增殖或纖維化,ALT和AST反而回到基線����,不再升高。這種情況����,可以結(jié)合病理或其它肝臟標(biāo)記物一起判斷�����,不可輕易排除。
第二步:確定供試品相關(guān)作用是否是毒性反應(yīng)
關(guān)于這點(diǎn)�����,可以從6個問題驅(qū)動��,輔助判斷����。
1�����、是否足夠嚴(yán)重到引起功能損傷��?
通常體重、攝食量和臨床觀察可以幫助從整體判斷動物的健康狀況����。如果這些參數(shù)的異常關(guān)聯(lián)到動物功能的損傷,則判定為毒性反應(yīng)��。對于什么程度的變化認(rèn)定為異常��,OECD發(fā)布過指導(dǎo)原則《Document on the Recognition, Assessment, and Use of Clinical Signs as Humane Endpoints for Experimental Animals Use in Safety Evaluation》����。以體重為例��,對于非減肥藥物�����,體重降低20%以上通常認(rèn)為是adverse。當(dāng)然��,還是那句話�����,不要孤立的通過一個指標(biāo)輕易下結(jié)論��,結(jié)合對照數(shù)據(jù)����、統(tǒng)計學(xué)��、量效關(guān)系變化、指標(biāo)變化的連續(xù)性等綜合分析�����。
通過臨床病理學(xué)數(shù)據(jù)判定毒性反應(yīng)是有一定挑戰(zhàn)的�����。鈉����、鉀��、鈣�����、葡萄糖、血紅蛋白和血小板�����,視變化程度大小判定是否是毒性反應(yīng)��。單純的ALT����、AST�����、LDH變化通常不視為毒性反應(yīng)��,可以作為組織損傷的biomarker����,需要結(jié)合其它臨床病理參數(shù)及組織病理學(xué)數(shù)據(jù)共同確認(rèn)�����。像總蛋白�����、白蛋白這類體現(xiàn)肝功能的參數(shù)��,低于一定數(shù)值可判定為毒性反應(yīng)��。
組織病理學(xué)檢查結(jié)果根據(jù)病灶病變嚴(yán)重程度進(jìn)行分級����,通常“minimal”不記為毒性反應(yīng)����,“marked”或“severe”則視為毒性反應(yīng)��。也有些特例�����,比如神經(jīng)元壞死的“minimal”分級則視為毒性反應(yīng)����。
2��、是否是適應(yīng)性反應(yīng)��?
為應(yīng)對有毒物質(zhì)的侵犯��,機(jī)體為維持穩(wěn)態(tài)或產(chǎn)生防御����,通常會出現(xiàn)代償性變化,稱之為適應(yīng)性反應(yīng)����。這種適應(yīng)性反應(yīng)通常是快速的、可逆的����,不會對機(jī)體造成損傷��。比如苯巴比妥����、美沙酮、纖維蛋白或肝藥酶誘導(dǎo)劑��,給藥后會出現(xiàn)肝臟重量增加�����、肝變大��、鏡檢可見肝細(xì)胞肥大����,伴隨多次給藥后的藥物暴露量下降��。這類變化如果未引起其它degenerative changes����,通常不視為毒性反應(yīng)��。
3����、反應(yīng)是否可逆?
并不是說部分或完全可逆的反應(yīng)就不視為毒性反應(yīng)����,而是需要結(jié)合所有毒理學(xué)發(fā)現(xiàn)和證據(jù)權(quán)重分析進(jìn)行綜合研判?�?赡嫘钥勺鳛檎w性的一部分����,輔助判斷毒性發(fā)現(xiàn)的嚴(yán)重程度��。
4、是供試品引發(fā)的原發(fā)作用還是繼發(fā)作用����?
首先����,無論是藥物引起的原發(fā)作用,還是由原發(fā)作用進(jìn)一步引發(fā)的繼發(fā)作用����,都會用于評估是否是毒性反應(yīng)��。不過��,有些繼發(fā)作用可以通過人道關(guān)懷、獸醫(yī)護(hù)理等得以改善��。比如藥物可引起犬惡心��,出現(xiàn)流涎�����、嘔吐等癥狀��,繼而導(dǎo)致攝食量降低����、體重下降�����,通過延長食物供給時間����,攝食和體重可恢復(fù)��。這類情況�����,前期動物出現(xiàn)的攝食量和體重異常則不視為毒性反應(yīng)��。
5�����、是否是藥理作用的放大�����?
藥理作用的放大就一定是non-adverse嗎����?答案當(dāng)然是否定的�����。還是要視藥理作用放大的程度及所引發(fā)作用的嚴(yán)重程度而定����。比如免疫激動劑可過度激活免疫系統(tǒng)�����,釋放細(xì)胞因子,并可能出現(xiàn)動物攝食量����、體重下降的情況,甚至導(dǎo)致動物不能耐受��,則可判定為adverse effect��。藥理作用的分類太過寬泛��,這也給藥理作用放大后的adverse��、non-adverse的判定帶來很大挑戰(zhàn)��,比如作用于CNS的藥物引發(fā)的動物平衡����、協(xié)調(diào)失調(diào)��,催眠類藥物可使動物喪失基本能力��。有時很難對這類毒性反應(yīng)進(jìn)行區(qū)分和定性,需要結(jié)合嚴(yán)重程度����、發(fā)生率、發(fā)生的頻率綜合判定����。
6、基于證據(jù)權(quán)重判斷藥物反應(yīng)是否嚴(yán)重到影響器官或機(jī)體的功能
這點(diǎn)還是強(qiáng)調(diào)基于總體的證據(jù)對藥物所致的毒性發(fā)現(xiàn)進(jìn)行綜合分析��。通?�;诙纠碓囼?yàn)中所有可獲得數(shù)據(jù)�����、文獻(xiàn)資料�����,GLP機(jī)構(gòu)的SD會對出現(xiàn)的藥物反應(yīng)的定性有個大致判斷。當(dāng)然����,對于疑問之處,也可與同行�����、顧問����、專家進(jìn)行進(jìn)一步討論。藥企sponsor對藥物的整體縱深了解通常更為全面�����,有比較詳細(xì)的藥效學(xué)�����、藥代動力學(xué)和毒理學(xué)資料��,通常也熟悉同類產(chǎn)品的臨床研究結(jié)果,故與sponsor的充分溝通也是非常關(guān)鍵的��。
第三步:確定NOAEL
NOAEL的確定說簡單也簡單�����,比如中劑量觀測到供試品相關(guān)的毒性反應(yīng)�����,低劑量未觀測到��,則低劑量可定為NOAEL。不過�����,在具體決策過程中還是有3個問題需要思考��。
1、對于毒性反應(yīng)非劑量依賴的情況:暴露量是線性還是非線性?
線性PK的AUC和Cmax隨劑量增加而成比例增加��,表觀分布容積�����、消除半衰期�����、清除率則劑量間表現(xiàn)一致。相反����,非線性PK的AUC和Cmax與劑量的增加不成比例��,表觀分布容積����、消除半衰期、清除率在不同劑量間也有差異����。有時會出現(xiàn)中劑量血藥濃度更高�����,出現(xiàn)毒性反應(yīng)����,高劑量反而血藥濃度降低����,未見毒性反應(yīng)的情況�����,這種情況下的NOAEL應(yīng)定為低劑量。
2��、毒性反應(yīng)是否有性別差異����?
不同性別之間的藥物PK和毒性敏感度不同還是挺常見的����。如果有明確證據(jù)說明這點(diǎn)�����,就需要雌雄動物分別界定NOAEL劑量,取劑量更低者用于臨床起始劑量的計算����。當(dāng)然��,不出意外的話的還是有意外出現(xiàn)����,比如一個藥物臨床僅用于男性����,但毒理試驗(yàn)采用的雙性別動物����,雌性動物低劑量是NOAEL�����,雄性動物則是高劑量為NOAEL��,這種情況自然可以選擇雄性動物的劑量進(jìn)行臨床起始劑量的計算。
3����、是否有必要建立局部和系統(tǒng)NOAEL?
比如藥物低劑量可見注射位點(diǎn)反應(yīng),但無其它毒性發(fā)現(xiàn)����。中劑量既有注射位點(diǎn)反應(yīng),也可見系統(tǒng)的毒性反應(yīng)�����。這類情況的處理方案通常有兩種�����,一種是低劑量定為系統(tǒng)NOAEL����,但標(biāo)注有注射位點(diǎn)反應(yīng)。一種是繼續(xù)探索更低劑量��,無注射位點(diǎn)反應(yīng)的局部NOAEL。關(guān)于注射位點(diǎn)反應(yīng)��,如果不是比較嚴(yán)重的情況��,通常不作為限制性因素影響NOAEL的制定。一是比較容易耐受�����,二是臨床可以給予抗組胺藥或其它藥物干預(yù)。
那有沒有需要界定特定器官NOAEL的情況呢��。比如藥物IND后,監(jiān)管機(jī)構(gòu)對藥物的心臟安全性風(fēng)險有擔(dān)憂�����,要求提供進(jìn)一步數(shù)據(jù)說明����。后續(xù)開展的毒理研究更多聚焦心臟重量�����、心臟毒性的biomarkers��、心臟大體解剖�����、心臟的組織病理學(xué)檢查,未額外開展系統(tǒng)的毒理學(xué)研究,那最終獲得的NOAEL則是心臟特異性的��。不過��,這種情況并不多見�����。
案例分享
案例一
已上市非抗腫瘤藥物增加新給藥途徑,開展28天大鼠靜脈重復(fù)給藥毒理研究。高劑量出現(xiàn)震顫����、步態(tài)改變����、呼吸困難等嚴(yán)重臨床癥狀�����,鏡檢可見肝臟空泡化��、垂體前葉變性。另外,可見劑量相關(guān)性的甲狀腺肥大����。進(jìn)行了TK分析,但未開展甲狀腺激素檢測����。
CRO SD:考慮到中劑量出現(xiàn)較minimal更為嚴(yán)重的甲狀腺肥大�����,NOAEL定為低劑量��。
Sponsor:不認(rèn)可SD結(jié)論��。提供了同一藥物其它種屬��、更高劑量下�����、相同甲狀腺病理結(jié)果的數(shù)據(jù)�����,顯示未見體現(xiàn)甲狀腺功能的甲狀腺激素的異常��。
CRO 病理學(xué)家:依然不為所動,堅持己見����,認(rèn)為只有大鼠的功能性數(shù)據(jù)才能說明問題,其它種屬的不予考慮�����。
CRO高級毒理學(xué)家:查閱了該藥物前期上市時開展的大鼠13周重復(fù)經(jīng)口給藥毒理研究數(shù)據(jù)��,更高暴露量情況下�����,未見甲狀腺激素的變化��。
最終��,CRO病理學(xué)家同意修改意見,判定中劑量出現(xiàn)的甲狀腺病理改變?yōu)閚on-adverse��,SD修改NOAEL劑量為中劑量��。這個案例首先判定甲狀腺肥大嚴(yán)重程度是劑量相關(guān)的��,是與供試品有關(guān)的反應(yīng)��。至于判定為毒性反應(yīng)還是非毒性反應(yīng)�����,不同相關(guān)方的結(jié)論不一。本文第二步的第1個問題��,是否足夠嚴(yán)重到引起功能損傷,比較慶幸的是甲狀腺異常是有功能性biomarkers可以支持決策的。也提醒NOAEL的確定不僅需要采納本試驗(yàn)數(shù)據(jù)����,還需結(jié)合前期數(shù)據(jù)�����、sponsor觀點(diǎn)等綜合考量。
案例二
ADC抗腫瘤產(chǎn)品����,大鼠靜脈給藥3周毒理研究。骨髓�����、胸腺��、脾臟�����、肺及睪丸均發(fā)現(xiàn)病理學(xué)變化��,且呈劑量依賴性����,低劑量嚴(yán)重程度是minimal/mild級別����。除睪丸外����,中�����、高劑量組動物的毒性發(fā)現(xiàn)經(jīng)6周恢復(fù)期后可逆性恢復(fù)。
基于以上信息����,CRO SD將NOAEL定為了低劑量��。Sponsor認(rèn)為低劑量用于計算起始劑量太低����,咨詢了其它毒理顧問意見?���?吹竭@��,不曉得各位是否意識到其中的問題����,供試品的臨床擬用適應(yīng)癥是腫瘤,根據(jù)ICH S9要求����,嚙齒類動物STD10的1/10作為起始劑量��,故應(yīng)該根據(jù)是否引發(fā)動物死亡/瀕死�����、威脅生命或不可逆毒性情況獲取STD10��,而不單純是NOAEL�����。當(dāng)然�����,最后SD對報告進(jìn)行了調(diào)整。這個案例提示我們�����,不是所有試驗(yàn)都需要界定NOAEL��。另外��,CRO與Sponsor的充分溝通非常關(guān)鍵����,不要等到最后試驗(yàn)都做完了����,產(chǎn)品目標(biāo)適應(yīng)癥還不清楚����。
案例三
一個多肽類藥物�����,擬用于非腫瘤適應(yīng)癥����,皮下給藥�����,犬9個月重復(fù)給藥毒性試驗(yàn)�����。給藥2個月時��,中�����、高劑量組注射部位出現(xiàn)中重度紅斑和水腫�����,而且注射位點(diǎn)反應(yīng)已經(jīng)影響到繼續(xù)給藥。鑒于這種情況����,CRO和sponsor進(jìn)行了密切溝通和反復(fù)討論,提出了各種各樣的解決方案����,包括重新開展研究、增設(shè)更低劑量組動物�����,兩個路徑都涉及費(fèi)用和時間的大量增加����,而且在已經(jīng)進(jìn)行的試驗(yàn)期間增設(shè)組別非常麻煩�����。還有一種方案是因低劑量未見注射部位反應(yīng)�����,說明該毒性表現(xiàn)是劑量相關(guān)的��,可以嘗試降低中��、高劑量組的劑量解決��。亦或者對于感染動物先停藥�����,恢復(fù)后繼續(xù)用藥��。還可以改變注射部位,換其它位點(diǎn)����。另外,研究發(fā)現(xiàn)注射位點(diǎn)反應(yīng)是組胺介導(dǎo)的��,可以給予抗組胺藥物處理�����,增加局部耐受����。最后����,經(jīng)過多方討論,采用的是給予抗組胺藥+動物短暫給藥休息+調(diào)整注射位點(diǎn)方案�����,順利完成了9個月的給藥周期。
最后給出了兩個NOAEL�����,低劑量為局部NOAEL�����,高劑量為系統(tǒng)NOAEL��。這個案例提示我們,試驗(yàn)出現(xiàn)問題不可怕�����,充分的頭腦風(fēng)暴��、信息互通對于解決問題反而頗為重要。對于注射位點(diǎn)反應(yīng)這點(diǎn)����,正文中已有解釋,不再贅述。
案例四
一個小分子藥物,擬用于非腫瘤適應(yīng)癥����,經(jīng)口給藥,大鼠6個月重復(fù)給藥毒理試驗(yàn)��。高劑量組在給藥第30天����,中劑量組動物在給藥第100天,低劑量組在第130天出現(xiàn)seizures癥狀��。有時發(fā)生在藥后幾秒��,有時發(fā)生在采血��、體重測量��、換籠等日常操作過程中����,持續(xù)約1分鐘。每個組別seizures發(fā)生率和發(fā)生次數(shù)如下表所示����。
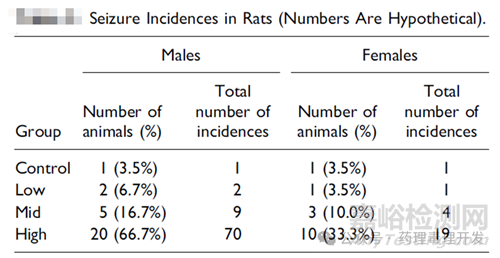
動物體重��、攝食量等其它指標(biāo)均正常��。也未見動物發(fā)作后抑郁表現(xiàn)����?���;謴?fù)期也未見動物出現(xiàn)seizures�����。雖然未見動物死亡/瀕死��,考慮到高劑量組動物發(fā)作的頻率較高,sponsor決定在第90天時�����,高劑量組動物停止給藥,進(jìn)行組織病理學(xué)檢查����,其它動物按原定方案繼續(xù)用藥��。病理發(fā)現(xiàn)高劑量組腦部空泡化�����。結(jié)合病理結(jié)果和臨床癥狀觀察�����,高劑量組出現(xiàn)的seizures定性為毒性反應(yīng)��。很明顯seizures發(fā)生率呈劑量相關(guān)性����,是供試品相關(guān)的。但問題也來了�����,所有的seizures都應(yīng)視為毒性反應(yīng)嗎��?單次seizures發(fā)作算毒性反應(yīng)嗎����?低劑量組的seizures發(fā)生率算毒性反應(yīng)還是非毒性呢��?關(guān)于這點(diǎn)�����,CRO公司����、申報方和其它相關(guān)團(tuán)隊并未完全達(dá)成一致�����。
最后,將低劑量定為NOAEL����,該組的seizures定性為可能的非毒性反應(yīng)(likely non-adverse)����。原因如下:1)低劑量組發(fā)生率很低�����,與對照組幾乎相當(dāng)����;2)動物并未在Tmax時間點(diǎn)發(fā)作����,更多在被操作時發(fā)作�����,不具備血藥濃度依賴;3)發(fā)作時間歇性的��,數(shù)天到數(shù)周不等�����;4)動物未見發(fā)作后抑郁����,而是發(fā)作后快速恢復(fù)��,并正常生活��;5)整個治療期間動物健康存活��;6)動物未見其它指標(biāo)異常�����。
暫不提這些原因有些是不是稍顯牽強(qiáng)�,這個案例對于中樞神經(jīng)系統(tǒng)毒性反應(yīng)相關(guān)的NOAEL界定,還是有參考價值的����。
案例五
一個小分子藥物����,擬用于非腫瘤適應(yīng)癥��,經(jīng)口給藥,大鼠3個月重復(fù)給藥毒理試驗(yàn)����。中�、高劑量組動物出現(xiàn)腎毒性、臨床癥狀異常(藥后1h內(nèi)約50%動物出現(xiàn)沒有精神)�、體重降低(平均20%)。此外����,高劑量組出現(xiàn)動物死亡���。所有劑量組動物均出現(xiàn)肝細(xì)胞脂質(zhì)增加��、肝臟重量增加��、肝小葉中心肥大��,嚴(yán)重程度呈劑量依賴性增加���。提交到監(jiān)管機(jī)構(gòu)的資料顯示�����,中劑量被定為NOAEL�����,脂質(zhì)代謝異常、臨床癥狀異常和體重降低未被視為毒性反應(yīng)�。當(dāng)然�����,監(jiān)管機(jī)構(gòu)最終不同意這一NOAEL選擇���,認(rèn)為應(yīng)該將低劑量作為NOAEL����。監(jiān)管機(jī)構(gòu)認(rèn)為中�����、高劑量組轉(zhuǎn)氨酶升高��、肝細(xì)胞脂質(zhì)增加��、血漿膽固醇增加等多個臨床病理指標(biāo)異常均指向了脂質(zhì)代謝過程的異常,應(yīng)視為毒性反應(yīng)���。再結(jié)合腎毒性����、體重降低�����、臨床觀察異常�����,中劑量不應(yīng)作為NOAEL��。
篇幅所限��,更多案例有時間另起一篇再單獨(dú)介紹吧。本文更多是把a(bǔ)dverse和non-adverse判定的基本邏輯��、大致過程和核心問題做下梳理���,可以看到,NOAEL的確定是一項復(fù)雜����、系統(tǒng)的技術(shù)活,需要有一套嚴(yán)格的決策步驟�����,不是完全憑主觀和經(jīng)驗(yàn)武斷給出答案���。更何況,NOAEL的確定涉及到臨床起始劑量的選擇��,定的過低�����,需要額外爬坡��,費(fèi)時費(fèi)力費(fèi)錢��。定的過高���,如果不合理,監(jiān)管機(jī)構(gòu)不會同意�,也會增加注冊時長����。