隨著人用藥品技術(shù)要求國際協(xié)調(diào)理事會(ICH)Q13指南的發(fā)布以及多個采用連續(xù)制造技術(shù)的口服固體制劑獲批,藥品連續(xù)制造在該類產(chǎn)品領(lǐng)域的監(jiān)管發(fā)展受到越來越多的關(guān)注�。物料處理是連續(xù)制造平臺重要的組成部分,本研究分析了物料輸入����、連續(xù)給料和連續(xù)混合方面的技術(shù)特點,介紹了口服固體制劑連續(xù)制造的物料處理步驟��,并從工藝驗證����、穩(wěn)健性��、設(shè)施設(shè)備��、過程控制��、質(zhì)量保證和清潔等方面探討了監(jiān)管檢查的關(guān)注點�。在相關(guān)技術(shù)考量方面�,工藝設(shè)備應(yīng)能持續(xù)穩(wěn)定地傳遞物料且盡可能控制風(fēng)險并降低物料損耗,因此需要深入了解物料特性����,科學(xué)地設(shè)計工藝設(shè)備和開展確認驗證;在監(jiān)管檢查方面可關(guān)注連續(xù)工藝的專屬風(fēng)險以及對產(chǎn)品質(zhì)量可能產(chǎn)生的影響��。期望能以此促進連續(xù)制造在制藥行業(yè)的應(yīng)用��,同時也建議監(jiān)管機構(gòu)�、制藥企業(yè)以及全社會共同參與,充分運用過程分析技術(shù)��、創(chuàng)新檢驗方法和數(shù)字化質(zhì)量保證等手段助力持續(xù)生產(chǎn)出符合質(zhì)量要求的產(chǎn)品�,從而推動我國制藥工業(yè)向高水平現(xiàn)代化邁進。
隨著 2021 年 7 月人用藥品技術(shù)要求國際協(xié)調(diào)理事會 (The International Council for Harmonisationof Technical Requirements for Pharmaceuticals forHuman Use��,ICH)Q13《原料藥和制劑的連續(xù)制造》指南發(fā)布征求意見[1],藥品連續(xù)制造 (pharmaceuticalcontinuous manufacturing�,PCM) 的監(jiān)管發(fā)展進入了新的時代。全球主要監(jiān)管機構(gòu)一致鼓勵連續(xù)制造技術(shù)的應(yīng)用����,2015 至 2021 年,美國��、歐盟以及日本陸續(xù)批準了涉及 3 類工藝生產(chǎn)線��、4 家公司的 9個口服固體制劑 (oral solid dosage��,OSD) 上市 [2-3]��??傮w上�,藥品連續(xù)制造在全球應(yīng)用呈增長趨勢,近年來該領(lǐng)域科學(xué)技術(shù)的快速發(fā)展促進了全球業(yè)界實踐以及監(jiān)管經(jīng)驗的積累��,對我國藥品連續(xù)制造的發(fā)展也起到了持續(xù)推動作用����。
從全球監(jiān)管考量來看,美國食品藥品監(jiān)督管理局 (FDA)����、日本獨立行政法人醫(yī)藥品醫(yī)療器械綜合機構(gòu) (PMDA) 等也都發(fā)布有藥品連續(xù)制造相關(guān)的指南細則 [4-7]��;歐洲藥品管理局 (EMA) 雖然暫沒有提供具體指南�,但已通過多種場合表示其目前的監(jiān)管體系足以支持連續(xù)制造的應(yīng)用 [8]����。監(jiān)管考量具有一定的地區(qū)特點,相對來說�,ICH Q13 總體還是比較框架性的,其延伸更寬泛�、包容度更高、在申報資料指導(dǎo)方面更詳細 ��;FDA�、PMDA 指南相對更具體,在專業(yè)領(lǐng)域的聚焦較深��、較細 [9]�。除監(jiān)管機構(gòu)外,其他機構(gòu)或組織也在積極推進先進制造����。美國藥典委員會在藥品連續(xù)制造的控制策略標準化、成分表征標準化 ( 體現(xiàn)在文獻標準和實物參比標準 )、產(chǎn)品放行標準化�、設(shè)備 / 系統(tǒng)要求標準化、傳感技術(shù)標準化以及系統(tǒng)建模標準化方面一直在開展深入研究 [10] �;美國材料與試驗協(xié)會 (ASTM) 于2014 年發(fā)布了“制藥工業(yè)連續(xù)工藝應(yīng)用的標準指南”[11] ;國際制藥工程協(xié)會 (ISPE) 口服固體實踐委員會連續(xù)制造分委會 2022 年也發(fā)布了“良好實踐指南 :口服固體制劑的連續(xù)制造”[12]��。這些成果都在推動連續(xù)制造創(chuàng)新和變革過程中發(fā)揮了重要作用��。各指南的側(cè)重點簡要對比見表1����。
表1 連續(xù)制造相關(guān)指南的對比
口服固體制劑連續(xù)制造已有較為成功的經(jīng)驗,當前階段的相關(guān)探討也較多聚焦在該領(lǐng)域�。物料處理是連續(xù)制造平臺重要的一部分,應(yīng)采用合適的設(shè)備�,使用特性良好的物料,并采取良好的過程控制��,使中間品及成品質(zhì)量始終在其關(guān)鍵質(zhì)量屬性(critical quality attribute����,CQA) 受控狀態(tài)范圍內(nèi)����。口服固體制劑生產(chǎn)中,可能涉及液體加工及干燥顆粒加工時的物料特性表征與控制����,而物料特性對系統(tǒng)的整體行為起重要的作用,在一定程度上�,物料的可變性很可能是影響產(chǎn)品質(zhì)量的主因,因此充分理解物料性能����、合理選取和設(shè)計設(shè)備,在工藝中通過過程分析技術(shù) (process analysis technology�,PAT)監(jiān)控和反饋,動態(tài)維持受控狀態(tài)��,更符合質(zhì)量源于設(shè)計 (Quality by Design��,QbD) 理念�。在 ICH、FDA 指南的基礎(chǔ)上��,ISPE 指南從制藥工程的角度納入了口服固體制劑的業(yè)界共識�,是對監(jiān)管指南的重要補充。本研究重點參考 ISPE 指南的部分內(nèi)容��,討論在口服固體制劑的連續(xù)制造過程中持續(xù)穩(wěn)定處理物料的相關(guān)考量�,探討監(jiān)管檢查可能需要關(guān)注的要點�。
1�、口服固體制劑連續(xù)制造的物料處理
藥品連續(xù)制造的物料處理應(yīng)盡量在不引入工藝風(fēng)險和不造成物料損失的情況下,持續(xù)穩(wěn)定地將物料在連續(xù)制造設(shè)備系統(tǒng)中進行傳遞����。這就需要在了解物料特性的基礎(chǔ)上確定適合的設(shè)備類型和屬性,并基于科學(xué)設(shè)計和確認驗證數(shù)據(jù)來建立基本工藝描述和最低性能指標要求�。考慮到連續(xù)制造的“批次”運行時間較長����、物料處理量較大,且生產(chǎn)中途有可能出現(xiàn)擾動等情況����,還應(yīng)關(guān)注操作安全 ( 如粉塵爆炸風(fēng)險控制等 )、產(chǎn)品切換����、可清潔性以及組裝和拆卸便利性等 [12]。
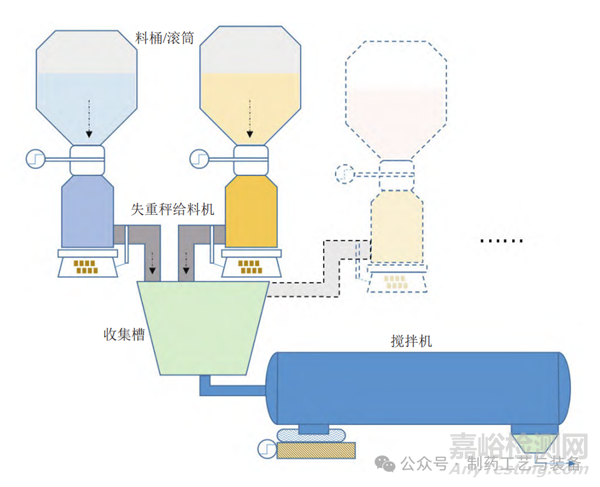
物料處理過程一般包括物料的存儲��、連續(xù)給料��、混合前收集����、攪拌混合以及過程中的各類輸送環(huán)節(jié)等。多數(shù)口服固體制劑尚未能實現(xiàn)端到端連續(xù)��,一般通過中間料斗在適當批量和時間內(nèi)保持工藝連續(xù)����。不同粉末原料的物理性質(zhì)可能不同,對前序工藝條件的保持能力也有差異����,因此需要綜合考慮采用機械助流等主動方式驅(qū)動粉末流動或通過重力排出等被動方式引導(dǎo)流動的設(shè)備設(shè)計。連續(xù)工藝的前端涉及原料�、物料或中間品的投入,需要主動計量并對投入的物料流進行混合 ��;為達到所需的精細控制水平����,常需采用批量工藝和連續(xù)工藝配合操作。初始物料輸入通常為批量給料設(shè)備��,一旦物料進入生產(chǎn)線��,則一般采用失重秤給料機��。常見的 PCM物料處理的設(shè)備和流程如圖 1 所示。
圖1 藥品連續(xù)制造的物料處理示意圖
1.1物料輸入
粉末處理不僅是物料輸入的重點��,也是多數(shù)連續(xù)制造單元操作中的關(guān)注點�。粉末的特征影響操作性能,決定了設(shè)備和工藝參數(shù)的選取及確認����。粉末處理特性概況可參見表 2 中的描述 [12]。在物料輸入工藝的研發(fā)和試制過程中應(yīng)充分考慮這些特性對工藝和產(chǎn)品的影響�,合理設(shè)計、驗證并制定有效的管理措施����。
表2 粉末特性的影響 1)
例如,有黏性和可充氣的物料難以自由流動和快速沉降����,需要考慮輔助輸送 ;采用稀相輸送流速快且不易堵塞����,但可能會導(dǎo)致管道或顆粒磨損及偏析的風(fēng)險,此外����,稀相輸送不適于靜電敏感性物料,可能導(dǎo)致顆粒黏附在管道壁面 ����;采用密相輸送可降低顆粒磨損,但對物料要求較苛刻�,例如用平推流(plug flow) 輸送大顆粒和片劑,移動床流 (movingbed flow) 輸送細的�、不可滲透的粉末。正壓輸送系統(tǒng)可利用氣壓牽引粉末��,而真空輸送系統(tǒng)可在常壓下將粉末吸入真空容器 ����;正壓輸送距離遠,而真空輸送更適于處理易成粉或有毒物料��。
在連續(xù)制造中����,工序之間的連接點通常需要部署物料處理系統(tǒng),以支持相鄰工序的參數(shù)之間平穩(wěn)轉(zhuǎn)換或橋接����。可靠的粉末流動能力是一個考慮重點����,在開發(fā)��、初始部署和變更時都應(yīng)仔細評估�。還應(yīng)關(guān)注物料的粒徑和流動性等性質(zhì)����。系統(tǒng)的性能取決于物料與設(shè)備特性之間的相互作用,在性能確認或試制之前��,盡可能考慮建立基于 QbD 的物料處理模型和設(shè)計空間��,重點研究進料和混合����,并關(guān)注混合粉末的積累和處理的情況。
1.2連續(xù)給料
連續(xù)制造單元需具備一定的存儲能力�。未加工物料需要倉儲�,可能因自重或裝袋堆積應(yīng)力等導(dǎo)致凝聚性增加,影響初始流動性�,需要結(jié)合物料的專屬特性進行考量。例如��,劉飛等分別采用連續(xù)干粉混合和直接壓片制造緩釋片,觀察到原料的流動性對緩釋片基質(zhì)的可制造性和加工性有很大影響��,具有良好流動性的粉末和有效的混合對于片劑質(zhì)量穩(wěn)定非常關(guān)鍵 [13]����。
生產(chǎn)線的物料容器主要有料倉�、滾筒和柔性袋等。料倉通常是不銹鋼結(jié)構(gòu)����,優(yōu)點是機械堅固、密封性好��、易于清洗和反復(fù)使用 ����;缺點是不靈活、難改造�。滾筒通常是塑料襯里加不銹鋼或纖維架構(gòu),靈活性好����,可組合使用;但須注意滾筒和襯墊材料的潛在污染情況�,以及較大滾筒中可能出現(xiàn)的較高頂壓和沉降。柔性袋系統(tǒng)一般具有柔性、透明的外壁�,可通過目視確認物料的排放情況 ;通常是一次性或即拋型的��,減少了物料轉(zhuǎn)移和清潔的需要 �;但在采用堆疊儲存時,底部物料承受的累積質(zhì)量可能導(dǎo)致粉末過度固結(jié)�,影響流動性。實際應(yīng)用中��,需結(jié)合包裝類型����、庫存需求以及實現(xiàn)方式確定總?cè)萘俊4送?�,還須考慮應(yīng)便于物料動態(tài)轉(zhuǎn)移使用����,以及大規(guī)格包裝中剩余的物料存儲評估等。
1.3連續(xù)混合
即便是單一原料發(fā)生偏析也會導(dǎo)致粗�、細顆粒不均勻,從而影響下游操作的堆積密度及混合��。對于 API 須與輔料預(yù)混合的情形����,還存在拱起��、拉孔��、黏聚或結(jié)塊�、載氣等潛在問題����,即使質(zhì)量流量相對恒定�,仍可能導(dǎo)致物料在連續(xù)混合過程中隨時間發(fā)生變異。因此����,應(yīng)采取有效手段分析物料混合情況,并維持連續(xù)混合物料的質(zhì)量符合要求��。例如美國羅格斯大學(xué)開發(fā)的連續(xù)直接壓片系統(tǒng)��,輸入物料的質(zhì)量可采用混合動力比例 - 積分 - 導(dǎo)數(shù)控制預(yù)測模型進行控制�,按要求送入混合器形成均勻的混合物 ;德國 GEA 公司開發(fā)的商業(yè)型直接壓片的ConsiGma-DC 型連續(xù)生產(chǎn)設(shè)備中則采用近紅外光譜儀實時檢測成分的混合均勻度 [14]����。
在重力流不足以確保粉末可靠排出的情況下,需要考慮機械助流,包括全面助流或僅清空容器壁上的殘留物料��。典型方法包括外部振動��、內(nèi)部攪拌或振動�、注氣等。此外�,原料可能需要通過選取合適的磨機類型如軋輥壓縮、沖擊或錘擊��、剪切或盤磨等進行研磨以消除結(jié)塊����、降低顆粒尺寸,以改善顆粒的粒度分布 (particle size distribution�,PSD) 目標、形狀和持續(xù)均勻性等��。
2�、監(jiān)管檢查關(guān)注點探討
藥品生產(chǎn)企業(yè)應(yīng)采取有效的措施,確保采用藥品連續(xù)制造工藝的口服固體制劑物料處理符合藥品生產(chǎn)質(zhì)量管理規(guī)范的要求����。在監(jiān)管檢查過程中,除了關(guān)注批量生產(chǎn)中的一般要求之外����,還需要重點關(guān)注連續(xù)制造物料處理的特殊之處及對產(chǎn)品質(zhì)量影響的相應(yīng)風(fēng)險��。
2.1工藝驗證方面
部分單元操作在符合科學(xué)性的情況下可采用縮小模型驗證����;而部分工藝如外部振動機械助流�,考慮到其擬解決的問題可能在小型測試平臺中無法體現(xiàn),需要在最大規(guī)?;蚪咏畲笠?guī)模條件下進行性能測試。監(jiān)管檢查可關(guān)注研發(fā)或生產(chǎn)企業(yè)開展工藝驗證的策略和選取模型的合理性�。
物料能夠達到預(yù)期的傳遞過程是物料處理系統(tǒng)工藝驗證關(guān)注的重要方面,需要評估輸送類型和輸送工具特點以及帶來的相應(yīng)影響��。對于氣體輸送機這一類關(guān)鍵部件����,監(jiān)管檢查可關(guān)注其能否提供所需的壓力和流量�,速度或物料類型可否允許調(diào)整,是否能基于壓力與流量的性能曲線等選取規(guī)格�,是否能經(jīng)過充分驗證來確保輸送周期內(nèi)給料速度的一致性。
此外����,可關(guān)注企業(yè)的工藝驗證是否充分考慮了管道連接點堆積�、磨損和壓力損失�;關(guān)注企業(yè)所使用的分離器類型是否考慮了科學(xué)布局和適當?shù)耐糠秶x取過濾器表面清理方法的合理性��,是否設(shè)置內(nèi)部清洗程序�,選擇的過濾介質(zhì)是否評估了操作溫度、耐磨性和過濾性能等����。
2.2工藝穩(wěn)健性方面
物料處理系統(tǒng)須能長時間穩(wěn)定運行,并與整個工藝流程相適應(yīng)��。生產(chǎn)期間應(yīng)避免故障或性能損失�,避免過量的噪聲、振動��、熱積累等非預(yù)期情況�,避免不適當?shù)哪Σ聊p或污染物產(chǎn)生。因此��,應(yīng)關(guān)注企業(yè)是否采取有效措施維持工藝穩(wěn)健�。
任何單元操作若存在粉塵,都須在防爆方面進行獨立評估�。研磨和篩分非常容易產(chǎn)生粉塵,應(yīng)關(guān)注企業(yè)是否開展了粉塵危害分析����,是否評估了可燃粉塵的標準化壓力上升速率 (normalized rateof pressure rise����,Kst)��、最大爆炸超壓 (maximumexplosion overpressure����,Pmax)、最低可爆炸濃度����、限制氧濃度、最小點火能量等的風(fēng)險����,是否在關(guān)鍵位置采取降速����、惰性氣體吹掃、接地����、通風(fēng)口和抑制系統(tǒng)等預(yù)防措施����。
管道堵塞和濾料堆積可能對產(chǎn)品質(zhì)量產(chǎn)生嚴重影響����,監(jiān)管檢查可關(guān)注是否具備監(jiān)測儀表,對粉末質(zhì)量�、氣體壓力、溫度和氣流等參數(shù)是否按需記錄����,是否采取反饋控制策略以降低相應(yīng)的風(fēng)險。如設(shè)計了管道清洗循環(huán)����,可關(guān)注控制邏輯避免污染。關(guān)注生產(chǎn)線及其主要部件是否便于快速拆卸和內(nèi)部檢查或可更換磨損的部件�,是否充分評估了維護和預(yù)防性檢查的頻率等。
在設(shè)備或單元間的連接方面����,可關(guān)注靈活連接設(shè)備的剛性、可移動性��、直接接觸產(chǎn)品的材料����、對齊情況等����;采用固定溜槽連接時��,要加入對其角度����、橫截面、內(nèi)表面光滑度的考量��,以防止堆積����、確保物料流速穩(wěn)定、減少黏附等����。關(guān)注中間閥開口是否可防止積聚、擾動和泄漏����,是否依賴傳感器�,是否可快速拆卸利于清洗等�。
2.3設(shè)施設(shè)備方面
可關(guān)注進料槽或料斗容量能否維持轉(zhuǎn)換期間的運行����。小容器靈活但比大容器所需要的填充操作更頻繁,檢查時應(yīng)關(guān)注選取存儲設(shè)備時是否對針對工藝目標開展了評估�。儲罐的幾何形狀對流動性能影響較大,合適的料斗形狀��、光滑陡峭的內(nèi)壁可以促進重力卸料時產(chǎn)生的質(zhì)量流 ( 沿料斗壁流動 )�,使物料先進先出、防止偏析�。若物料以漏斗流的形式流動,則會導(dǎo)致潛在的流動障礙和難以清潔等問題����,并造成排出物料堆積密度不穩(wěn)定 ;料斗出口上方有物料積滯��,導(dǎo)致出現(xiàn)物料先入后出的情況并增加偏析傾向��。建議檢查過程中關(guān)注設(shè)施設(shè)備是否考慮到其接觸物料表面的材質(zhì)����、粗糙度、傾斜角度,并是否通過測試進行評估�。
檢查時還可關(guān)注流動輔助所需程度的計算是否合理,整個出口區(qū)域是否能夠保持動態(tài)檢查��,閥門特性是否充分考慮了下游的響應(yīng)時間�、密封、空間��、成本�、維護和清潔。如果使用了連接和對接設(shè)備����,可關(guān)注是否充分考慮到粉塵隔離、設(shè)備振動����、接口尺寸和傳輸速率等因素。
2.4過程控制方面
過程控制可能需要采用系統(tǒng)組件如機械取樣探頭或接觸點來收集樣本�,送至實驗室離線分析物料的水分、粒徑�、含量等特性,監(jiān)管檢查時可關(guān)注樣本的代表性�,評估取樣位置、設(shè)備大小和取樣方法的合理性����,以及是否考慮到流動床層干擾和取樣區(qū)域限制等可能造成的偏差����。采用 PAT 方式替代直接提取或去除離散粉末時��,相關(guān)儀器須直接安裝在工藝設(shè)備中以實時監(jiān)測流經(jīng)粉末的屬性�,檢查時可關(guān)注采用的分析方法與所采集信息的相關(guān)性�、設(shè)備位置、儀器有效測量區(qū)域的維持��、校準情況以及采樣率等�。在全局取樣計劃方面,建議可以關(guān)注其在統(tǒng)計上是否合理�,以及檢測持續(xù)時間是否考慮到過程停留時間以便及時反饋信息并及時做出操作決策。
在口服固體制劑的連續(xù)制造過程中��,很多不合格情況是由于物料或中間品的偏析造成的�,應(yīng)盡可能采用 PAT 等工具對工藝中不合格物料進行預(yù)防和監(jiān)控。監(jiān)管檢查時可關(guān)注是否充分研究了顆粒體積����、形狀和密度,以及是否了解傳輸工序中的作用力和粒子間運動模式��。特別應(yīng)關(guān)注偏析可能的發(fā)生機制,如顆粒間篩分�、空氣夾帶以及粉塵形成,是否采取了有效措施予以降低��。
2.5質(zhì)量保證方面
連續(xù)生產(chǎn)線性能與粉末成分及混合物的物理性能具有較強的相關(guān)性�,不合格物料的產(chǎn)生很大程度上取決于工藝或設(shè)備組合、材料或配方特性和控制策略的設(shè)計�。連續(xù)工藝不合格物料的發(fā)現(xiàn)、追溯和對產(chǎn)品質(zhì)量的影響需要更深入分析�,可能需要對物料性質(zhì)、對應(yīng)的表征方法以及停留時間分布(residence time distribution��,RTD) 等方面進行深入研究才能進行科學(xué)評估��。連續(xù)制造過程中的物料特性不一定是穩(wěn)態(tài)的��,但其動態(tài)變化應(yīng)在驗證的范圍內(nèi)進行整體考量�,當發(fā)生較大偏離時,應(yīng)考慮結(jié)合RTD 數(shù)據(jù)等科學(xué)依據(jù)對潛在的不合格物料加以分流 [15]����。監(jiān)管檢查時可關(guān)注企業(yè)針對物料性質(zhì)及工藝特點所制定的偏差調(diào)查規(guī)程和中間品、產(chǎn)品放行管理規(guī)程�,并關(guān)注偏差調(diào)查的記錄是否能反映出對原因的準確定位和風(fēng)險的全面評估,以合理支持產(chǎn)品放行依據(jù)�、提供充分的質(zhì)量保證��。
物料處理系統(tǒng)可能因共線生產(chǎn)需求而進行變更����,例如��,引入新產(chǎn)品時��,各進料點需要能夠適于處理不同特性和 (或) 使用率的物料�。在產(chǎn)能需要擴大的情況下也可能會引起變更�,例如復(fù)制生產(chǎn)線、增加單元操作設(shè)備��、增加質(zhì)量流量或延長運行時間等�。監(jiān)管檢查時可關(guān)注企業(yè)質(zhì)量保證體系是否對變更開展了有效管理,對于涉及不同于批制造生產(chǎn)模式的特定風(fēng)險是否進行了充分評估����,是否采取了充分的控制措施確保對產(chǎn)品質(zhì)量的不良影響降到最低,變更實施前的研究結(jié)果是否可以充分證明變更前后產(chǎn)品質(zhì)量的一致性或可比性等�。
2.6清潔方面
口服固體制劑的生產(chǎn)過程常會涉及粉末物料,密封性是必須考慮的因素之一��。根據(jù)所涉及的物料和工藝總體策略����,物料處理系統(tǒng)將需要提供最低水平的密封��。監(jiān)管檢查時可以關(guān)注該最低水平的確認驗證是否全面考慮了所有組件和特性并應(yīng)能避免污染和交叉污染��,同時便于清潔 ����;對操作人員潛在的職業(yè)暴露是否采取了預(yù)防措施�,特別是在設(shè)備運行、配置和拆卸期間����。
部分單元操作可能是非連續(xù)的,在物料處理設(shè)備或組件體積較小的情況下����,可能會采用非在線清洗 (clean out of place,COP����,即將設(shè)備拆卸清洗后重新組裝 ) 的方式。COP 包括人工清洗或使用機器清洗����,對這類清洗過程的監(jiān)管檢查可關(guān)注設(shè)備的可獲得性�、組裝和操作的便利性��,以及洗滌劑的選擇��、清洗液流速����、清洗液對內(nèi)表面的覆蓋、超聲的使用��、清洗周期����、清洗時間�、清洗溫度等方面的過程控制設(shè)置是否合理。對于不容易拆卸的大型藥品連續(xù)制造系統(tǒng)或組件�,通常會采用在線清洗 (cleanin place,CIP) 的方式�,以減少對設(shè)備的拆卸組裝,并減少停機等待的時間����。CIP 操作可能會采用自動化系統(tǒng)、噴淋系統(tǒng)和浸漬等清洗方式�,為確保覆蓋度和密封性��,應(yīng)對相關(guān)具體細節(jié)進行確認����。除上述對于 COP 的檢查要點外����,對 CIP 的檢查還可關(guān)注是否合理設(shè)計并確認噴嘴的性能及位置、是否充分驗證清洗程序等�。
3、總結(jié)與展望
藥品連續(xù)制造的物料處理是一個科技密集的工業(yè)過程�,特別是口服固體制劑的連續(xù)化干燥和固體或流體的處理,難度較高����,需要考慮存儲條件、存儲容器類型和特性�、機械助流、研磨和篩分����、采樣和監(jiān)測、氣體輸送�、單元操作之間的接口、清潔等多方面細節(jié)�,還需要延伸考慮系統(tǒng)的耐用性�、密封性��、可切換性和靈活性等��。此外����,并非所有單元的操作均可集成,可供選擇的試驗和中試設(shè)備也比較有限�。因此,在生產(chǎn)線的整體設(shè)計和確認驗證方面�,研究工作的深度和廣度一般遠超過了批量制造,并額外需要統(tǒng)計學(xué)�、過程控制、建模等多方面的專業(yè)知識和方法����。連續(xù)制造對生產(chǎn)企業(yè)和監(jiān)管部門都會帶來較大的挑戰(zhàn)�,需要充分做好知識儲備、加強溝通交流�,結(jié)合物料處理的特點對相應(yīng)風(fēng)險加以額外關(guān)注。
相比批量制造技術(shù)來說����,連續(xù)制造的物料處理需要對材料屬性有更深的理解����。監(jiān)管檢查中可關(guān)注企業(yè)是否建立并擴展了相應(yīng)物料的質(zhì)量標準��,以及是否有針對性地開展了供應(yīng)商管理����。偏差管理也是監(jiān)管檢查關(guān)注的重點方面,特別是可能產(chǎn)生的不合格物料����、中間品、成品的追溯和處置��,對產(chǎn)品質(zhì)量影響的風(fēng)險評估����,以及放行策略的合理性。此外����,在連續(xù)制造商業(yè)化實施過程中,伴隨著對產(chǎn)品和工藝理解的加深��,可能涉及控制算法和模型的調(diào)整以適應(yīng)原材料的變化,檢查中可以關(guān)注其涉及的上市后變更研究是否符合相應(yīng)指南的要求��、是否在藥品生產(chǎn)質(zhì)量管理規(guī)范 (GMP) 體系下規(guī)范開展變更管理以及是否及時按要求申報注冊�、備案或報告等。
推動連續(xù)制造在制藥行業(yè)的應(yīng)用����,有利于提高口服固體制劑產(chǎn)品的質(zhì)量和可及性,降低患者用藥負擔����。藥品連續(xù)制造的發(fā)展需要行業(yè)協(xié)會、設(shè)備供應(yīng)商�,以及在連續(xù)過程和自動化方面具有專業(yè)知識的科研院所共同參與,在工藝技術(shù)提升的同時����,質(zhì)量保證技術(shù)也應(yīng)當同步提升,充分運用 PAT 工具��、創(chuàng)新檢驗方法和數(shù)字化質(zhì)量保證等手段 [16-19]����,確保持續(xù)生產(chǎn)出符合質(zhì)量要求的產(chǎn)品��,從而充分推動我國制藥工業(yè)邁向現(xiàn)代化、提升競爭力��。
參考文獻
[1] ICH.Continuous manufacturing of drug substances anddrug products, Q13 [EB/OL].(2021-07-27)[2021-10-08].https://database.ich.org/sites/default/files/ICH_Q13_Step2_DraftGuideline_2021_0727.pdf.
[2] WAHLICH J.Review: continuous manufacturing of smallmolecule solid oral dosage forms [J].Pharmaceutics, 2021,13(8): 1311.
[3] 胡延臣.藥品連續(xù)生產(chǎn)及全球監(jiān)管趨勢[J].中國新藥雜志, 2020, 29(13): 1464-1468.
[4] FDA.Quality considerations for continuous manufacturing:guidance for industry [EB/OL].(2019-02-01)[2021-10-08].https://www.fda.gov/media/121314/download.
[5] PMDA.Points to consider regarding continuousmanufacturing [EB/OL].(2017-05-01)[2021-12-06].https://www.nihs.go.jp/drug/section3/AMED_CM_PtC.pdf.
[6] PMDA.PMDA views on applying continuous manufacturingto pharmaceutical products for industry [EB/OL].(2018-03-30)[2021-10-08].https://www.pmda.go.jp/files/000223712.pdf.
[7] PMDA.State of control in continuous pharmaceuticalmanufacturing [EB/OL].(2018-05-01)[2021-12-06].https://www.nihs.go.jp/drug/section3/AMED_CM_CONTROLST.pdf.
[8] EMA.Continuous manufacturing - EMA perspective andexperience [EB/OL].(2017-09-19)[2021-12-06].https://dc.engconfintl.org/cgi/viewcontent.cgi?article=1033&context=biomanufact_iii.
[9] 曹 萌, 丁力承, 胡延臣, 等.藥品連續(xù)制造全球監(jiān)管發(fā)展現(xiàn)狀與思考[J].中國藥事, 2022, 36(4): 364-376.
[10] USP.Policy considerations to help harness pharmaceuticalcontinuous manufacturing for a more resilient medicinesupply chain.[EB/OL].(2021-04-01)[2021-10-08].https://www.usp.org/sites/default/files/usp/document/supply-chain/usp-policy-considerations-for-pharmaceuticalcontinuous-manufacturing.pdf.
[11] ASTM.Standard guide for application of continuousprocessing in pharmaceutical industry [EB/OL].(2016-12-27)[2021-10-08].https://www.a(chǎn)stm.org/e2968-14.html.
[12] ISPE.Good practice guide: continuous manufacturing oforal solid dosage forms [EB/OL].(2022-03-30)[2022-05-11].https://ispe.org/publications/guidance-documents/good-practice-guide-continuous-manufacturing-oral-soliddosage-forms.
[13] 劉 飛, 李海燕.粉末直接壓片連續(xù)制造緩釋片[J].臨床醫(yī)藥文獻電子雜志, 2018, 5(15): 196-197.
[14] 袁春平, 時 曄, 王 健, 等.口服固體制劑連續(xù)制造的研究進展[J].中國醫(yī)藥工業(yè)雜志, 2016, 47(11): 1457-1463.
[15] BHALODE P, TIAN H, GUPTA S, et al.Using residencetime distribution in pharmaceutical solid dose manufacturinga critical review [J].Int J Pharm, 2021, 610: 121248.
[16] 張 闖, 唐文燕.過程分析技術(shù)在制藥工業(yè)中的應(yīng)用及監(jiān)管考量[J].中國醫(yī)藥工業(yè)雜志, 2021, 52(3): 407-413.
[17] 董正龍, 曹 萌.信息技術(shù)在生物制藥工業(yè)中的應(yīng)用[J].中國醫(yī)藥工業(yè)雜志, 2019, 50(11): 1262-1267.
[18] 朱 馨, 陳桂良, 曹 萌.藥品生產(chǎn)的數(shù)字化質(zhì)量保證探索與實踐[J].中國醫(yī)藥工業(yè)雜志, 2022, 53(3): 395-398.
[19] 曹 萌, 葛淵源, 張景辰, 等.藥物分析新技術(shù)在藥品科學(xué)監(jiān)管中的應(yīng)用[J].中國藥事, 2021, 35(6): 614-623.
本文作者曹萌�、葛淵源、胡延臣��、王亞敏�、曹軼,上海藥品審評核查中心�、國家藥品監(jiān)督管理局藥品審評中心、國家藥品監(jiān)督管理局食品藥品審核查驗中心��,來源于中國醫(yī)藥工業(yè)雜志��,僅供交流學(xué)習(xí)�。