今日頭條
睿健眼科iPSC獲FDA孤兒藥資格�。睿健醫(yī)藥通用型iPSC(誘導(dǎo)多能干細(xì)胞)眼科細(xì)胞治療產(chǎn)品NouvSight001獲FDA授予孤兒藥資格。這是該公司“AI+化學(xué)誘導(dǎo)”平臺(tái)針對(duì)視網(wǎng)膜色素變性系列適應(yīng)癥開(kāi)發(fā)的通用型細(xì)胞治療產(chǎn)品����。去年8月,“AI+化學(xué)誘導(dǎo)”平臺(tái)首款通用型細(xì)胞療法NouvNeu001已獲CDE臨床批件����,擬開(kāi)發(fā)用于治療帕金森病(PD)���。
國(guó)內(nèi)藥訊
1.恒瑞引進(jìn)干眼癥新藥Ⅲ期臨床見(jiàn)刊����。恒瑞醫(yī)藥引進(jìn)的環(huán)孢素滴眼液SHR8028(CyclASol����,0.1%環(huán)孢菌素A制劑)治療中國(guó)干眼患者(DED)的Ⅲ期研究成果公布于《美國(guó)醫(yī)學(xué)會(huì)雜志》(JAMA)子刊JAMA Ophthalmology上。與溶劑相比���,SHR8028可有效降低患者的全角膜熒光素染色(tCFS)評(píng)分���,中央?yún)^(qū)CFS、總結(jié)膜麗思胺綠染色和視物模糊指標(biāo)也優(yōu)于溶劑�,且藥物安全性良好���。目前,該新藥上市申請(qǐng)正接受CDE審查����。
2.德琪ADC啟動(dòng)國(guó)際II期臨床。德琪醫(yī)藥靶向Claudin 18.2的抗體偶聯(lián)藥物(ADC)ATG-022在中國(guó)和澳大利亞啟動(dòng)評(píng)估單藥治療晚期或轉(zhuǎn)移性實(shí)體瘤患者的II期CLINCH臨床劑量擴(kuò)展研究���。ATG-022已取得初步療效數(shù)據(jù)和安全性結(jié)果����,該公司計(jì)劃在劑量擴(kuò)展階段入組胃癌和其他實(shí)體瘤患者���。去年5月,F(xiàn)DA已授予該新藥用于治療胰腺癌和胃癌兩項(xiàng)孤兒藥資格認(rèn)定(ODD)�。
3.北京偉德杰結(jié)腸炎新藥獲批IND。北京偉德杰生物自主開(kāi)發(fā)的I類生物制品注射用VDJ010獲國(guó)家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可���,臨床適應(yīng)癥為潰瘍性結(jié)腸炎(UC)����。VDJ010是一款長(zhǎng)效Treg激活劑���,具備結(jié)構(gòu)天然���、高活性����、用藥劑量低����、適應(yīng)癥范圍廣等潛在優(yōu)勢(shì),在國(guó)際競(jìng)爭(zhēng)格局中具備差異化的特點(diǎn)���。偉德杰生物在該項(xiàng)目布局了4個(gè)國(guó)際專利�。
4.康樸新型分子膠獲批SLE臨床�。康樸生物E3泛素連接酶復(fù)合物CRL4-CRBN調(diào)節(jié)劑1類化藥KPG-818膠囊獲國(guó)家藥監(jiān)局臨床許可,擬開(kāi)發(fā)治療系統(tǒng)性紅斑狼瘡(SLE)�。KPG-818可高效降解鋅指轉(zhuǎn)錄因子Aiolos(IKZF3)和Ikaros(IKZF1),能有效調(diào)節(jié)免疫細(xì)胞以及相關(guān)免疫細(xì)胞因子���。在美國(guó)����,該新藥已完成用于治療SLE患者的Ⅰb/Ⅱa期臨床研究����。
5.石藥HER2 ADC報(bào)新IND����。石藥集團(tuán)巨石生物開(kāi)發(fā)的靶向HER2的ADC新藥DP303c的臨床試驗(yàn)申請(qǐng)獲CDE受理����。該新藥目前已處于Ⅲ期臨床開(kāi)發(fā)階段,正開(kāi)展多項(xiàng)頭對(duì)頭臨床研究�,評(píng)估對(duì)比恩美曲妥珠單抗(T-DM1),以及對(duì)比曲妥珠單抗����,用于治療HER2陽(yáng)性、晚期或轉(zhuǎn)移性乳腺癌的有效性與安全性����。除乳腺癌外�,DP303c用于治療胃癌、卵巢癌的相關(guān)研究也已進(jìn)入II期臨床階段����。
6.藥明巨諾CAR-T商業(yè)化銷售1.74億元。藥明巨諾發(fā)布2023年全年業(yè)績(jī)報(bào)告�,公司收入1.739億元人民幣�,較去年的1.457億元同比增加19.3%���;研發(fā)投入4.08億元���,同比增長(zhǎng)1.4%。目前���,藥明巨諾僅有瑞基奧侖賽注射液(商品名:瑞諾達(dá))1款商業(yè)化產(chǎn)品����,這是靶向CD19的CAR-T產(chǎn)品����,已在國(guó)內(nèi)獲批用于治療既往二線或以上系統(tǒng)性治療的復(fù)發(fā)或難治性大B細(xì)胞淋巴瘤(LBCL),以及復(fù)發(fā)或難治性濾泡淋巴瘤(FL)���。
國(guó)際藥訊
1.武田白血病靶向藥獲批新適應(yīng)癥�。武田第三代Bcr-abl激酶抑制劑ponatinib(Iclusig)獲FDA加速批準(zhǔn)新適應(yīng)癥����,聯(lián)合化療一線治療費(fèi)城染色體陽(yáng)性急性淋巴細(xì)胞白血病(Ph+ ALL)。在III期PhALLCON研究中,與伊馬替尼相比����,ponatinib聯(lián)合化療使患者獲得微小殘留病(MRD)陰性完全緩解的比例更高����。此前,該藥已被批準(zhǔn)用于治療TKI耐藥或不耐受的慢性期�、加速期或母細(xì)胞期慢性粒細(xì)胞白血病(CML)或Ph+ ALL患者����,以及T315I陽(yáng)性CML或Ph+ ALL患者。
2.O藥聯(lián)合治療肝癌Ⅲ期臨床積極����。百時(shí)美施貴寶PD-1抑制劑Opdivo(nivolumab)聯(lián)合CTLA-4靶向抗體Yervoy(ipilimumab)一線治療晚期肝細(xì)胞癌(HCC)的Ⅲ期臨床CheckMate-9DW達(dá)到主要終點(diǎn)。與研究者選擇的索拉非尼或樂(lè)伐替尼單藥治療相比����,Opdivo+Yervoy組合顯著提高了患者的總生存期����。臨床中,該組合的安全性特征與已知研究數(shù)據(jù)一致,沒(méi)有發(fā)現(xiàn)新的安全信號(hào)�。
3.DMD新機(jī)制口服療法Ⅲ期見(jiàn)刊。Italfarmaco公司新型口服組蛋白去乙?;福℉DAC)抑制劑givinostat治療6歲以上仍具備行走能力的杜氏肌營(yíng)養(yǎng)不良癥(DMD)男童的Ⅲ期臨床EPIDYS達(dá)到主要終點(diǎn)。第72周時(shí)����,與安慰劑相比,givinostat聯(lián)合皮質(zhì)類固醇治療顯著延緩了疾病進(jìn)展���,患者攀爬四級(jí)樓梯的衰退速度較安慰劑組更慢(與安慰劑的差異為1.78秒����,p=0.037)����。詳細(xì)結(jié)果發(fā)表在The Lancet Neurology期刊上。
4.體內(nèi)CRISPR基因編輯療法上Ⅲ期臨床�。Intellia公司CRISPR/Cas9基因編輯療法NTLA-2001治療轉(zhuǎn)甲狀腺素蛋白淀粉樣變性伴心肌病(ATTR-CM)的Ⅲ期MAGNITUDE試驗(yàn)完成首例患者給藥。NTLA-2001是基于Intellia專有的非病毒平臺(tái)開(kāi)發(fā)�,利用脂質(zhì)納米顆粒向肝臟輸送靶向TTR基因的特異性gRNA和編碼Cas9酶的mRNA,具有ATTR功能治愈性潛力����。在Ⅰ期臨床中�,單次注射NTLA-2001可將患者血清中的轉(zhuǎn)甲狀腺素(TTR)蛋白降低約90%����,且療效維持6-12個(gè)月。
5.全球首款結(jié)核病疫苗啟動(dòng)Ⅲ期臨床����。葛蘭素史克與Aeras公司和國(guó)際艾滋病疫苗行動(dòng)組織(IAVI)共同開(kāi)發(fā)的結(jié)核病(TB)候選疫苗M72/AS01E啟動(dòng)Ⅲ期臨床�,在受結(jié)核病影響嚴(yán)重的南非開(kāi)展首批疫苗接種,評(píng)估用于預(yù)防結(jié)核病的有效性���。M72有望成為首款為青少年和成人預(yù)防最常見(jiàn)的肺結(jié)核的疫苗���。該項(xiàng)試驗(yàn)由惠康基金會(huì)(Wellcome)和比爾及梅琳達(dá)·蓋茨基金會(huì)提供資金,蓋茨醫(yī)學(xué)研究所負(fù)責(zé)開(kāi)展�。
6.優(yōu)瑞科T細(xì)胞療法早期臨床積極。優(yōu)瑞科生物(Eureka Therapeutics)宣布其T細(xì)胞療法ECT204已在用于治療GPC3陽(yáng)性晚期肝細(xì)胞癌(HCC)的Ⅰ/Ⅱ期臨床ARYA-3取得了安全性數(shù)據(jù)和初步療效結(jié)果���,目前正進(jìn)行第二階段患者招募���。在這項(xiàng)研究中,患者的T細(xì)胞被收集并經(jīng)過(guò)基因修改����,以表達(dá)優(yōu)瑞科專有的抗GPC3 ARTEMIS T細(xì)胞受體(AbTCR)。此前�,F(xiàn)DA已授予ECT204用于治療HCC的孤兒藥資格。
7.Capstan公司完成B輪融資���。Capstan公司宣布完成1.75億美元的超額認(rèn)購(gòu)B輪融資�,用于推進(jìn)其體內(nèi)嵌合抗原受體T細(xì)胞(CAR-T)候選療法CPTX2309開(kāi)展用于治療自身免疫疾病的早期概念驗(yàn)證研究,以及進(jìn)一步開(kāi)發(fā)靶向脂質(zhì)納米顆粒(tLNP)管線����。此輪融資由RA Capital Management領(lǐng)投,新投資者包括Forbion����、強(qiáng)生創(chuàng)新(JJDC)等,現(xiàn)有投資者Alexandria Venture Investments����、百時(shí)美施貴寶����、禮來(lái)公司���、拜耳旗下的Leaps也參投����。
醫(yī)藥熱點(diǎn)
1.“16+8”飲食或增加心臟病風(fēng)險(xiǎn)�。據(jù)美國(guó)《華盛頓郵報(bào)》18日?qǐng)?bào)道,一項(xiàng)新研究發(fā)現(xiàn)�,每天僅在8小時(shí)內(nèi)完成全天的進(jìn)食的成年人死于心臟病或中風(fēng)的可能性是將進(jìn)食分散在12—16小時(shí)的人的兩倍左右,而且不會(huì)延年益壽����。與不禁食的人相比,選擇每天8小時(shí)之外禁食的人的肌肉質(zhì)量較低�。吃得太少或禁食時(shí)間太長(zhǎng),會(huì)導(dǎo)致增肌或維持肌肉含量變得更加困難����,而肌肉含量的減少增加了患心血管疾病死亡的風(fēng)險(xiǎn)。
2.拜耳調(diào)整制藥業(yè)務(wù)管理團(tuán)隊(duì)����。3月20日,拜耳宣布其制藥業(yè)務(wù)部執(zhí)行領(lǐng)導(dǎo)團(tuán)隊(duì)將進(jìn)行重組�。據(jù)Endpoints News和Fierce Pharma報(bào)道�,制藥領(lǐng)導(dǎo)團(tuán)的高管人數(shù)將從14人減少至8人���,其中全球營(yíng)銷主管Anne-Grethe Mortensen���、放射學(xué)主管Gerd Kruger和消費(fèi)者健康部門(mén)負(fù)責(zé)人Heiko Schipper將離開(kāi)公司����。此外,拜耳還新成立了一個(gè)新的“全球商業(yè)化”部門(mén)�,該部門(mén)將包括公司前戰(zhàn)略業(yè)務(wù)單元腫瘤學(xué)、全球營(yíng)銷�、數(shù)字與商業(yè)創(chuàng)新的主要部分,以及醫(yī)療事務(wù)與藥物警戒的部分���,由Christine Roth領(lǐng)導(dǎo)���。
3.醫(yī)師電子化信息管理文件出臺(tái)。3月19日���,國(guó)家衛(wèi)健委發(fā)布《關(guān)于進(jìn)一步推進(jìn)醫(yī)師電子化信息管理工作的通知》����,明確了各級(jí)衛(wèi)生健康行政部門(mén)進(jìn)一步推進(jìn)醫(yī)師電子化信息管理工作的具體措施和要求?���!锻ㄖ窂?qiáng)調(diào)繼續(xù)并行使用醫(yī)師電子證照和現(xiàn)行證照,明確兩者具有同等效力�。鼓勵(lì)地方不斷拓展電子證照應(yīng)用場(chǎng)景,鼓勵(lì)醫(yī)師通過(guò)醫(yī)師電子化注冊(cè)系統(tǒng)電腦端���、手機(jī)端辦理相關(guān)業(yè)務(wù)�,優(yōu)化政務(wù)服務(wù)�,提升管理水平。
評(píng)審動(dòng)態(tài)
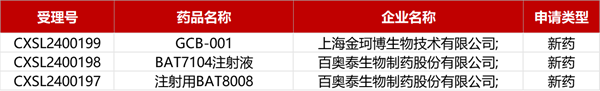
1. CDE新藥受理情況(03月21日)
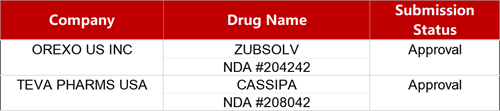
2. FDA新藥獲批情況(北美03月20日)