筆者最近在整理我國(guó)近年來(lái)間充質(zhì)干細(xì)胞產(chǎn)品的IND注冊(cè)申報(bào)情況時(shí)發(fā)現(xiàn)��,越來(lái)越多的企業(yè)開(kāi)始布局干細(xì)胞治療這一賽道�����。國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(NMPA)僅2023年受理的干細(xì)胞產(chǎn)品就有42項(xiàng)���,獲批數(shù)目就達(dá)到24項(xiàng)���,還有14個(gè)產(chǎn)品尚在評(píng)審階段���。間充質(zhì)干細(xì)胞產(chǎn)品呈井噴式爆發(fā)�����,與其經(jīng)眾多臨床數(shù)據(jù)驗(yàn)證所展示出的強(qiáng)有力的治療效果和產(chǎn)品的安全性密不可分�����。而干細(xì)胞產(chǎn)品從工藝探索��、藥學(xué)研究再到臨床轉(zhuǎn)化的階段,整體生產(chǎn)流程中需要遵循嚴(yán)格的質(zhì)量控制�����。本文將干細(xì)胞產(chǎn)品藥學(xué)研究全流程分成主要的三個(gè)階段��,按照生產(chǎn)用原材料的采集(組織/細(xì)胞采集)���,多級(jí)細(xì)胞庫(kù)的制備以及終產(chǎn)品(原液/半成品/制劑)的生產(chǎn)�����,分階段介紹關(guān)鍵的質(zhì)量研究?jī)?nèi)容���,包括過(guò)程中涉及的質(zhì)量評(píng)價(jià)項(xiàng)目�����、關(guān)鍵質(zhì)控點(diǎn)和參考質(zhì)量標(biāo)準(zhǔn)及實(shí)施案例��。
一���、組織/細(xì)胞采集階段(以臍帶源間充質(zhì)干細(xì)胞為例):
作為生產(chǎn)用起始原材料,也是整個(gè)產(chǎn)品開(kāi)發(fā)的開(kāi)端���,需要嚴(yán)格進(jìn)行供者管理�����。在臍帶采集前,需簽訂供供者捐獻(xiàn)知情同意書用于倫理審查���;在采集臍帶時(shí)��,需要篩選供者年齡、無(wú)傳染性疾病��、無(wú)遺傳性疾病��,在供者健康調(diào)查表中需統(tǒng)計(jì)過(guò)去家族病史與現(xiàn)病史��。在采集臍帶的同時(shí),可以同時(shí)采集產(chǎn)婦靜脈血與臍帶血用于病毒檢測(cè)作為物料入場(chǎng)控制��。
在臍帶的采集�����、運(yùn)輸���、接受整個(gè)過(guò)程中需保證無(wú)菌���;人源病毒檢測(cè)項(xiàng)主要包括:HIV、HAV�����、HBV�����、HCV�����、HTLV、EBV���、CMV���、HPV、B19�����、人皰疹病毒6/7/8�����、人多瘤病毒�����、腺病毒���、SARS-CoV-2等�����。
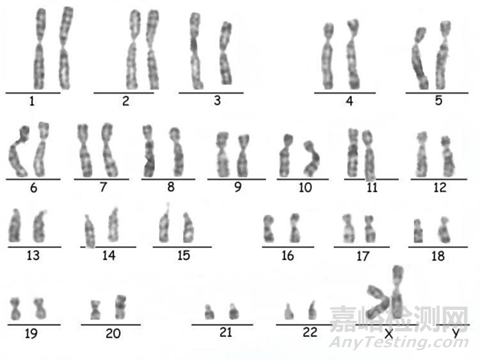
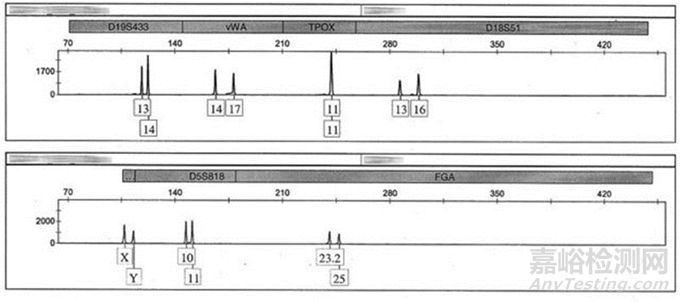
本階段檢測(cè)方法多參考藥典法條,無(wú)菌檢測(cè)通常采用藥典法中的需/厭氧菌培養(yǎng)法及薄膜過(guò)濾法。染色體核型檢測(cè)方法為G帶染色��。人源病毒檢測(cè)方法通常為凝集法���、ELISA或Q-PCR法��。
圖1:G帶染色法-染色體核型(正常為46,XX或46,XY)
圖2:STR圖譜分析報(bào)告
本階段質(zhì)量要求:1���、無(wú)菌檢查呈陰性2、產(chǎn)婦血病毒為陰性3���、染色體核型正常4�����、STR無(wú)細(xì)胞間交叉污染�����。
二���、關(guān)鍵中間體(多級(jí)細(xì)胞庫(kù))的制備階段
不同的工藝路線,其關(guān)鍵中間體也有所不同���。多數(shù)組織來(lái)源的間充質(zhì)干細(xì)胞通常會(huì)建立主細(xì)胞庫(kù)與工作細(xì)胞庫(kù)�����。在細(xì)胞凍存前會(huì)進(jìn)行放行檢驗(yàn)�����,只有符合放行質(zhì)量標(biāo)準(zhǔn)的樣品才可以用于建庫(kù)保存���。此時(shí)檢測(cè)項(xiàng)目包括細(xì)胞的生物學(xué)活性(細(xì)胞活率和細(xì)胞數(shù)�����、細(xì)胞增殖能力檢測(cè))�����、鑒別(細(xì)胞形態(tài)觀察��、細(xì)胞表面標(biāo)志物)以及微生物安全性(無(wú)菌檢測(cè)�����、支原體檢測(cè)�����、外源病毒檢測(cè)��、端粒酶活性與染色體核型檢測(cè)等)�����。
在細(xì)胞凍存入庫(kù)后�����,為了保證凍存的細(xì)胞能夠滿足后續(xù)的生產(chǎn)要求��,還要抽庫(kù)進(jìn)行更全面的質(zhì)量檢測(cè)��。主要檢項(xiàng)包括:生物學(xué)活性(細(xì)胞活率和細(xì)胞數(shù)��、細(xì)胞增殖能力)���、細(xì)胞鑒別(細(xì)胞形態(tài)觀察、細(xì)胞表面標(biāo)志物)��、生物學(xué)安全性檢查(體外成瘤性��、STR、染色體核型��、端粒酶活性)���、生物學(xué)效能(淋巴細(xì)胞增殖抑制能力���、針對(duì)特定適應(yīng)癥體外藥效調(diào)節(jié))、微生物安全性檢查(無(wú)菌��、支原體)等���。
與此同時(shí)��,考慮到維持各級(jí)細(xì)胞庫(kù)在長(zhǎng)期凍存過(guò)程中的質(zhì)量屬性���,需深入研究細(xì)胞庫(kù)的凍存穩(wěn)定性,考察現(xiàn)有凍存條件對(duì)細(xì)胞質(zhì)量的影響��,尤其是長(zhǎng)期凍存穩(wěn)定性(時(shí)間點(diǎn)包括3個(gè)月���、6個(gè)月���、一年甚至更久)���。穩(wěn)定性研究期限至少需涵蓋上市前臨床試驗(yàn)期限的要求,考察項(xiàng)目與細(xì)胞庫(kù)全檢檢項(xiàng)相同���。
本階段檢測(cè)方法與結(jié)果分析舉例:
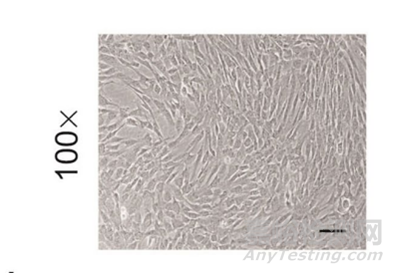
1��、細(xì)胞形態(tài)觀察
圖3:顯微鏡細(xì)胞形態(tài)觀察:應(yīng)為貼壁、長(zhǎng)梭形��、旋渦狀生長(zhǎng)[1]
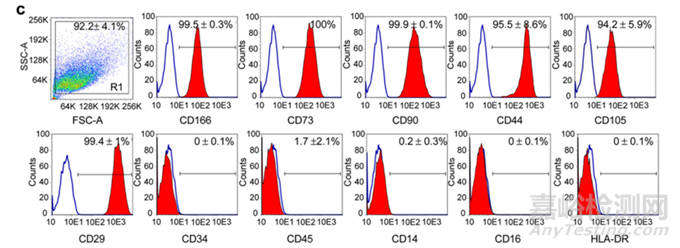
2���、細(xì)胞表面標(biāo)志物檢測(cè)
圖4:“三陽(yáng)五陰”流式表型檢測(cè)[2]:需符合可接受標(biāo)準(zhǔn)�����,可擴(kuò)展標(biāo)志物如CD166/CD44/CD133等
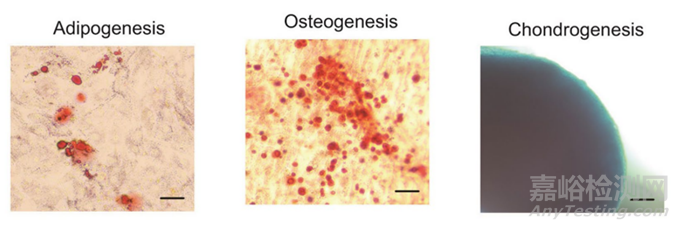
3�����、三系分化能力考察
圖5:成脂��、成骨��、成軟骨球分化照片[1]
對(duì)于三系分化能力的檢測(cè)通?�?勺鋈旧?��、Q-PCR法以及WB法鑒定誘導(dǎo)后特異性標(biāo)志物的表達(dá)��。推薦提供Q-PCR檢測(cè)特征性基因(成骨:ALP�����、Runx�����;成脂:LPL�����、PPARγ��;軟骨球:Collagen II等)代替WB法�����。
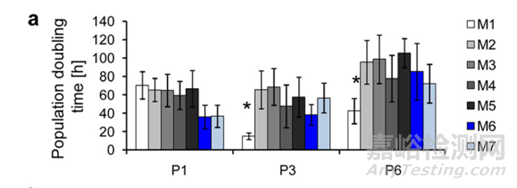
4�����、細(xì)胞數(shù)量��、活率與細(xì)胞群體倍增時(shí)間檢測(cè)
細(xì)胞數(shù)量與活率常使用細(xì)胞計(jì)數(shù)儀���,經(jīng)臺(tái)盼藍(lán)或AO/PI雙熒光染色��,統(tǒng)計(jì)細(xì)胞活率并讀取細(xì)胞數(shù)���,推算細(xì)胞收獲量。
關(guān)于細(xì)胞的增殖能力���,主要通過(guò)繪制生長(zhǎng)曲線推算細(xì)胞群體倍增時(shí)間(PDT,Population Doubling Time)���。PDT計(jì)算公式= [log2/(lgNt-lgN0)] ×T,公式中T為細(xì)胞達(dá)到平臺(tái)期的培養(yǎng)時(shí)間(96 h)�����, Nt為t時(shí)間收獲細(xì)胞數(shù)��,N0為起始接種細(xì)胞數(shù)。
圖6:細(xì)胞PDT統(tǒng)計(jì)[2]
5�����、端粒酶活性檢測(cè)
在遺傳學(xué)安全性方面�����,對(duì)細(xì)胞端粒酶活性的檢測(cè)也很關(guān)鍵���。大多數(shù)腫瘤等惡性增殖細(xì)胞具有端粒酶活性��,正常的體細(xì)胞中端粒酶常常失活�����。hTERT亞基的mRNA水平基因表達(dá)量可用來(lái)衡量端粒酶活性��。Q-PCR檢測(cè)結(jié)果應(yīng)為陰性�����,樣品即合格���。
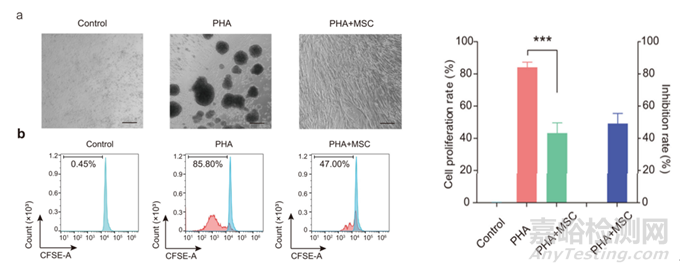
6、MSC免疫調(diào)節(jié)能力
圖7:MSC抑制人淋巴細(xì)胞增殖功能[1]
MSC具有抑制人淋巴細(xì)胞增殖的能力�����,通過(guò)CFSE標(biāo)記人PBMC活細(xì)胞��,隨細(xì)胞分裂熒光強(qiáng)度逐步減半��,通過(guò)流式檢測(cè)CFSE熒光強(qiáng)度推算子代與親代細(xì)胞比例,能夠檢測(cè)細(xì)胞的增殖能力��。通常將不同濃度的MSC與預(yù)處理激活的PBMC細(xì)胞共培養(yǎng)多天���,計(jì)算PBMC細(xì)胞增殖抑制比例。這里需要優(yōu)化共培養(yǎng)試驗(yàn)條件后�����,測(cè)試多批不同來(lái)源的PBMC���,計(jì)算合適的抑制率放行范圍��。這里不同來(lái)源的PBMC引起的結(jié)果波動(dòng)比較大,可以對(duì)使用的PBMC批號(hào)做提前篩選��,以免影響判定結(jié)果�����。
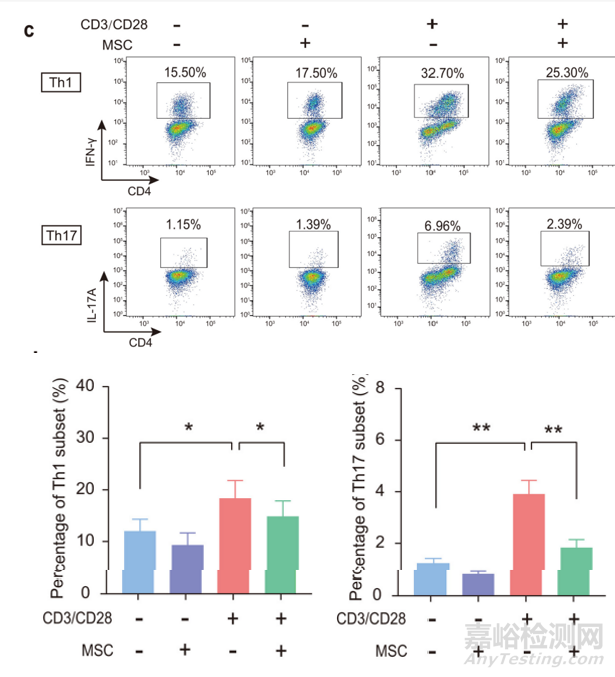
圖8:MSC調(diào)節(jié)人淋巴細(xì)胞亞群增殖功能[1]
除抑制淋巴細(xì)胞增殖外��,MSC還能夠抑制淋巴細(xì)胞Th1和Th17亞群��。
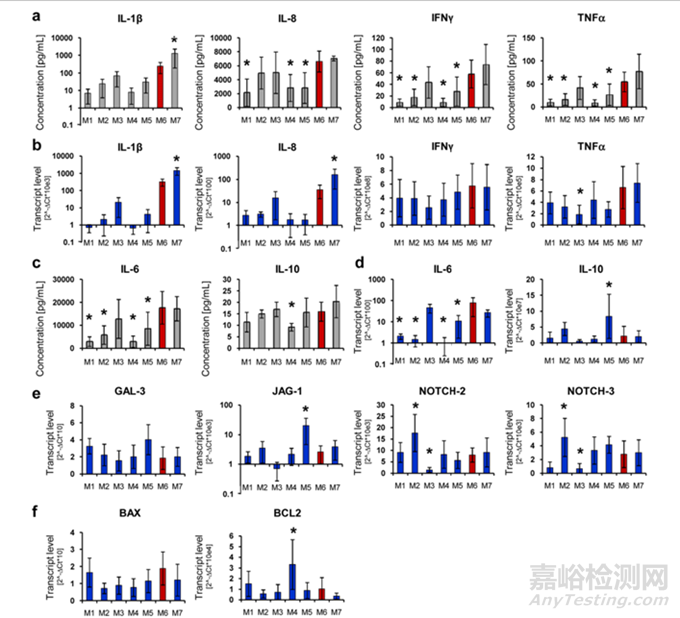
圖9:MSC調(diào)節(jié)人淋巴細(xì)胞分泌細(xì)胞因子的能力[1]
也可以選擇圖中提供的多種細(xì)胞因子���,如發(fā)揮抑炎作用的IL-10�����,促炎因子TNFα�����、INFγ等���,檢測(cè)MSC對(duì)免疫細(xì)胞分泌的細(xì)胞因子含量的影響,評(píng)估產(chǎn)品的免疫調(diào)節(jié)能力��。
對(duì)細(xì)胞庫(kù)的質(zhì)量標(biāo)準(zhǔn)(可參考):
1、生物學(xué)活性:細(xì)胞活率不低于80%���,增殖能力細(xì)胞倍增時(shí)間在20-30 h�����;
2���、細(xì)胞鑒別:形態(tài)觀察為長(zhǎng)梭形、成纖維細(xì)胞樣�����,細(xì)胞表面標(biāo)志物流式結(jié)果應(yīng)滿足ISCT最低檢定標(biāo)準(zhǔn)的CD73/90/105+>95%�����,CD19/34/45/11b�����、HLA-DR+<2%��,具有向成骨�����、成軟骨�����、成脂分化能力��;
3��、生物學(xué)安全性檢查:體外成瘤實(shí)驗(yàn)應(yīng)無(wú)成瘤�����,STR檢測(cè)無(wú)細(xì)胞間交叉污染���,染色體核型正常,端粒酶活性應(yīng)為陰性�����;
4�����、微生物安全性檢查:無(wú)菌/支原體檢查應(yīng)為陰性,人源病毒檢測(cè)應(yīng)為陰性��;
5�����、生物學(xué)效能考察:間充質(zhì)干細(xì)胞對(duì)淋巴細(xì)胞增殖抑制功能應(yīng)為抑制��,對(duì)淋巴細(xì)胞分泌細(xì)胞因子功能應(yīng)為抑制��。
三��、對(duì)原液和制劑的質(zhì)量控制
對(duì)于終產(chǎn)品的質(zhì)量也需要做全面檢測(cè)��。在輔料加入前�����,對(duì)原液的質(zhì)量檢測(cè)包括:理化性質(zhì)(滲透壓檢測(cè))��、細(xì)胞鑒別(形態(tài)與活率數(shù)量��、染色體核型���、STR�����、流式表面標(biāo)志物表型)�����、生物學(xué)效能(三系分化能力�����、細(xì)胞因子分泌���、免疫抑制能力等)、生物學(xué)安全性(軟瓊脂克隆形成�����、端粒酶活性)�����、外源成分殘留(凍存液DMSO���、BSA���、慶大霉素等)和微生物檢測(cè)(無(wú)菌�����、支原體��、內(nèi)毒素���、人源病毒檢測(cè))���。
原液通過(guò)加入輔料以及灌裝后形成制劑���。相應(yīng)的檢項(xiàng)在此時(shí)也最為全面,包括理化特性(滲透壓�����、pH��、產(chǎn)品外觀���、可見(jiàn)異物及裝量)�����、細(xì)胞鑒別(形態(tài)與活率數(shù)量��、染色體核型�����、STR�����、流式表面標(biāo)志物表型���、同工酶、STR��、細(xì)胞周期�����、凋亡及衰老�����、細(xì)胞倍增時(shí)間及克隆形成率等)、生物學(xué)效能(三系分化���、細(xì)胞因子分泌��、免疫細(xì)胞抑制調(diào)節(jié)和不同疾病細(xì)胞模型的藥效調(diào)節(jié))���、生物學(xué)安全性(軟瓊脂克隆形成、端粒酶活性)���、殘留檢測(cè)(DMSO���、TrypLE消化酶、殘余培養(yǎng)基)���、微生物安全性(支原體��、無(wú)菌��、厭氧/需氧菌���、內(nèi)毒素��、人源性病毒檢測(cè))�����。作為輸注入人體前的最后一道關(guān)卡�����,對(duì)制劑的檢項(xiàng)最為全面��,能夠保證在臨床應(yīng)用時(shí)的安全性。
這里需要注意�����,產(chǎn)品與工藝相關(guān)雜質(zhì)可結(jié)合穩(wěn)定合理的工藝清除驗(yàn)證進(jìn)行分析控制�����。不同工藝過(guò)程中���,對(duì)終產(chǎn)品中存在殘留并且可能影響干細(xì)胞產(chǎn)品質(zhì)量和安全有效性的工藝相關(guān)雜質(zhì)�����,例如BSA���、消化酶���、凍存液成分,或者有些工藝中涉及分選和三維條件下微載體培養(yǎng)等��,應(yīng)關(guān)注相關(guān)成分殘留檢測(cè)做為放行控制�����。
對(duì)制劑的質(zhì)量標(biāo)準(zhǔn)(可參考):
1�����、理化:產(chǎn)品外觀應(yīng)符合標(biāo)準(zhǔn)���,pH范圍在6.0-8.0��,滲透壓范圍在1500~2000 mOsmol/kg��,可見(jiàn)異物不超限���,裝量應(yīng)符合產(chǎn)品規(guī)格��;
2���、雜質(zhì):死細(xì)胞比例應(yīng)低于25%,雜細(xì)胞比例<2%�����,DMSO含量應(yīng)≤8 ug/mL�����,消化液含量應(yīng)≤15ng/mL ��,培養(yǎng)基殘留量應(yīng)≤0.125mg/mL�����;
理化和雜質(zhì)為制劑階段增加的檢項(xiàng)���,此外對(duì)細(xì)胞鑒別、安全性檢查��、生物學(xué)效能的檢測(cè)項(xiàng)與質(zhì)量標(biāo)準(zhǔn)與前文對(duì)細(xì)胞庫(kù)的質(zhì)量標(biāo)準(zhǔn)相同�����,可參考前文內(nèi)容。
干細(xì)胞生產(chǎn)過(guò)程中不可避免的需要經(jīng)過(guò)傳代�����,可能會(huì)存在基因組特性的轉(zhuǎn)變��,隨著傳代代次增加��,其遺傳不穩(wěn)定性風(fēng)險(xiǎn)也越高��,也可能造成細(xì)胞異質(zhì)性��。根據(jù)《中國(guó)藥典》2020年版對(duì)于生物制品穩(wěn)定性試驗(yàn)的指導(dǎo)原則�����,還需要對(duì)包括傳代穩(wěn)定性���、制劑加速與長(zhǎng)期保存穩(wěn)定性�����、制劑模擬運(yùn)輸條件穩(wěn)定性�����、聯(lián)合使用穩(wěn)定性等進(jìn)行考察以保證產(chǎn)品質(zhì)量可控��。傳代穩(wěn)定性需要明確體外生產(chǎn)限制傳代的代次與臨床上使用的細(xì)胞代次���,在確定的工藝代次基礎(chǔ)上繼續(xù)傳代并進(jìn)行細(xì)胞生長(zhǎng)鑒別與遺傳穩(wěn)定性考察�����。制劑的加速和長(zhǎng)期保存研究則需要對(duì)制劑在不同取樣時(shí)間(4h�����、8h�����、12h、24h等)和溫度環(huán)境(4℃��、25℃��、37℃避光等條件)考察相關(guān)指標(biāo)��。運(yùn)輸穩(wěn)定性研究中,考慮到模擬運(yùn)輸條件��、冷鏈保存和使用過(guò)程中的常規(guī)與極端情況等�����,可以假設(shè)運(yùn)輸過(guò)程為顛簸路面��,運(yùn)輸時(shí)間在8-12 h間��,且在開(kāi)始運(yùn)輸和運(yùn)輸終點(diǎn)的首尾脫離冷鏈暴露于25℃環(huán)境���。還需要進(jìn)行制劑聯(lián)合使用穩(wěn)定性的研究��,在制劑制備后到臨床使用期間���,按照冷鏈保存-運(yùn)輸-臨床使用等場(chǎng)景,考察整個(gè)過(guò)程對(duì)細(xì)胞的質(zhì)量是否存在影響��。藥企還需制定產(chǎn)品上市批準(zhǔn)后的穩(wěn)定性研究計(jì)劃���,用來(lái)保證藥品批準(zhǔn)上市后的主細(xì)胞庫(kù)��、工作細(xì)胞庫(kù)��、原液與制劑的長(zhǎng)期穩(wěn)定性�����。
四���、小結(jié)
本文按照干細(xì)胞產(chǎn)品開(kāi)發(fā)流程���,煎蛋梳理了過(guò)程中的關(guān)鍵質(zhì)量研究?jī)?nèi)容,并對(duì)過(guò)程中涉及的質(zhì)控點(diǎn)��、評(píng)價(jià)項(xiàng)和可參考的質(zhì)量標(biāo)準(zhǔn)做了舉例說(shuō)明��。細(xì)胞治療產(chǎn)品因?yàn)槿淌褂玫幕畹募?xì)胞��,因此對(duì)其安全性�����、生物學(xué)有效性的考量更加嚴(yán)格���。在產(chǎn)品開(kāi)發(fā)過(guò)程中,深入學(xué)習(xí)藥典和CDE發(fā)布的指導(dǎo)原則將更好的幫助我們開(kāi)發(fā)出穩(wěn)定��、有效且安全的產(chǎn)品。
五�����、參考資料
1��、Stem Cell Reviews and Reports DOI/10.1007/s12015-023-10556-8
2��、J Mol Med (2017) 95:205–220 DOI 10.1007/s00109-016-1471-7
3��、細(xì)胞治療產(chǎn)品研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)(2017年12月22日發(fā)布)
4���、人源干細(xì)胞產(chǎn)品藥學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)(2023年4月25日發(fā)布)
5���、中國(guó)藥典2020版三部、四部-生物制品穩(wěn)定性試驗(yàn)的指導(dǎo)原則
6���、免疫細(xì)胞治療產(chǎn)品藥學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)(2022年5月26日發(fā)布)