在2022年11月�����,由RDPAC 的藥學(xué)團(tuán)隊(duì)對(duì)中美歐藥學(xué)技術(shù)指導(dǎo)原則和指南進(jìn)行了調(diào)研與對(duì)比�����,總結(jié)分析了中美歐指南的標(biāo)準(zhǔn)差異及實(shí)施情況差異�����,采用了主題詞及分類方式����、深度對(duì)比、報(bào)告撰寫(xiě)和定稿流程�,最后呈現(xiàn)研究報(bào)告,給到藥審中心參考���。
目前�,ICH 主要國(guó)家實(shí)踐上�����,允許批準(zhǔn)前生產(chǎn)批次(包括驗(yàn)證批次��,檢查和非檢查批次) 上市銷售��。而我國(guó) NDA 和上市后變更中的批準(zhǔn)(和備案)后執(zhí)行日期定義不清晰 , 造成批準(zhǔn)(或 備案)前生產(chǎn)批次可否上市不清晰���,給患者用藥和供應(yīng)鏈造成一定風(fēng)險(xiǎn)���。建議以問(wèn)與答的形式�, 明確對(duì)執(zhí)行日期的定義�����,明確在上市許可批準(zhǔn)和變更批準(zhǔn)或備案前生產(chǎn)的批次滿足一定條件后����, 比如 GMP 條件��,放行條件等�����,即可上市銷售�����。推薦加急制定���。
原因分析:
• 歐美日現(xiàn)行指南:
對(duì)于歐美日中��,批準(zhǔn)前生產(chǎn)批次(包括驗(yàn)證批次���,檢查和非檢查批次)可上市銷售的要求 對(duì)比詳見(jiàn)表格 17 和表格 18.
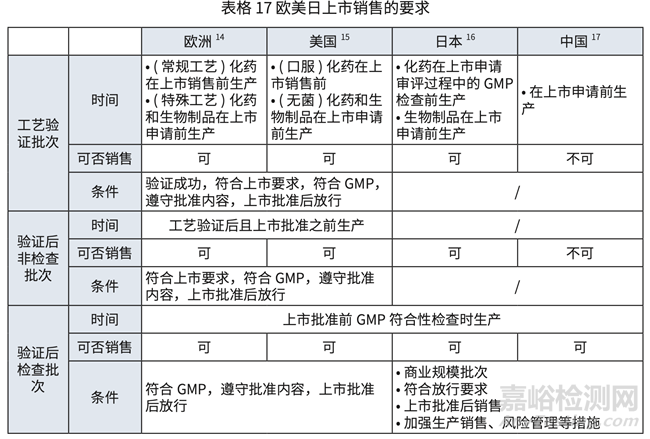
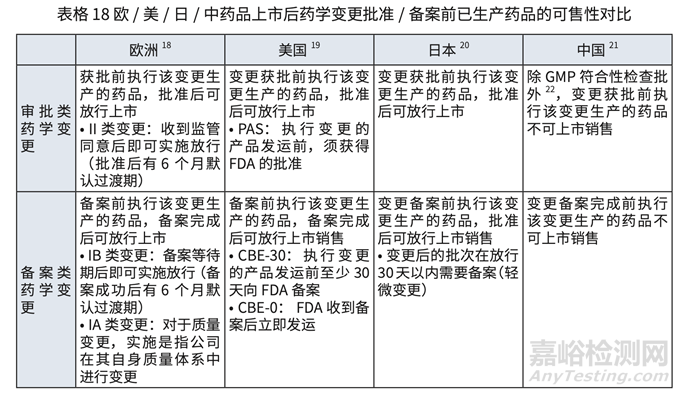
• 中國(guó)實(shí)施問(wèn)題
NDA 和上市后變更中的批準(zhǔn)(和備案)后執(zhí)行日期理解為生產(chǎn)日期 , 造成批準(zhǔn)(或備案) 后方可生產(chǎn)���,之前生產(chǎn)的批次無(wú)法上市。
以“生產(chǎn)日期”作為注冊(cè)批準(zhǔn)(藥品上市許可和上市后變更)實(shí)施監(jiān)管節(jié)點(diǎn)在實(shí)際工作中 的影響����,RDPAC 在會(huì)員公司內(nèi)發(fā)起了調(diào)研(報(bào)告請(qǐng)參見(jiàn)附件),從獲得的數(shù)據(jù)分析發(fā)現(xiàn):
1. 新藥供應(yīng)中國(guó)市場(chǎng)的延遲:藥品上市許可獲批后在執(zhí)行“批準(zhǔn)后方可生產(chǎn)”的情況下�����, 境外生產(chǎn)新藥(臨床急需品種除外)從上市批準(zhǔn)到供應(yīng)中國(guó)市場(chǎng)的時(shí)間差約為 7 個(gè)月(中 位值)����,且年度生產(chǎn)批次少的罕見(jiàn)病新藥通常需要更長(zhǎng)時(shí)間�����,導(dǎo)致患者難以盡早獲益已 批準(zhǔn)的新藥��。對(duì)于境外生產(chǎn)的臨床急需品種,由于允許上市供應(yīng)批準(zhǔn)前生產(chǎn)的批次��,時(shí) 間差可縮短為 2 ~ 3 個(gè)月����,與境內(nèi)生產(chǎn)的藥品從批準(zhǔn)到供應(yīng)的時(shí)間差相當(dāng)��。
2. 增加供應(yīng)短缺和患者可及性的風(fēng)險(xiǎn):藥品上市后藥學(xué)變更因境內(nèi)外不能同步報(bào)批且需執(zhí) 行“批準(zhǔn)后方可生產(chǎn)”的要求����,從境外實(shí)施變更到境內(nèi)供應(yīng)變更后藥品之間的時(shí)間差長(zhǎng) 達(dá) 19 個(gè)月(中位值)�����。其中�����,執(zhí)行“批準(zhǔn)后方可生產(chǎn)”引起的時(shí)間差約 9 個(gè)月(中位值)。 由此��,該期間行業(yè)僅能依靠提前積壓數(shù)千萬(wàn)至數(shù)億元資金備貨以維持中國(guó)市場(chǎng)的供應(yīng)����, 且備貨通常僅可維持最多 9 個(gè)月的供應(yīng),發(fā)生斷藥的風(fēng)險(xiǎn)較高��。
總之�,以“生產(chǎn)日期”作為注冊(cè)批準(zhǔn)實(shí)施監(jiān)管節(jié)點(diǎn)對(duì)確保臨床患者用藥可及性以及行業(yè)運(yùn)營(yíng)帶來(lái)很大的困難�。
• 相關(guān)的國(guó)內(nèi)監(jiān)管法規(guī) :
《中華人民共和國(guó)藥品管理法實(shí)施條例(修訂草案征求意見(jiàn)稿)》第六十條【注冊(cè)前規(guī)模批藥品上市銷售】質(zhì)量標(biāo)準(zhǔn)����、生產(chǎn)工藝與注冊(cè)證書(shū)一致的商業(yè)規(guī)模批次藥品�����,其生產(chǎn)過(guò)程符合藥品生產(chǎn)質(zhì)量管理規(guī)范的��,在取得藥品注冊(cè)證書(shū)后����,符合產(chǎn)品放行要求的����,可以上市銷售;藥 品上市許可持有人應(yīng)當(dāng)對(duì)其加強(qiáng)生產(chǎn)銷售管理和風(fēng)險(xiǎn)管理。
建議:
盡快出臺(tái) Q&A 對(duì)執(zhí)行日期進(jìn)行明確定義�,明確在上市許可批準(zhǔn)和變更批準(zhǔn)或備案前生產(chǎn) 的批次滿足一定條件后����,比如 GMP 條件,放行條件等�����,即可上市銷售���。
1. 充分落實(shí) MAH 制度,按照《藥品管理法》“第二十四條”精神����,“以藥品的‘質(zhì)量受權(quán) 人放行日期’(簡(jiǎn)稱放行日期)作為注冊(cè)批準(zhǔn)后的實(shí)施時(shí)間,適用于藥品上市許可和上 市后變更的注冊(cè)批準(zhǔn)�����。”
2. 境外藥品無(wú)論在進(jìn)口環(huán)節(jié)還是在市場(chǎng)流通環(huán)節(jié),注冊(cè)批準(zhǔn)的執(zhí)行情況均可通過(guò)查驗(yàn)隨貨 同行的藥品檢驗(yàn)報(bào)告書(shū)(CoA)上載明的“放行日期”���,并通過(guò)相關(guān)文件溯源以達(dá)到有效監(jiān)管的目的�。
參考文獻(xiàn)
1.國(guó)內(nèi)外藥品技術(shù)指導(dǎo)原則體系對(duì)比研究 (藥學(xué)部分》�����,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心��,中國(guó)藥品監(jiān)督管理研究會(huì)��,藥品監(jiān)管研究國(guó)際交流專業(yè)委員會(huì)����,中國(guó)外商投資企業(yè)協(xié)會(huì)藥品研制和開(kāi)發(fā)工作委員會(huì)(RDPAC)����,2022年11月



