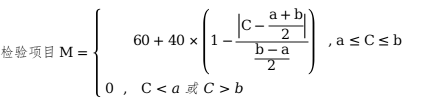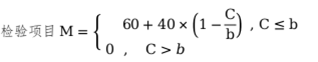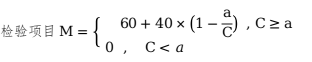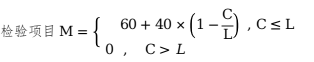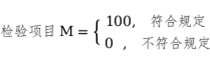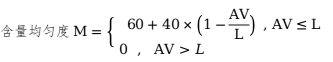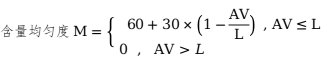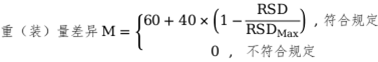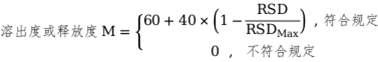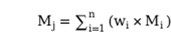剛剛���,國家藥監(jiān)局發(fā)布《藥品抽檢探索性研究原則及程序》,內(nèi)容如下:
藥品抽檢探索性研究原則及程序
根據(jù)監(jiān)管工作需要���,藥品監(jiān)管部門及其設(shè)置或指定的藥品檢驗機構(gòu)(以下簡稱“承檢機構(gòu)”)可以采用藥品標(biāo)準(zhǔn)以外的檢驗項目和檢驗方法開展探索性研究�����,為防控潛在風(fēng)險隱患�����、提升藥品質(zhì)量水平���、加強藥品監(jiān)管提供技術(shù)支撐���。
1、適用范圍
探索性研究是指在藥品抽檢中���,除按照藥品標(biāo)準(zhǔn)進(jìn)行檢驗并判定藥品是否符合標(biāo)準(zhǔn)規(guī)定之外�,根據(jù)監(jiān)管工作需要�,進(jìn)一步針對抽檢樣品可能存在的質(zhì)量風(fēng)險,采用藥品標(biāo)準(zhǔn)以外的檢驗項目和檢測方法對藥品質(zhì)量進(jìn)行進(jìn)一步分析研究的過程�����,可為防控潛在風(fēng)險隱患�、提升藥品質(zhì)量水平、加強藥品監(jiān)管提供技術(shù)支撐�����。
本原則及程序主要適用于在藥品抽檢中按程序開展的探索性研究�����,以及基于檢驗和探索性研究結(jié)果對抽檢品種質(zhì)量狀況進(jìn)行的相關(guān)分析工作�。
2、探索性研究基本原則
2.1探索性研究針對可能影響藥品質(zhì)量的相關(guān)因素開展���,應(yīng)以服務(wù)監(jiān)管為目的�,結(jié)合監(jiān)管實際需要和藥品工業(yè)化生產(chǎn)實際開展,相關(guān)結(jié)果需轉(zhuǎn)為具體的監(jiān)管措施或切實可行的監(jiān)管建議���。
2.2除有特殊監(jiān)管需求外���,開展探索性研究的品種遴選參考《藥品質(zhì)量抽查檢驗管理辦法》第十一條規(guī)定,組織抽檢的藥品監(jiān)管部門應(yīng)對擬開展探索性研究的品種進(jìn)行研究�����,包括確定最少抽檢批次數(shù)���、抽樣環(huán)節(jié)、企業(yè)覆蓋比例���、文號覆蓋比例等�,以確保抽取的樣品具有足夠的代表性���。
原則上�����,開展探索性研究品種的在產(chǎn)藥品上市許可持有人(以下簡稱“持有人”)數(shù)量應(yīng)不少于3家���。少于等于3家在產(chǎn)持有人的�,樣品應(yīng)實現(xiàn)全覆蓋�;多于3家在產(chǎn)持有人的,抽取樣品應(yīng)覆蓋全部在產(chǎn)持有人數(shù)的70%以上�。
2.3開展探索性研究工作,承檢機構(gòu)應(yīng)充分了解相關(guān)品種的歷史沿革�、處方工藝、不良反應(yīng)�����、質(zhì)量標(biāo)準(zhǔn)和檢驗方法的適用及變更�����、持有人數(shù)量���、在產(chǎn)情況�、市場分布�����、監(jiān)管歷史等,可采用問卷�、函調(diào)、電話�����、現(xiàn)場交流等方式進(jìn)行調(diào)研�����,深入了解國內(nèi)首研首仿生產(chǎn)企業(yè)及品種情況�,充分掌握承檢品種在安全性、有效性�����、質(zhì)量可控性等方面的現(xiàn)狀和可能存在的問題�,研究制定有針對性的探索性研究方案,避免重復(fù)研究或過度研究�。
2.4探索性研究應(yīng)針對藥品的不同特性開展���,承檢機構(gòu)應(yīng)結(jié)合臨床應(yīng)用及藥物性質(zhì)�,以實際研究結(jié)果和數(shù)據(jù)積累為基礎(chǔ)���,選擇恰當(dāng)?shù)慕y(tǒng)計學(xué)分析方法開展處方�����、生產(chǎn)工藝與穩(wěn)定性���、有效性���、安全性等方面的關(guān)聯(lián)性評價,建立多元化的藥品質(zhì)量評價體系���,采用的評價分析方法須保證科學(xué)性和合理性�。
2.5探索性研究應(yīng)科學(xué)�、規(guī)范開展,相關(guān)程序應(yīng)符合藥品檢驗和實驗室管理相關(guān)規(guī)定�。除有特殊要求外,不得有針對性地對某一企業(yè)品種開展單獨的探索性研究�。
2.6在探索性研究中發(fā)現(xiàn)涉嫌違法違規(guī)線索及其他質(zhì)量安全隱患的,承檢機構(gòu)不得擅自向相關(guān)企業(yè)�、單位、個人泄露�����,不得擅自前往相關(guān)企業(yè)或單位開展調(diào)研、檢查���、現(xiàn)場實驗等工作�;確需進(jìn)一步了解核實相關(guān)情況�����,應(yīng)與相關(guān)企業(yè)或單位所在地省級藥品監(jiān)管部門聯(lián)系�����,或向組織探索性研究的藥品監(jiān)管部門報告�。
2.7在探索性研究中發(fā)現(xiàn)存在問題隱患,需要進(jìn)一步開展研究的�����,不受任務(wù)時限要求限制�,應(yīng)繼續(xù)深入研究;發(fā)現(xiàn)問題線索的���,應(yīng)及時按程序報告。
3、探索性研究工作要點
探索性研究應(yīng)針對處方工藝���、現(xiàn)行標(biāo)準(zhǔn)與質(zhì)量存在的主要或重要缺陷�����、標(biāo)準(zhǔn)檢驗中發(fā)現(xiàn)的問題等影響藥品質(zhì)量的關(guān)鍵因素開展�,如非法添加�����、溶出曲線�����、含量均勻度分布曲線�、包材相容性等,并提出解決問題的辦法或建議���;一般不得重復(fù)新藥臨床前研究與I期臨床研究的內(nèi)容�����,如藥物合成路徑�、穩(wěn)定性試驗(不包括影響因素實驗)、藥理�、毒理、生物利用度�、生物等效性等有關(guān)研究。
對于某些劑型(如眼用制劑���、注射劑)�,可以針對處方合理性開展刺激性�����、溶血性等藥理實驗���,也可對雜質(zhì)進(jìn)行初步毒理等方面的研究�。
以下歸納了部分藥品類別及劑型的探索性研究要點�,未涵蓋的藥品類別及劑型���,可參照開展探索性研究���。
3.1化學(xué)藥
3.1.1口服固體制劑
針對標(biāo)準(zhǔn)較簡單、關(guān)鍵質(zhì)量控制指標(biāo)缺失或存在一定問題���、未通過一致性評價的仿制藥�、地標(biāo)升國標(biāo)等品種,建議重點關(guān)注溶出度���、釋放度�、有關(guān)物質(zhì)等研究�����。已經(jīng)通過一致性評價的品種�����,除承檢機構(gòu)發(fā)現(xiàn)可能影響藥品質(zhì)量的問題外,不建議做大量的溶出度探索性研究�,可通過適當(dāng)?shù)呐g溶出曲線比較,考察其工藝穩(wěn)定性和一致性情況�����。
3.1.1.1溶出度或釋放度���。與國外標(biāo)準(zhǔn)比較���;方法�����、介質(zhì)類型���、介質(zhì)pH與體積、轉(zhuǎn)速�����、取樣時間與限度設(shè)置的科學(xué)性與合理性�����;可參照仿制藥一致性評價的技術(shù)要求�����,根據(jù)每個品種的特殊性���,科學(xué)合理設(shè)定研究項目。
3.1.1.2有關(guān)物質(zhì)�����。與國外標(biāo)準(zhǔn)比較�����;考慮薄層色譜(TLC)法的分離度與檢測限�,高效液相色譜(HPLC)法的專屬性和檢測靈敏度�,關(guān)注檢測器參數(shù)設(shè)置,紫外光譜(UV)重點關(guān)注檢測波長�、蒸發(fā)光散射(ELSD)重點關(guān)注不同類型參數(shù)設(shè)定等、進(jìn)樣濃度�、供試品與對照品制備用溶劑(特別關(guān)注部分特殊品種的溶劑效應(yīng));雜質(zhì)限度設(shè)定的合理性;對于含量大于0.1%的未知雜質(zhì)���,可采用多種方法進(jìn)行結(jié)構(gòu)分析;對有關(guān)物質(zhì)測定方法的合理性進(jìn)行評價,如需測定校正因子,建議采用斜率比法,優(yōu)先考慮主成分自身對照法的可行性;需要時可進(jìn)一步考察雜質(zhì)的毒理作用影響,或檢測方法中有毒有害試劑的毒性影響等研究內(nèi)容。
分析雜質(zhì)來源,明確雜質(zhì)的引入途徑,探討降低雜質(zhì)的方法�����;分析有關(guān)物質(zhì)與處方工藝、包裝材料等的關(guān)系,特別是原料藥質(zhì)量���、制粒工藝�����、成型工藝等���,并考慮輔料與有關(guān)物質(zhì)降解的關(guān)系;分析水分等多種因素與藥物穩(wěn)定性、有關(guān)物質(zhì)產(chǎn)生是否有關(guān)。
3.1.1.3元素雜質(zhì)殘留�����。結(jié)合生產(chǎn)工藝進(jìn)行考察�����;特別關(guān)注原料藥中使用金屬催化劑的情況���,以及其他易引入元素雜質(zhì)的情況�;如有發(fā)現(xiàn)其他毒性雜質(zhì)應(yīng)進(jìn)一步考慮其毒性影響。
3.1.1.4有機溶劑殘留。結(jié)合生產(chǎn)工藝進(jìn)行考察�;關(guān)注固體制劑品種生產(chǎn)過程中使用的有機溶劑殘留情況�。
3.1.2注射劑
重點關(guān)注與臨床給藥方式相關(guān)的用藥合理性�、安全性、有關(guān)物質(zhì)���、滲透壓�����、添加劑(穩(wěn)定劑���、抗氧劑、助溶劑���、等滲劑等)�����、pH值�����、溶液澄清度與顏色、不溶性微粒與可見異物等方面。
3.1.2.1安全性。分析滅菌工藝的合理性,關(guān)注F0值�,對F0值小于8的工藝分析其是否還有其他手段來保證滅菌有效性(如:用0.22μm以下濾膜過濾�����、全密閉灌裝與封口等);關(guān)注滅菌條件對藥物穩(wěn)定性的影響���;關(guān)注細(xì)菌內(nèi)毒素方法與限度���、熱原的給藥劑量以及熱原檢查替代方法的研究。
3.1.2.2有關(guān)物質(zhì)。同3.1.1.2。
3.1.2.3滲透壓。關(guān)注靜脈注射用或椎管注射用小容量注射劑的滲透壓范圍�����,處方工藝的改變、添加劑的加入等方面。
3.1.2.4添加劑。關(guān)注添加劑的品種�、加入量、加入的必要性�、合理性以及對藥物穩(wěn)定性的影響�����。
3.1.2.5可見異物�。關(guān)注與包材的關(guān)聯(lián)性等���。
3.1.3無菌分裝的注射用粉針
重點關(guān)注晶型�、溶液的澄清度與顏色���、有關(guān)物質(zhì)�、溶劑殘留���、包材(如膠塞)相容性�、包材(如硅硼玻璃)多種元素雜質(zhì)的殘留�;對于有可能產(chǎn)生聚合物的品種,建議考察其聚合物的水平���,并應(yīng)評價測定方法的科學(xué)性和合理性�,考察聚合物與有關(guān)物質(zhì)之間的相關(guān)性���;探討有關(guān)物質(zhì)測定方法取代聚合物測定方法的可行性���;考察不同方法測定結(jié)果之間的相關(guān)性�。
3.1.4滴眼劑
該劑型屬無菌制劑�����,應(yīng)對其安全性給予關(guān)注�,參考注射劑項下相關(guān)要求進(jìn)行研究,同時應(yīng)重點關(guān)注滲透壓�����、pH���、無菌、可見異物���、不溶性微粒�����、金屬性異物等研究項目;關(guān)注緩沖劑與抑菌劑種類���、用量合理性、抑菌效力及其對藥物穩(wěn)定性的影響���;關(guān)注開啟后的微生物污染情況���;適當(dāng)考慮對滴眼液的黏度的評價,分析處方的合理性���、工藝穩(wěn)定性和使用中的穩(wěn)定性���;適當(dāng)考慮包裝材料、容器或包裝方式對其抑菌效力等質(zhì)量穩(wěn)定性的影響�。
3.1.5生化藥品
3.1.5.1動物來源生化藥品。關(guān)注動物的種屬是否存在混用或代用���;通過考察組胺���、動物感染微生物的蛋白或核酸殘留來驗證使用的動物是否符合檢疫的要求;關(guān)注生產(chǎn)工藝能否有效去除雜蛋白或核酸殘留�����;關(guān)注添加劑與滲透壓;關(guān)注高分子物質(zhì)�����;考察輔料對含量測定的干擾�;關(guān)注活力測定方法的專屬性;關(guān)注抗生素殘留問題�;關(guān)注標(biāo)準(zhǔn)中未涉及的安全性項目(如:過敏反應(yīng),異常毒性���,熱原或細(xì)菌內(nèi)毒素等)���。
3.1.5.2合成肽類生化藥品。重點關(guān)注純度與有關(guān)物質(zhì)方面���。
3.1.5.3多糖類生化藥品���。關(guān)注多糖的分子量與分子量分布及其測定方法的科學(xué)性���;關(guān)注在水系溶液中多糖分子水合化對分子量測定的影響���;關(guān)注生物來源雜質(zhì)�;此外對于取代多糖還應(yīng)關(guān)注取代度���。
3.1.6其他制劑�����。結(jié)合其劑型的質(zhì)量特性�,重點關(guān)注與其風(fēng)險點及關(guān)鍵質(zhì)量參數(shù)相關(guān)的項目(如:高水活性液體口服制劑�����,可結(jié)合工藝評估洋蔥伯克霍爾德菌污染風(fēng)險或其他不可接受微生物污染風(fēng)險)�。
3.2中成藥
3.2.1口服制劑
3.2.1.1藥材、飲片�。重點關(guān)注提取物是否有質(zhì)控指標(biāo)進(jìn)行控制,質(zhì)控指標(biāo)的選擇是否科學(xué)�,質(zhì)控指標(biāo)的限度是否合理等;關(guān)注藥材的基原���、產(chǎn)地�����,關(guān)注藥材品質(zhì)���;考察是否存在生產(chǎn)過程中投入使用假劣藥材或飲片的情況(如:使用染色藥材�、硫磺熏蒸藥材���、增重藥材�,使用非藥用部位�����,冒充貴細(xì)藥材等)�。關(guān)鍵中間體研究可參照《中藥新藥質(zhì)量研究技術(shù)指導(dǎo)原則》,關(guān)注質(zhì)控指標(biāo)與藥材品質(zhì)�、生產(chǎn)工藝是否正相關(guān)。
3.2.1.2生產(chǎn)工藝�����。關(guān)注不同企業(yè)不同生產(chǎn)工藝對藥品質(zhì)量的影響�����,特別是藥材前處理情況�����,是否切片或粉碎���,切片的厚度及粉碎的粒度�����;藥材煎煮或提取時間���;生產(chǎn)工藝中有效成分的轉(zhuǎn)移率等;考察是否存在未按批準(zhǔn)的處方投料�、未按批準(zhǔn)的工藝生產(chǎn)等情況,是否存在摻偽投料���、少投料以及未按處方進(jìn)行提取物投料或原粉投料;結(jié)合不同年齡群體可能的敏感性�,考慮中藥、天然藥物的特點���;關(guān)注中成藥中添加的藥用輔料的合理性���,尤其是防腐劑、增溶劑、著色劑���、矯味劑的種類和用量對于藥效的影響。蜜丸應(yīng)關(guān)注蜂蜜用量與質(zhì)量�。
3.2.1.3質(zhì)量控制。重點關(guān)注無專屬性檢驗項目或?qū)傩詸z驗項目較少的品種���;重點關(guān)注標(biāo)準(zhǔn)中未控制的藥味�,包括定性與定量�;可嘗試用指紋圖譜、特征圖譜���、一標(biāo)多測���、浸出物或固形物等項目來控制;針對處方含毒性藥味或現(xiàn)代研究表明含有毒性成分的藥味���,應(yīng)關(guān)注毒性成分的質(zhì)量控制�。
3.2.1.4安全性���。如有藥材原粉投料���,應(yīng)關(guān)注農(nóng)藥殘留、重金屬�����、微生物�����、植物生長調(diào)節(jié)劑等�����;如有朱砂���、雄黃等藥味�����,應(yīng)關(guān)注汞與砷的價態(tài)�����;如有易霉變藥材�����,應(yīng)關(guān)注真菌毒素���;如存在關(guān)鍵中間體的制備�����,應(yīng)關(guān)注有機溶劑殘留���、樹脂殘留等;如有動物藥原粉投料�����,還應(yīng)關(guān)注獸藥殘留���。
3.2.2注射劑
3.2.2.1藥材�����、飲片�����。同3.2.1.1�。
3.2.2.2生產(chǎn)工藝。生產(chǎn)工藝的合理性�、科學(xué)性;特別是分析滅菌工藝的合理性�����,滅菌條件對藥物穩(wěn)定性的影響���。
3.2.2.3外觀。關(guān)注溶液的顏色及其均一性�、澄清度、不溶性微粒與可見異物�����。
3.2.2.4添加劑�����。重點關(guān)注表面活性劑的種類�����、來源與加入量,關(guān)注穩(wěn)定劑�、抗氧化劑與等滲劑等。
3.2.2.5滲透壓�����。關(guān)注滲透壓范圍���;關(guān)注影響中藥注射劑滲透壓的因素:如有機溶劑�、無機雜質(zhì)���、有機雜質(zhì)���、添加劑都會導(dǎo)致滲透壓升高,或影響滲透壓測定時無法析出冰晶的情況�����。
3.2.2.6高分子雜質(zhì)�。重點關(guān)注殘留異性蛋白、鞣質(zhì)等高分子雜質(zhì)�����,可采用高靈敏度的方法進(jìn)行研究。
3.2.2.7質(zhì)量控制�����。關(guān)注熱原�����、無菌�����、異常毒性�、過敏反應(yīng)���、降壓物質(zhì)等安全性項目���;關(guān)注吐溫80等助溶劑的用量,評估對安全性帶來的影響�。
3.2.3軟膏劑
3.2.3.1藥材、飲片�。同3.2.1.1。
3.2.3.2生產(chǎn)工藝���、添加劑�����、質(zhì)量控制等�����。關(guān)注微生物限度或無菌���、防腐劑用量合理性及抑菌效力���、含細(xì)粉軟膏劑的粒度。
3.3中藥飲片
重點關(guān)注藥材的基原�����、產(chǎn)地���、采收加工�����、炮制工藝�����;關(guān)注藥材的品質(zhì)���;關(guān)注輻照滅菌對飲片質(zhì)量(包括:性狀�����、藥效�����、輻射殘留等)的影響���;考察是否存在使用假劣藥材�����、染色藥材�����、硫磺熏蒸藥材���、增重藥材及使用非藥用部位生產(chǎn)飲片的情況���;直接口服的中藥飲片還應(yīng)該關(guān)注微生物限度項�。
3.3.1植物類中藥飲片
3.3.1.1來源�����?����?疾焖幉牡谋静菘甲C情況���,重點關(guān)注藥材的基原�、歷史沿用以及不同地方炮制規(guī)范習(xí)用等情況���;考察是否混有非藥用部位�����、摻雜使假等現(xiàn)象�����,建議采用專屬性強的理化方法或基因檢測等方法進(jìn)行確認(rèn)���;如遇同名異物或同物異名情況應(yīng)加以充分說明�。
3.3.1.2種植采收加工與炮制���。重點關(guān)注是否存在中藥材種植不規(guī)范�����、種植年限不夠���、不適宜產(chǎn)區(qū)種植、濫用農(nóng)藥�����、搶青采收等現(xiàn)象�;關(guān)注不同種植方式及采收加工方法是否符合藥典規(guī)定���,不同產(chǎn)地�、生長年限、采收季節(jié)���、采收時間�、采收加工方法是否會對藥材的品質(zhì)造成影響以及影響規(guī)律�����;炮制過程重點關(guān)注炮制工藝是否合理���,比較現(xiàn)代炮制方法與傳統(tǒng)炮制方法的優(yōu)劣勢�����,比較不同炮制規(guī)范中規(guī)定炮制工藝關(guān)鍵點的異同�����,采用輔料炮制的飲片還應(yīng)該關(guān)注輔料用量和質(zhì)量以及對飲片品質(zhì)的影響���;關(guān)注炮制前后品質(zhì)的變化。
3.3.1.3質(zhì)量控制和評價���。重點關(guān)注影響中藥材及飲片品質(zhì)的關(guān)鍵性因素(包括:品種�、產(chǎn)地、生長年限�����、采收季節(jié)�、采收加工方法、炮制�、存儲、使用�、人為的摻雜摻假及檢驗方法不當(dāng)造成的影響);重點關(guān)注質(zhì)控指標(biāo)的選擇�、檢驗參數(shù)與限度設(shè)置的科學(xué)性與合理性,可綜合性狀���、鑒別�����、檢查�����、浸出物�����、含量測定等多個項目進(jìn)行評價���,可嘗試建立指紋圖譜、特征圖譜���、一標(biāo)多測���、浸出物或固形物等方法來綜合評價和控制;關(guān)注炮制對藥材質(zhì)量的影響�。
3.3.1.4安全性。重點關(guān)注農(nóng)藥殘留�、重金屬及有害元素等問題;如有易霉變藥材�,應(yīng)關(guān)注真菌毒素;關(guān)注是否有使用染色藥材���、硫磺熏蒸藥材���、增重藥材生產(chǎn)中藥飲片等現(xiàn)象,并建立合適的方法加以控制�����;關(guān)注植物生長調(diào)節(jié)劑對人體的影響;直接口服的中藥飲片還應(yīng)該關(guān)注微生物限度項�;含毒性成分的藥材應(yīng)關(guān)注毒性成分含量的高低,必要時增加限度檢查�����;此外還應(yīng)關(guān)注存儲不當(dāng)造成的走油�����、蟲蛀�����、風(fēng)化���、潮解和黏連等現(xiàn)象�。
3.3.2動物類中藥飲片
3.3.2.1來源�。重點關(guān)注動物的種源,是否存在混用或代用等問題�����;關(guān)注養(yǎng)殖方法是否存在不規(guī)范養(yǎng)殖等問題���;其余同植物類中藥飲片���。
3.3.2.2采收加工與炮制。重點關(guān)注防腐方法���;關(guān)注動物非藥用部位的去除�;其余同植物類中藥飲片�����。
3.3.2.3質(zhì)量控制�����。關(guān)注灰分�、水分等檢查項;關(guān)注動物類特異性成分的定性定量檢查方法���;其余同植物類中藥飲片�。
3.3.2.4安全性�����。重點關(guān)注真菌毒素、重金屬及有害元素�、農(nóng)藥殘留(殺蟲劑等)、獸藥殘留�����、二氧化硫熏蒸等安全性問題�����;其余同植物類中藥飲片�。
3.3.3礦物類中藥飲片
3.3.3.1來源。重點關(guān)注藥材是否為天然或人工合成�,其余同植物類中藥飲片。
3.3.3.2采收加工與炮制�����。重點關(guān)注炮制工藝(如:煅的時間和溫度)�����;其余同植物類中藥飲片�����。
3.3.3.3質(zhì)量控制。同3.3.1.3�。
3.3.3.4安全性。重點關(guān)注重金屬及有害元素等問題�;對于朱砂、雄黃等藥材�,應(yīng)關(guān)注汞與砷的價態(tài)問題;其余同植物類中藥飲片�����。
3.3.4菌類中藥飲片
3.3.4.1來源���。重點關(guān)注菌種的不純與退化;關(guān)注寄生物的品種或培養(yǎng)基質(zhì)問題�����;其余同植物類中藥飲片���。
3.3.4.2采收加工與炮制���。重點關(guān)注菌類中藥材種植中菌種有害突變或感染病毒;其余同植物類中藥飲片�。
3.3.4.3質(zhì)量控制���。重點關(guān)注菌類藥材特異性成分的定性定量測定;其余同植物類中藥飲片�。
3.3.4.4安全性。重點關(guān)注農(nóng)藥殘留�、重金屬及有害元素、添加劑污染�、微生物污染等問題;其余同植物類中藥飲片�。
3.3.5樹脂、加工品及其他類別
3.3.5.1來源�。重點關(guān)注藥材是否為天然或人工合成;關(guān)注原植物的基原和產(chǎn)地�����;其余同植物類中藥飲片�。
3.3.5.2采收加工與炮制。關(guān)注不同企業(yè)不同產(chǎn)地加工工藝�、生產(chǎn)工藝對藥材質(zhì)量的影響,特別是藥材前處理情況�,加工過程中產(chǎn)生的工藝殘留、雜質(zhì)���;發(fā)酵藥材可關(guān)注加工后酶活性的變化�;關(guān)注儲存溫度對藥材質(zhì)量的影響。
3.3.5.3質(zhì)量控制���。樹脂類藥材關(guān)注不同樹脂的摻假問題���;其余同植物類中藥飲片。
3.3.5.4安全性�����。同3.3.1.4�����。
3.4生物制品
3.4.1生產(chǎn)工藝�����。關(guān)注不同企業(yè)產(chǎn)品生產(chǎn)工藝的差異可能對產(chǎn)品質(zhì)量產(chǎn)生的影響�����;關(guān)注生產(chǎn)工藝是否能有效去除雜蛋白或核酸殘留等雜質(zhì)�;關(guān)注病毒或外源因子殘留風(fēng)險;關(guān)注有效成分是否有聚集現(xiàn)象發(fā)生�����;關(guān)注保存期間的降解模式���。
3.4.2不同企業(yè)產(chǎn)品質(zhì)量的相似性�����。關(guān)注國內(nèi)外�����、不同企業(yè)產(chǎn)品的質(zhì)量差異�����;關(guān)注同企業(yè)產(chǎn)品的批間一致性���。
3.4.3質(zhì)量標(biāo)準(zhǔn)制定的科學(xué)性和合理性。重點關(guān)注生物學(xué)活性���、純度�����、雜質(zhì)等關(guān)鍵質(zhì)量屬性�;關(guān)注可見異物、微細(xì)可見異物及不溶性微粒等的分布及來源���。
3.4.4包材相容性�。關(guān)注包材中元素的遷移情況�,包括重金屬離子、抗氧劑���、有機物等�。
3.4.5其他質(zhì)量擴展研究���。隨著新技術(shù)、新手段�、新發(fā)現(xiàn)的出現(xiàn),對產(chǎn)品進(jìn)行的研究�����。
3.5藥用輔料
重點關(guān)注安全性指標(biāo)���、功能性相關(guān)指標(biāo)�、不同來源產(chǎn)品的質(zhì)量比對、藥用輔料與藥物的相容性和穩(wěn)定性研究�,以及對佐劑的質(zhì)量進(jìn)行研究。
3.5.1安全性指標(biāo)
3.5.1.1有關(guān)物質(zhì)���。同3.1.1.2���。
3.5.1.2元素雜質(zhì)殘留。結(jié)合生產(chǎn)工藝進(jìn)行考察���。
3.5.1.3有機溶劑殘留���。結(jié)合生產(chǎn)工藝進(jìn)行考察。
3.5.1.4其他�����。對于供注射用的藥用輔料�,應(yīng)關(guān)注不溶性微粒、高分子雜質(zhì)�、細(xì)菌內(nèi)毒素、無菌(不進(jìn)行終端滅菌的注射劑)或微生物限度(進(jìn)行終端滅菌的注射劑)等項目���。
3.5.2功能性相關(guān)指標(biāo)
根據(jù)藥用輔料的類別對相應(yīng)的功能性指標(biāo)進(jìn)行考察�����;關(guān)注不同來源�����,不同型號�,不同級別的產(chǎn)品相關(guān)功能性指標(biāo)的差異。
3.5.3不同來源產(chǎn)品的質(zhì)量比對
關(guān)注國內(nèi)外���、不同級別�、不同生產(chǎn)工藝等不同來源產(chǎn)品的質(zhì)量差異�。
3.5.4藥用輔料與藥物的相容性和穩(wěn)定性研究
結(jié)合藥用輔料的質(zhì)量特性、制劑應(yīng)用等方面���,對注射劑中使用的藥用輔料與藥物的相容性和穩(wěn)定性進(jìn)行考察�。
3.6藥包材
研究項目可參照《化學(xué)藥品注射劑與藥用玻璃包裝容器相容性研究技術(shù)指導(dǎo)原則(試行)》《化學(xué)藥品注射劑與塑料包裝材料相容性研究技術(shù)指導(dǎo)原則》《化學(xué)藥品與彈性體密封件相容性研究技術(shù)指導(dǎo)原則(試行)》《化學(xué)藥品注射劑生產(chǎn)所用的塑料組件系統(tǒng)相容性研究技術(shù)指南(試行)》《化學(xué)藥品注射劑包裝系統(tǒng)密封性研究技術(shù)指南(試行)》等���。重點關(guān)注材料及包裝系統(tǒng)的安全性、相容性���、密封性���、功能性以及不同來源產(chǎn)品質(zhì)量對比�。
3.6.1材料安全性���。關(guān)注抗氧劑�、增塑劑���、穩(wěn)定劑等各種化學(xué)助劑的種類�、加入量�、加入的必要性、合理性以及對藥物安全性的影響�;關(guān)注是否存在使用和混用再生料的情況;關(guān)注加工過程中使用印刷物�、黏合劑、添加劑���、殘留單體�����、小分子化合物等有害物質(zhì)殘留情況���。
3.6.2相容性���。關(guān)注化學(xué)助劑(如抗氧劑、增塑劑等)�����、金屬元素以及揮發(fā)性成分�����、降解產(chǎn)物等物質(zhì)與藥物相容性�。關(guān)注印刷物、黏合劑���、添加劑�、殘留單體�、小分子化合物等,及其降解產(chǎn)物向藥物的遷移���;關(guān)注藥物活性成分或功能性輔料被藥包材的吸附���;關(guān)注經(jīng)包裝藥物后藥包材的質(zhì)量變化情況(如:玻璃容器的脫片、膠塞的硅油等)�。
3.6.3功能性。關(guān)注包裝容器在臨床使用過程中帶來的風(fēng)險以及影響�;關(guān)注藥包材生產(chǎn)過程中的關(guān)鍵工藝、步驟以及部件質(zhì)控情況(如:玻璃安瓿的折斷面不平整�����、輸液組合蓋穿刺漏液�、落屑、注射劑瓶的冷凍破裂�、防兒童開啟失效、多室袋虛焊等)���。
3.6.4保護(hù)性���。關(guān)注包裝容器對藥品的保護(hù)性能;關(guān)注藥包材的材質(zhì)選擇�、物理性能以及密封完整性等要求;對密封性能�����、阻隔性能、機械性能���、跌落性能以及避光性能等進(jìn)行考察���。
4、問題發(fā)現(xiàn)與處置
4.1問題報送
4.1.1發(fā)現(xiàn)相關(guān)企業(yè)涉嫌存在摻雜摻假�����、違法違規(guī)生產(chǎn)等行為�,經(jīng)研判認(rèn)為可能存在較為嚴(yán)重風(fēng)險隱患,需要對相關(guān)企業(yè)或單位開展現(xiàn)場核查的問題�,承檢機構(gòu)應(yīng)在明確相關(guān)問題后及時將有關(guān)情況上報組織探索性研究的藥品監(jiān)管部門,上報材料包括但不限于按基本情況�����、發(fā)現(xiàn)的問題���、原因分析���、風(fēng)險研判、監(jiān)管建議以及附件(如新建方法�,至少包括方法正文及起草說明)等。
4.1.2發(fā)現(xiàn)抽檢品種在處方工藝、質(zhì)量控制�、原輔料使用、標(biāo)簽���、說明書等方面的問題,尚未發(fā)現(xiàn)相關(guān)產(chǎn)品在安全性和有效性存在嚴(yán)重不良后果���,經(jīng)研判認(rèn)為通過持有人自查自糾可予控制的一般問題�,承檢機構(gòu)應(yīng)按照組織探索性研究的藥品監(jiān)管部門的工作要求�����,將有關(guān)情況匯總后統(tǒng)一上報�。
4.1.3發(fā)現(xiàn)抽檢品種的藥品標(biāo)準(zhǔn)在項目設(shè)置、檢驗方法���、限度值規(guī)定�,以及不同注冊標(biāo)準(zhǔn)之間存在的差異及其對產(chǎn)品質(zhì)量的影響等問題�,承檢機構(gòu)應(yīng)加強與藥品標(biāo)準(zhǔn)管理部門的溝通,按照國家藥品標(biāo)準(zhǔn)提高工作的起草要求完成標(biāo)準(zhǔn)研究工作�,將明確的標(biāo)準(zhǔn)完善建議上報組織探索性研究的藥品監(jiān)管部門;或者按照藥品標(biāo)準(zhǔn)管理部門的有關(guān)要求�����,直接將相關(guān)材料同時報送藥品標(biāo)準(zhǔn)管理部門。
4.1.4發(fā)現(xiàn)抽檢品種存在摻雜摻假嫌疑并研究新建藥品補充檢驗方法的�����,承檢機構(gòu)應(yīng)按《藥品補充檢驗方法管理工作規(guī)程》(食藥監(jiān)科〔2016〕155號)和《藥品補充檢驗方法研制指南》(食品藥品監(jiān)管總局2018年第7號通告)有關(guān)要求�,按程序報批,同時報告組織探索性研究的藥品監(jiān)管部門�。
4.1.5除上述發(fā)現(xiàn)的問題及建議外,探索性研究如有其他有助于加強藥品監(jiān)管���,促進(jìn)藥品質(zhì)量提升的成果和建議�����,可參照以上規(guī)定進(jìn)行報送���,并在此處闡述問題的基本情況、問題原因�����、監(jiān)管建議等內(nèi)容�����。
4.2問題處置
組織探索性研究的藥品監(jiān)管部門需根據(jù)承檢機構(gòu)發(fā)現(xiàn)并報送的風(fēng)險問題和監(jiān)管建議,組織分析研判并按程序逐一處置�。
對經(jīng)研判認(rèn)為需開展現(xiàn)場檢查的,應(yīng)部署有關(guān)檢查機構(gòu)或直接派出檢查組開展現(xiàn)場檢查�����,根據(jù)檢查結(jié)果依法處置���,必要時應(yīng)視情況開展延伸檢查;對經(jīng)研判認(rèn)為可組織相關(guān)企業(yè)排查整改的���,可將有關(guān)情況通報涉及企業(yè)�,由企業(yè)自行開展排查并整改�;對經(jīng)研判認(rèn)為需要進(jìn)一步調(diào)查核實以明確有關(guān)情況的,可商請相關(guān)職能部門配合核實�;對經(jīng)研判認(rèn)為相關(guān)問題尚不明確或需要提供更多資料、數(shù)據(jù)的�����,應(yīng)組織相關(guān)承檢機構(gòu)進(jìn)一步深入研究���。
對經(jīng)研判認(rèn)為相關(guān)產(chǎn)品可能存在用藥風(fēng)險的�����,應(yīng)立即采取有效風(fēng)險控制措施�����,或組織相關(guān)持有人開展評估�,并監(jiān)督持有人對存在質(zhì)量問題或其他安全隱患的藥品采取主動召回等風(fēng)險控制措施,對應(yīng)當(dāng)召回而未采取召回的�����,要責(zé)令召回���。
如涉及外省相關(guān)企業(yè)的�����,需由組織探索性研究的省級藥品監(jiān)管部門通報涉及相關(guān)企業(yè)所在地省級藥品監(jiān)管部門�����;對發(fā)現(xiàn)抽檢品種可能存在的系統(tǒng)性問題或其他重要問題�����,應(yīng)報告國家藥監(jiān)局藥品監(jiān)管司�。
5、質(zhì)量分析工作要點
根據(jù)組織探索性研究的藥品管理部門的要求���,承檢機構(gòu)可基于調(diào)研�����、檢驗和探索性研究結(jié)果�����,統(tǒng)計分析藥品質(zhì)量與處方、原輔料���、生產(chǎn)工藝�����、包裝材料�、檢驗項目等因素的相關(guān)性(統(tǒng)計學(xué)分析要點見附件1)�����,分析影響藥品質(zhì)量的主要因素與次要因素,對承檢品種的總體質(zhì)量狀況進(jìn)行綜合分析評價�。
承檢機構(gòu)可參考綜合評分方法(見附件2)對各持有人樣品的質(zhì)量進(jìn)行綜合評分,用表列出參加評分的檢驗項目與權(quán)重系數(shù)及企業(yè)評分情況���,如果對本指導(dǎo)原則項目評分計算方法進(jìn)行了修改���,則還應(yīng)說明修改的理由;按評分由高到低順序列出各持有人的綜合評分���。
承檢機構(gòu)可綜合上述工作�����,撰寫承檢品種的質(zhì)量分析報告(見附件3)���,為藥品檢查、檢驗�����、監(jiān)測���、審評審批�、標(biāo)準(zhǔn)提升等日常監(jiān)管工作提供進(jìn)一步的技術(shù)支撐和數(shù)據(jù)積累。
附件1
統(tǒng)計學(xué)分析要點
1檢驗數(shù)據(jù)的統(tǒng)計描述
1.1統(tǒng)計表�。統(tǒng)計表是以表格形式簡明闡述數(shù)據(jù)關(guān)系的一種方式。一張表只表達(dá)一個中心內(nèi)容�����。統(tǒng)計表標(biāo)題表達(dá)的主詞放在表的左側(cè)���,作為橫標(biāo)目�;賓詞放在表的右側(cè)���,作為縱標(biāo)目���;數(shù)字內(nèi)容一般用小數(shù)點對齊�,符號內(nèi)容一般居中,無內(nèi)容時用“-”表示���,數(shù)據(jù)缺失時用“…”表示�����;表格一般不設(shè)縱線�。
1.2統(tǒng)計圖。統(tǒng)計圖是以圖型直觀闡明數(shù)據(jù)關(guān)系的方式���。
統(tǒng)計地圖:統(tǒng)計地圖用于表述統(tǒng)計量在不同地域的分布情況�,數(shù)據(jù)用散點或顏色來表示�����。
餅圖:餅圖是以圓形面積作為100%���,以若干個(兩個以上)扇形表示事物內(nèi)部構(gòu)成所占的比例�����。
條圖:條圖是用相同寬度���、不同長度的直條表示相互獨立的統(tǒng)計量的大小,條圖橫坐標(biāo)一般為定性變量�����,縱標(biāo)為定量變量。
頻數(shù)分布圖(直方圖):頻數(shù)分布圖是以各直方面積描述各組頻數(shù)的分布情況�����。頻數(shù)分布圖直觀簡潔���,是定量資料分析的重要方法���,可以發(fā)現(xiàn)數(shù)據(jù)的分布情況,便于發(fā)現(xiàn)特異數(shù)據(jù)�����,估計正常值�,初步評價限度設(shè)定的合理性等。
散點圖:散點圖表示兩個定量變量之間的大致關(guān)系���,判斷兩變量之間是否存在某種關(guān)聯(lián)或分布模式�。
折線圖:折線圖是用線段表示數(shù)據(jù)值的變化�,用于描述統(tǒng)計量隨另一連續(xù)變量變化的趨勢���,通常是隨時間的變化趨勢。
箱式圖:箱式圖是探索數(shù)據(jù)的重要分析工具,其給出的信息量更豐富�����。箱式圖用于多組數(shù)據(jù)平均水平和變異程度的直觀分析比較�,每組數(shù)據(jù)均可呈現(xiàn)其最小值、最大值�����、中位數(shù)�����、下四分位數(shù)和上四分位數(shù)���,可以反映數(shù)據(jù)的變異程度���,觀察數(shù)據(jù)的分布特征,如:正態(tài)分布�、左偏分布、右偏分布還是其他類型的分布�����。簡單的箱式圖是以下四分位數(shù)和上四分位數(shù)為箱型方框的上下邊�,以最大值�、最小值為線的上下端�,在箱型方框中標(biāo)出中位數(shù)的位置�。
2兩組數(shù)據(jù)均數(shù)比較的t檢驗
兩組數(shù)據(jù)均數(shù)比較的t檢驗方法有:總體方差相等的t檢驗�、總體方差不等的t’檢驗和配對t檢驗。
同一批樣品在兩個不同地方抽檢數(shù)據(jù)的比較���,或者同一批樣品在兩個不同時間的抽檢數(shù)據(jù)的比較�,應(yīng)使用配對t檢驗�。
3多組數(shù)據(jù)均數(shù)比較的方差分析
超過兩組數(shù)據(jù)的均數(shù)比較應(yīng)使用方差分析(F檢驗)。
兩組以上完全隨機設(shè)計數(shù)據(jù)的均數(shù)比較應(yīng)使用完全隨機設(shè)計資料的方差分析�。完全隨機設(shè)計資料的方差分析結(jié)果只能反映出各組數(shù)據(jù)均數(shù)是否有差異,如有差異���,不能說明兩兩之間都有差異。如需進(jìn)一步分析兩兩之間是否有差異���,則應(yīng)進(jìn)行多組樣本均數(shù)間的多重比較分析���。
用完全隨機設(shè)計資料的方差分析結(jié)果顯示多組數(shù)據(jù)均數(shù)有差異時,用LSD-t檢驗和SNK-q檢驗進(jìn)行兩兩之間的比較�����。
4聚類分析
聚類分析是將隨機數(shù)據(jù)歸類的統(tǒng)計學(xué)分析方法���。適用于對數(shù)據(jù)規(guī)律尚不清楚�,不知道應(yīng)分為幾類的數(shù)據(jù)分類分析�。聚類分析的方法較多,應(yīng)根據(jù)專業(yè)知識選擇合適的聚類分析方法�����。
聚類分析常用于數(shù)據(jù)的探索性分析�,其結(jié)果應(yīng)密切結(jié)合專業(yè)知識,一般可嘗試多種聚類方法分類�,以得出較為科學(xué)的結(jié)論。
聚類分析的步驟一般有:①選擇一種聚類方法進(jìn)行計算���;②對計算的結(jié)果用專業(yè)知識進(jìn)行解釋�����;③如果分類結(jié)果無法以專業(yè)知識解釋�����,嘗試另一種聚類分析方法�����,直至分類結(jié)果符合專業(yè)知識的解釋(如:中藥材或中成藥中某種成分定量測定的數(shù)據(jù)�����,由于中藥成分的變化差異較大�����,可以用聚類分析將測定的數(shù)據(jù)進(jìn)行分類)�����。
5相關(guān)分析
相關(guān)分析是研究變量與變量之間關(guān)系的統(tǒng)計方法�����,包括二元線性相關(guān)分析�����、多元相關(guān)分析和典型相關(guān)分析。
二元相關(guān)分析是研究一個變量與另一個變量相關(guān)性的統(tǒng)計方法�����。藥品檢驗中�,樣品溶液的顏色與有關(guān)物質(zhì)是否相關(guān)���,有關(guān)物質(zhì)是否是與貯存時間相關(guān)等分析應(yīng)使用二元相關(guān)分析�����。
多元相關(guān)分析是研究一個變量與多個自變量相關(guān)性的統(tǒng)計方法���。上例中,有時樣品溶液的顏色可能與原料的質(zhì)量�����、晶型���、有關(guān)物質(zhì)�、貯存時間、貯存的溫度與濕度等因素存在關(guān)系�����,這時應(yīng)使用多元相關(guān)分析���。多元相關(guān)分析要求應(yīng)變量是連續(xù)變量���,自變量可以是連續(xù)變量也可以是分類變量或有序變量。
典型相關(guān)分析是研究兩組變量之間相互關(guān)系的統(tǒng)計方法�����。例如�,上例中,有時樣品溶液的顏色�、澄清度等可能與原料的質(zhì)量、晶型�、有關(guān)物質(zhì)、貯存時間���、貯存的溫度與濕度等因素存在關(guān)系�,這時應(yīng)使用典型相關(guān)分析進(jìn)行數(shù)據(jù)分析�����。
相關(guān)分析步驟一般有:①將需分析的參量輸入統(tǒng)計軟件進(jìn)行分析計算;②對計算的結(jié)果中不相關(guān)的參量剔除�,剩余參量重新輸入統(tǒng)計軟件進(jìn)行分析計算;重復(fù)此步驟���,直至剩余參量均相關(guān)���。
附件2
綜合評分方法
綜合評價是依據(jù)多個指標(biāo)�����、多個因素對藥品質(zhì)量評價對象作出評價�,并排出優(yōu)劣順序的統(tǒng)計學(xué)方法。綜合評價的方法較多�����,藥品抽檢采用的綜合評分法是基于檢驗結(jié)果的評分方法�����,其一般步驟如下:
(1)成立綜合評分小組�,小組成員不少于3名���。
(2)專家小組根據(jù)法定質(zhì)量標(biāo)準(zhǔn)、補充標(biāo)準(zhǔn)�、探索性研究中擬作為修訂或增訂并報國家藥典委員會審批的檢驗標(biāo)準(zhǔn),或擬作為上報藥品監(jiān)督管理部門審批的補充檢驗標(biāo)準(zhǔn)�,選擇反映藥品質(zhì)量的主要檢驗項目作評價指標(biāo)。
藥品評價抽檢中�,選擇可量化的、能區(qū)分不同企業(yè)產(chǎn)品質(zhì)量差異的主要項目作為評價指標(biāo)�����,評價項目應(yīng)包括檢出的不符合規(guī)定項目�����?��?诜腆w制劑可選擇的項目如:溶出度�����、有關(guān)物質(zhì)�����、含量測定等���。注射劑可選擇的項目如:澄清度與顏色�����、有關(guān)物質(zhì)�、水分�����、干燥失重�����、含量測定等�。對于所有樣品檢驗結(jié)果全部符合規(guī)定的符合性檢查項目�����,如鑒別�、熱原、無菌等可不選擇,但一旦這些項目有不符合規(guī)定時���,應(yīng)選擇并進(jìn)行量化處理���。評價指標(biāo)一般選擇3~5項即可。
(3)專家小組研究確定評價指標(biāo)的權(quán)重系數(shù)�,權(quán)重系數(shù)一般在0.6~1之間。對藥品質(zhì)量影響大的項目權(quán)重系數(shù)大些�,對藥品質(zhì)量影響小的項目權(quán)重系數(shù)小些。選擇的評價指標(biāo)中�,對藥品質(zhì)量影響最大項目的權(quán)重系數(shù)設(shè)為1,對藥品質(zhì)量影響最小項目的權(quán)重系數(shù)設(shè)為0.6���,其他項目的權(quán)重系數(shù)在0.6~1之間���。
(4)藥品抽檢所選擇評價項目的滿分為100分,得分越高說明質(zhì)量越好�����。符合規(guī)定項目的最低分為60分�����,最高分為100分,不符合規(guī)定為0分�����。各檢驗項目評分可參考如下方法計算�����。
(5)先按法定標(biāo)準(zhǔn)計算綜合評分���,再按法定標(biāo)準(zhǔn)加探索性研究計算綜合評分���。
①定量檢驗項目
定量檢驗項目采用離差法計算評分值。首先確定量值的限度范圍�、限度均值,然后根據(jù)檢驗值與限度均值的差確定檢驗項目的評分�����,如含量測定���、有關(guān)物質(zhì)檢查、溶劑殘留等項目�����。
有上限與下限規(guī)定范圍的檢驗項目
假設(shè)該項目規(guī)定范圍為a~b,a為下限���,b為上限���,測得值為C,其評分按下式計算:
只有上限規(guī)定的檢驗項目
假設(shè)該項目規(guī)定上限為b�,默認(rèn)低限一般為0,測得值為C�����,其評分按下式計算:
只有下限規(guī)定的檢驗項目
假設(shè)該項目規(guī)定下限為a�,測得值為C,其評分按下式計算:
②半定量檢驗項目
對于半定量檢驗項目�,應(yīng)當(dāng)根據(jù)專業(yè)知識將檢驗項目結(jié)果分成不同等級,依據(jù)不同等級用專家評分法確定評分�����。如重金屬檢查�����、澄清度檢查、溶液的顏色等項目�。
假設(shè)該項目可以分為L個等級,從0開始���,每增加一個等級加1�,例如�����,某項分5個等級���,分別表示為0�、1���、2�、3和4�。等級越小質(zhì)量越好,測得值為第C個等級�,其評分按下式計算:
③定性項目
定性項目通常只有兩種結(jié)果,如符合規(guī)定與不符合規(guī)定�����、呈正反應(yīng)與不呈正反應(yīng)等�,如無菌、降壓物質(zhì)�����、過敏反應(yīng)檢查等���。這類檢驗項目用專家評分法確定評分�����,按下式計算:
④含量均勻度
中國藥典含量均勻度分為初試與復(fù)試�����,進(jìn)入復(fù)試的說明產(chǎn)品的均一性可疑���,應(yīng)當(dāng)與初試區(qū)分對待。計算AV值: 
判定限度�����,L=15�、20�����、25�����。
初試符合規(guī)定的���,其評分按下式計算:
復(fù)試符合規(guī)定的,其評分按下式計算:
⑤重(裝)量差異
RSDMax為所有符合規(guī)定批重(裝)量差異RSD的最大值�。
⑥溶出度或釋放度
RSDMax為所有符合規(guī)定批溶出度或釋放度RSD的最大值。
(6)計算每個批號樣品綜合評分:
式中:Mj為批的分值�,wi為項目的權(quán)重系數(shù),Mi為項目的分值�����。
(7)以各企業(yè)的樣品評分值的平均值或中位值進(jìn)行評價���,并考慮各企業(yè)抽檢總批次對評分值的影響�。
(8)根據(jù)綜合評價結(jié)果�����,結(jié)合專業(yè)知識,調(diào)整�����、修改選擇評價指標(biāo)與權(quán)重系數(shù)�����,逐步實現(xiàn)科學(xué)評價���。
復(fù)方口服固體制劑有N個溶出度(或含量測定)檢查時,應(yīng)當(dāng)視為N個檢驗項目�,應(yīng)有各自的權(quán)重系數(shù);有些檢驗項目有多個指標(biāo)�����,如有關(guān)物質(zhì)項有單雜�、特定雜質(zhì)和總雜的規(guī)定時,假設(shè)有關(guān)物質(zhì)重權(quán)系數(shù)為0.9�,可將有關(guān)物質(zhì)拆分為N個檢驗項目,但此N個檢驗項目的權(quán)重系數(shù)之和為0.9�����,仍相當(dāng)于一個檢驗項目;釋放度檢查多個取樣點可類似處理�。
附件3
質(zhì)量分析報告撰寫指南
××××年××藥品抽檢
××××(品種名稱)質(zhì)量分析報告
××××××(承檢機構(gòu)全稱)
××××年××月
目錄
(目錄字體)
摘要
正文……
一、基本信息
(一)基本情況
基本情況應(yīng)包括本品的歷史沿革(盡可能包含國內(nèi)首研企業(yè)的詳細(xì)情況�,首次申報企業(yè)獲批情況,委托生產(chǎn)企業(yè)品種的標(biāo)準(zhǔn)變更情況等)���、劑型(藥用輔料為級別���、藥包材為型號)、規(guī)格�����、包裝���、適應(yīng)癥或功能與主治(藥用輔料為應(yīng)用或用途���、藥包材為功效或用途)及不良反應(yīng)(藥用輔料和藥包材為安全性信息或注意事項);部分特性描述(如:生物學(xué)特性�����、藥劑學(xué)特性、理化特性)�。
正文……
(二)原料藥合成工藝
本部分應(yīng)簡要敘述原料藥的批準(zhǔn)文號數(shù)量、在產(chǎn)企業(yè)數(shù)以及本次抽樣涉及的原料藥生產(chǎn)企業(yè)情況�����,原料藥主要合成工藝���、藥包材原材料的制造工藝情況,以及中藥材炮制工藝(如有)�、來源、采收季節(jié)和產(chǎn)地加工等信息�����;并分析原料藥與制劑的對應(yīng)關(guān)系���。
正文……
(三)國內(nèi)外標(biāo)準(zhǔn)情況與對比分析
本部分需用表的形式逐項列出本品國內(nèi)現(xiàn)行標(biāo)準(zhǔn)與國外標(biāo)準(zhǔn)的檢驗項目�����、簡要的檢驗方法和限度(如有)�����、分析現(xiàn)行藥品標(biāo)準(zhǔn)的優(yōu)劣�。
正文……
二、調(diào)研
(一)調(diào)研方案
調(diào)研方案應(yīng)包括調(diào)研目的�、調(diào)研方式、時間安排和調(diào)研問卷等內(nèi)容�,問卷的內(nèi)容應(yīng)根據(jù)藥品特點設(shè)計。
正文……
(二)調(diào)研結(jié)果
調(diào)研結(jié)果應(yīng)簡要敘述調(diào)研問卷的反饋情況及其他調(diào)研獲取的信息�����,對反饋信息采用適宜的方法進(jìn)行統(tǒng)計和分析�,并在附件列出。
正文……
三�����、樣品信息
(一)批準(zhǔn)文號情況
本部分應(yīng)說明抽檢品種的持有人數(shù)量�、批準(zhǔn)文號的數(shù)量(如有進(jìn)口批準(zhǔn)文號單獨列出)、藥包材的備案登記號數(shù)量及關(guān)聯(lián)信息�����,并按不同劑型逐項分析���。
正文……
(二)樣品的劑型�、規(guī)格與包裝情況
本部分應(yīng)說明抽檢品種的劑型(藥用輔料為級別、藥包材為型號)�、規(guī)格及各自的批數(shù)與比例,并分別說明不同企業(yè)的包裝材料與包裝情況�����。
正文……
(三)樣品批數(shù)
本部分應(yīng)說明抽檢的樣品總批次�����、涉及的批準(zhǔn)文號(備案登記號)數(shù)及其比例�����、涉及的持有人數(shù)及其比例�、抽樣的批次與比例���、未覆蓋的持有人數(shù)及其比例(持有人數(shù)量小于20時在正文用表列出�����,大于20時在附件中列出)���、從經(jīng)營企業(yè)及醫(yī)療機構(gòu)抽取樣品的數(shù)與比例�。對納入國家集中采購品種的���,應(yīng)說明國家集中采購品種中選企業(yè)的抽樣批次數(shù)�、持有人數(shù)���、批準(zhǔn)文號數(shù)等情況�。
正文……
(四)樣品分布
本部分需用統(tǒng)計地圖或統(tǒng)計表列出樣品抽樣批次與地區(qū)比例分布情況���;用圖形或統(tǒng)計表列出樣品在生產(chǎn)���、經(jīng)營(藥用輔料為使用企業(yè))、使用單位抽檢的批次與比例分布情況�。
正文……
四、處方與生產(chǎn)工藝
本部分需說明通過調(diào)研等方式獲得的處方(藥包材為配方)和生產(chǎn)工藝情況�,不同持有人處方(配方)與工藝的差別(藥用輔料、藥包材為不同來源產(chǎn)品質(zhì)量對比)���。以1000個制劑單位(中成藥可以制法的制劑單位)列出處方主藥與輔料���,用流程圖簡要表述生產(chǎn)工藝流程。
正文……
五�����、依據(jù)標(biāo)準(zhǔn)檢驗結(jié)果與分析
(一)總檢驗結(jié)果
本部分需詳細(xì)說明檢驗樣品數(shù)、符合規(guī)定數(shù)與百分率���、不符合規(guī)定數(shù)與百分率�����。不符合規(guī)定樣品信息應(yīng)以統(tǒng)計表列出�,包括但不限于標(biāo)示上市許可持有人�、標(biāo)示生產(chǎn)企業(yè)、批號�����、批準(zhǔn)文號(或備案登記號)�����、制劑規(guī)格�����、抽樣環(huán)節(jié)���、檢品來源(被抽樣單位)、檢驗依據(jù)���、不符合規(guī)定項目���。
正文……
(二)分項檢驗結(jié)果與分析
本部分需按現(xiàn)行標(biāo)準(zhǔn)的檢驗項目,逐項敘述該項檢驗結(jié)果與項目合格率(如:性狀�����、鑒別等)���,并簡要列出檢驗方法與限度�,樣品與對照品的典型圖譜或照片�,該項目合格率。
對不符合規(guī)定的�,應(yīng)列出詳細(xì)數(shù)據(jù),包括圖譜與照片�,并分析可能造成不符合規(guī)定的主要因素與次要因素及解決辦法。
對定量數(shù)據(jù)檢驗項目(如:pH值�����、水分、含量等)���,需使用頻數(shù)分布圖列出檢驗結(jié)果�,分析檢驗結(jié)果的分布與該項目檢驗方法和限度的科學(xué)性與合理性�;對于樣品批數(shù)大于等于6的持有人,用箱式圖列出涉及持有人的檢驗結(jié)果�,分析質(zhì)量差異。
詳細(xì)的檢驗數(shù)據(jù)�����,需用表的形式在附件中列出�,表的縱標(biāo)目為:持有人�����、批號�、執(zhí)行標(biāo)準(zhǔn)�����、檢驗項目(如有多個檢驗項目按標(biāo)準(zhǔn)順序列出)、檢驗結(jié)論���;有關(guān)物質(zhì)應(yīng)列出單雜和總雜���,溶出度應(yīng)列出6個或12個數(shù)據(jù),含量均勻度應(yīng)列出平均值�����、標(biāo)準(zhǔn)差和A+kS值�����。
對藥包材物理性能或功效性能�����,需按標(biāo)準(zhǔn)的計數(shù)抽樣要求應(yīng)列出每個樣品的檢測數(shù)據(jù)(超過10個抽樣數(shù)量的可以列出結(jié)果數(shù)據(jù)范圍)或平均值。
正文……
六�����、探索性研究及其檢驗結(jié)果分析
(一)開展探索性研究項目及其目的
敘述開展探索性研究的項目���,研究目的,采用的主要方法及標(biāo)準(zhǔn)(方法或標(biāo)準(zhǔn)應(yīng)標(biāo)明來源�����,如自行開發(fā)的方法或引用其他藥典或產(chǎn)品注冊標(biāo)準(zhǔn)等)�����。
正文……
(二)探索性研究及其檢驗結(jié)果分析
本部分需逐項敘述探索性研究項目詳細(xì)研究方法���,樣品與對照品的典型圖譜或照片���,研究結(jié)果與結(jié)論���;方法學(xué)需按《中華人民共和國藥典》附錄分析方法驗證指導(dǎo)原則驗證,詳細(xì)方法學(xué)驗證內(nèi)容在附件中列出�����。
如果該項目擬作為修訂或增訂檢驗標(biāo)準(zhǔn)�����,或擬作為補充檢驗標(biāo)準(zhǔn)���,則應(yīng)說明修訂或增訂檢驗項目的依據(jù),限度修訂或設(shè)定的依據(jù)�,對選取每個廠家每個規(guī)格各3批以上樣品進(jìn)行檢驗的結(jié)果按“依據(jù)標(biāo)準(zhǔn)檢驗結(jié)果與分析”進(jìn)行統(tǒng)計與分析。
擬修訂或增訂標(biāo)準(zhǔn)資料按藥品標(biāo)準(zhǔn)提高有關(guān)要求或藥品標(biāo)準(zhǔn)管理部門工作要求整理�,擬補充檢驗標(biāo)準(zhǔn)資料按藥品補充檢驗方法申報有關(guān)要求整理。相關(guān)上述資料應(yīng)在附件中列出�。
正文……
(三)探索性研究總檢驗結(jié)果
依照探索性研究方法涉及的相關(guān)項目(包含擬修訂�����、增訂或擬補充標(biāo)準(zhǔn)檢驗項目,以及某些探索性研究項目結(jié)果有不符合規(guī)定情況�,但經(jīng)評估認(rèn)為不需納入標(biāo)準(zhǔn)的檢驗項目等)�,計算總合格率。
正文……
(四)影響本品質(zhì)量主要因素分析
通過調(diào)研�、標(biāo)準(zhǔn)檢驗、探索性研究���,統(tǒng)計分析藥品質(zhì)量與處方���、原輔料���、生產(chǎn)工藝���、包裝材料、檢驗項目等因素的相關(guān)性�,分析影響藥品質(zhì)量的主要因素與次要因素。
正文……
七���、綜合評分
按附1對各持有人樣品質(zhì)量進(jìn)行綜合評分,用表列出參加評分的檢驗項目與權(quán)重系數(shù)及企業(yè)評分情況�����,如果對本指導(dǎo)原則項目評分計算方法進(jìn)行了修改�����,則還應(yīng)說明修改的理由�����;按評分由高到低順序列出各持有人的綜合評分�����。
由于藥包材的物理性能或使用性能指標(biāo)�����,與藥品檢驗項目不同���,其權(quán)重系數(shù)���、評定標(biāo)準(zhǔn)及判定規(guī)則參考打分細(xì)則。
正文……
八�����、發(fā)現(xiàn)的主要問題與建議
(一)涉嫌存在摻雜摻假���、違法違規(guī)生產(chǎn)等行為�����,經(jīng)研判認(rèn)為可能存在較為嚴(yán)重風(fēng)險隱患�����,需要對相關(guān)企業(yè)或單位開展現(xiàn)場核查的問題�。
本部分主要包括探索性研究發(fā)現(xiàn)的涉嫌摻雜摻假、非法添加�、不投料、低限投料、替代投料、染色�、清場不凈、物料間交叉污染���、擅自改變生產(chǎn)工藝���、原輔料質(zhì)量控制不嚴(yán)等違法違規(guī)需對相關(guān)企業(yè)或單位開展現(xiàn)場核查的風(fēng)險。行文要求及研究結(jié)果描述可參照《關(guān)于填報國家藥品抽檢發(fā)現(xiàn)的藥品質(zhì)量風(fēng)險信息的函》(監(jiān)督函〔2021〕58號)的要求執(zhí)行�����。
正文……
(二)發(fā)現(xiàn)抽檢品種在處方工藝、質(zhì)量控制���、原輔料使用���、標(biāo)簽、說明書等方面的問題���。
本部分主要包括探索性研究中發(fā)現(xiàn)的尚不影響藥物安全性和有效性的風(fēng)險�����,包括工藝的優(yōu)化�、生產(chǎn)過程管理的加強等,旨在幫助企業(yè)不斷提升藥品質(zhì)量管理水平�,主動落實藥品質(zhì)量安全的主體責(zé)任。行文要求及研究結(jié)果描述可參照《關(guān)于填報國家藥品抽檢發(fā)現(xiàn)的藥品質(zhì)量風(fēng)險信息的函》(監(jiān)督函〔2021〕58號)的要求執(zhí)行�����。
正文……
(三)藥品標(biāo)準(zhǔn)在項目設(shè)置�����、檢驗方法、限度值規(guī)定�����,以及不同注冊標(biāo)準(zhǔn)之間存在的差異及其對產(chǎn)品質(zhì)量的影響等問題�����。
本部分主要包括在探索性研究中�,對現(xiàn)行藥品標(biāo)準(zhǔn)提出的改進(jìn)方法或完善建議���。行文要求及研究結(jié)果描述可參照《關(guān)于填報國家藥品抽檢發(fā)現(xiàn)的藥品質(zhì)量風(fēng)險信息的函》(監(jiān)督函〔2021〕58號)的要求執(zhí)行�。
正文……
九�、總體評價
在本部分�,承檢機構(gòu)可按檢驗結(jié)果���、探索性研究檢驗結(jié)果���、綜合評分等對承檢品種的質(zhì)量狀況作出總體評價�����,給出“好���、較好、一般�����、差”的結(jié)論�����。
正文……
十�����、附件