1��、背景
生物類似藥��,是指在質(zhì)量��、安全性和有效性方面與已獲準(zhǔn)上市的參照藥具有相似性的治療性生物制品[1]��。其中的相似性��,是指候選藥與已獲準(zhǔn)注冊的參照藥整體相似��,且在質(zhì)量��、安全性及有效性方面不存在有臨床意義的差別[2]��。這部分的定義��,在中美法規(guī)指南中基本一致��。是否存在臨床意義的差別��,是相似性評(píng)價(jià)的考察點(diǎn)��。
早在2015年��,美國FDA的兩份指導(dǎo)原則[3][4]和中國國家藥監(jiān)局的指導(dǎo)原則[1]提出��,可采用遞進(jìn)式的方式證明候選藥與參照藥的相似性��,并且提示需要在藥學(xué)質(zhì)量相似性研究中考慮各質(zhì)量屬性與臨床的相關(guān)性��,甚至應(yīng)根據(jù)各質(zhì)量特性與臨床效果相關(guān)的程度確定評(píng)判相似性的權(quán)重��,并設(shè)定標(biāo)準(zhǔn)��。
2017年��,美國FDA發(fā)布指導(dǎo)原則草案[5]��,提出應(yīng)采用風(fēng)險(xiǎn)評(píng)估工具,評(píng)估產(chǎn)品質(zhì)量屬性對(duì)臨床的潛在影響��,并將質(zhì)量屬性分為三個(gè)級(jí)別��,臨床相關(guān)性最強(qiáng)風(fēng)險(xiǎn)最高的質(zhì)量屬性為第一級(jí)(Tier 1��,通常是生物學(xué)活性方法),風(fēng)險(xiǎn)更低的為第二級(jí)(Tier 2)��,風(fēng)險(xiǎn)最低的為第三級(jí)(Tier 3)��,并且給出了每個(gè)級(jí)別所推薦使用的統(tǒng)計(jì)學(xué)分析工具,Tier 1使用等效性檢驗(yàn)(Equivalence testing)��,Tier 2使用質(zhì)量范圍(Quality ranges)評(píng)估��,Tier 3可采用直觀對(duì)比(Visual comparisons)的方式��。雖然該指導(dǎo)原則草案在公示不到一年的時(shí)間就被FDA撤回��,不過撤回的原因主要是業(yè)界反饋認(rèn)為��,指南中要求參照藥及生物類似藥的批次數(shù)量��、統(tǒng)計(jì)學(xué)的評(píng)估方法影響了生物類似藥開發(fā)的成本和效率��,而其中提出的基于臨床影響的質(zhì)量屬性分級(jí)思想依然被業(yè)界所廣泛接受��。
2019年��,F(xiàn)DA發(fā)布指導(dǎo)原則草案[6]��,重新提出了對(duì)生物類似藥質(zhì)量相似性數(shù)據(jù)分析的建議��,認(rèn)為對(duì)于高到中等風(fēng)險(xiǎn)的質(zhì)量屬性��,可以使用質(zhì)量范圍的方法進(jìn)行評(píng)估,對(duì)于低風(fēng)險(xiǎn)或無法定量的質(zhì)量屬性采用直觀對(duì)比的方式進(jìn)行��。同時(shí)提到��,不推薦使用容忍區(qū)間作為相似性的接受標(biāo)準(zhǔn)(因?yàn)楂@得有意義的區(qū)間需要較大的樣本量)��,但可以使用其他統(tǒng)計(jì)方法��,如等效性檢驗(yàn)��。
2021年��,中國國家藥監(jiān)局發(fā)布了《生物類似藥相似性評(píng)價(jià)和適應(yīng)癥外推技術(shù)指導(dǎo)原則》��,在之前指導(dǎo)原則的基礎(chǔ)上��,明確了應(yīng)“基于對(duì)參照藥質(zhì)量屬性的認(rèn)知程度及其與臨床風(fēng)險(xiǎn)獲益的相關(guān)性��,采用合適的風(fēng)險(xiǎn)評(píng)估工具對(duì)質(zhì)量屬性進(jìn)行分級(jí)”��,并且��,“質(zhì)量相似性定量評(píng)估引入統(tǒng)計(jì)學(xué)分析方法有助于增強(qiáng)相似性判斷的客觀性”��,推薦使用質(zhì)量范圍(μR-XσR, μR+XσR)和直觀對(duì)比的方式進(jìn)行��,“對(duì)于和產(chǎn)品作用機(jī)制或臨床表現(xiàn)直接相關(guān)的質(zhì)量屬性(如生物學(xué)活性)��,可根據(jù)質(zhì)量風(fēng)險(xiǎn)分級(jí)和相似性評(píng)價(jià)目標(biāo)��,采用其他統(tǒng)計(jì)方法進(jìn)行數(shù)據(jù)分析��,如等效性檢驗(yàn)��。”
時(shí)至今日��,在實(shí)際操作中��,藥學(xué)部分的質(zhì)量相似性評(píng)價(jià)依然有一些矛盾和挑戰(zhàn)��,大家往往會(huì)被諸如參照藥不同原液批次的收集��、代表性樣品的批次數(shù)量��、實(shí)施中的統(tǒng)計(jì)工具��、判斷相似的可接受標(biāo)準(zhǔn)等等問題困擾��。本文即圍繞統(tǒng)計(jì)工具和可接受標(biāo)準(zhǔn)這一點(diǎn)進(jìn)行探討,以加深對(duì)工具的理解��,幫助具體的應(yīng)用��。這些統(tǒng)計(jì)工具不僅應(yīng)用于質(zhì)量相似性評(píng)價(jià)中��,而且能夠廣泛地應(yīng)用在變更可比性研究、技術(shù)轉(zhuǎn)移��、分析方法對(duì)比��、維護(hù)乃至樣品檢測等各個(gè)方面��。
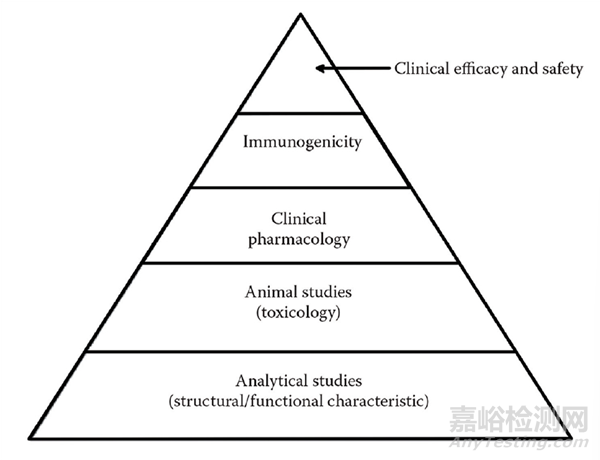
圖 1 Stepwise approach to demonstrating biosimilarity
2、風(fēng)險(xiǎn)評(píng)估和分級(jí)
質(zhì)量相似性評(píng)價(jià)指標(biāo)通常包括蛋白結(jié)構(gòu)和理化特性��、純度和雜質(zhì)��、生物學(xué)活性��、免疫學(xué)特性��、穩(wěn)定性等[2]��。質(zhì)量屬性的風(fēng)險(xiǎn)評(píng)估可以采用多種風(fēng)險(xiǎn)評(píng)估工具進(jìn)行(如RPN風(fēng)險(xiǎn)優(yōu)先順序數(shù)評(píng)估��、RRA風(fēng)險(xiǎn)排序分析法等等),但至少需要包含如下兩個(gè)方面[6]:
對(duì)臨床表現(xiàn)的潛在影響:包括活性��、PK/PD��、安全性��、有效性和免疫原性��,可以通過公開可獲得的信息,或自行對(duì)參照藥進(jìn)行的相關(guān)表征研究獲得信息��。
圍繞某一質(zhì)量屬性的不確定程度:如質(zhì)量屬性與臨床表現(xiàn)之間的相關(guān)性存在不確定性時(shí)��,其質(zhì)量風(fēng)險(xiǎn)應(yīng)評(píng)估為更高的等級(jí)��。
穩(wěn)定性比對(duì)研究(例如穩(wěn)定性或強(qiáng)制降解研究中的降解速率等)可不必進(jìn)行風(fēng)險(xiǎn)分級(jí)��,但應(yīng)體現(xiàn)在質(zhì)量相似性評(píng)價(jià)中��。
3��、Tier 1 (Equivalence testing) 等效性檢驗(yàn)
對(duì)于和產(chǎn)品作用機(jī)制或臨床表現(xiàn)直接相關(guān)的質(zhì)量屬性(如生物學(xué)活性)��,被分類為Tier 1��,推薦使用等效性檢驗(yàn)方法進(jìn)行評(píng)估(也可使用質(zhì)量范圍方式進(jìn)行評(píng)估)。FDA撤回指南[5]的統(tǒng)計(jì)學(xué)評(píng)估方面的原因也主要在等效性檢驗(yàn)方面[7]��。
自2014年起��,F(xiàn)DA就開始通過PINDs和INDs的會(huì)議意見向申辦方推薦等效性檢驗(yàn)的方法[7]��。從技術(shù)角度而言��,等效性檢驗(yàn)是目前用來判斷二者是否等效的首選方法��。我們常用差異性檢驗(yàn)(如t檢驗(yàn))來評(píng)估兩組數(shù)據(jù)的均值差異��,但是當(dāng)兩組數(shù)據(jù)的均值差異沒有統(tǒng)計(jì)顯著性時(shí)(如p值大于0.05)��,我們只能得到兩組數(shù)據(jù)差異不顯著的結(jié)論��,而無法得到兩組數(shù)據(jù)等效的結(jié)論��。等效性檢驗(yàn)?zāi)軌蚝芎玫亟鉀Q這個(gè)問題��。此外��,等效性檢驗(yàn)不僅計(jì)算了差異的大小��,還考慮了差異的意義,從而得到等效與否的結(jié)論��。
簡單地說��,等效性檢驗(yàn)是一種假設(shè)檢驗(yàn)��,它通過假設(shè)參照藥質(zhì)量屬性的均值μR��,與候選藥質(zhì)量屬性的均值μT��,二者之間的差異μT-μR��,應(yīng)在一個(gè)能夠被接受的范圍內(nèi)(或者說在一個(gè)被認(rèn)為是沒有臨床影響的范圍內(nèi))��,即等效界值δ��,其假設(shè)為:
● H0: μT-μR ≤ -δ or μT-μR ≥ δ
● Ha: -δ < μT-μR < δ
該假設(shè)也可以寫成一種等價(jià)形式:
● H01: μT-μR ≤ -δ vs. Ha1: μT-μR > -δ
● H02: μT-μR ≥ δ vs. Ha2: μT-μR < δ
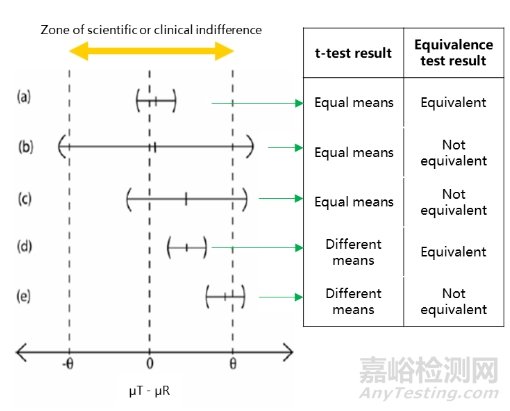
因此,等效性檢驗(yàn)可以通過兩種方式進(jìn)行��,一種是計(jì)算μT-μR差值的90%置信區(qū)間(α=0.05)��,當(dāng)?shù)刃Ы缰低耆眯艆^(qū)間時(shí)��,等效性成立��,另一種是進(jìn)行雙單邊t檢驗(yàn)(TOST)��,在-δ和δ兩側(cè)分別進(jìn)行單邊t檢驗(yàn)(α=0.05)��,當(dāng)兩個(gè)p值均小于0.05時(shí)��,說明等效性成立。兩種方法完全等價(jià)��。
圖2 左:等效性檢驗(yàn)將差值的90%置信區(qū)間與等效界值進(jìn)行對(duì)比��;右:t 檢驗(yàn)與等效性檢驗(yàn)的結(jié)果對(duì)比
大部分統(tǒng)計(jì)分析軟件都具備計(jì)算等效性檢驗(yàn)相關(guān)統(tǒng)計(jì)量的功能��,甚至使用Excel或者手動(dòng)即可進(jìn)行相關(guān)統(tǒng)計(jì)量的計(jì)算��。統(tǒng)計(jì)計(jì)算本身不是很大的問題��,最大的問題通常在于等效界值的設(shè)置(即可接受標(biāo)準(zhǔn)的設(shè)置)和樣本量的確定��。
等效界值的設(shè)置對(duì)等效性檢驗(yàn)來說是最困難且最關(guān)鍵的環(huán)節(jié)。理想情況下��,可以基于科學(xué)知識(shí)或過往經(jīng)驗(yàn)預(yù)設(shè)一個(gè)生物學(xué)意義或臨床意義的等效界值��,但受到藥物研發(fā)階段等的限制,通常無法實(shí)現(xiàn)��。因此��,F(xiàn)DA建議基于參照藥標(biāo)準(zhǔn)偏差σR��,采用f×σR作為等效界值��,在建議批次數(shù)量n ≥ 10的條件下��,為滿足檢驗(yàn)水準(zhǔn)(α=0.05)和檢驗(yàn)效能(power ≥ 85%)��,F(xiàn)DA認(rèn)為f取值為1.5是比較合適的[5]��,即δ = 1.5×σR��。
值得注意的是��,F(xiàn)DA的以上建議��,是基于以下假設(shè)進(jìn)行的:
假設(shè)均值的真實(shí)差異與σR成正比��,即μT-μR與σR成正比��;
σR通過參照藥樣品檢測值的標(biāo)準(zhǔn)偏差獲得(一個(gè)批次有一個(gè)檢測結(jié)果)��;
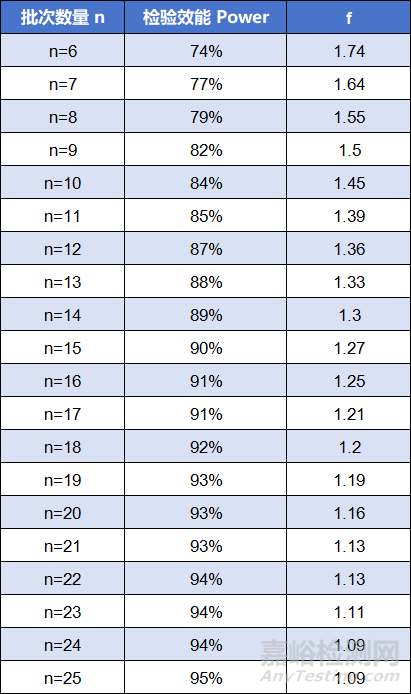
為獲得期望的等效性檢驗(yàn)的檢驗(yàn)效能��,F(xiàn)DA進(jìn)一步建議在μT-μR = 1/8σR的假設(shè)下��,計(jì)算樣本量��。
基于均值的真實(shí)差異為1/8σR和檢驗(yàn)水準(zhǔn)α=0.05的前提下��,批次數(shù)量、檢驗(yàn)效能及f的取值有如下關(guān)系[8]:
然而��,上述假設(shè)引起了業(yè)界和學(xué)術(shù)界的大量討論��,其結(jié)論是值得商榷的��。
在使用該種方法時(shí)��,由于參照藥質(zhì)量屬性的總體標(biāo)準(zhǔn)差σR未知��,需要從已有樣品的檢測中獲得(即用樣品標(biāo)準(zhǔn)差s替代總體標(biāo)準(zhǔn)差σ)��,而參照藥的產(chǎn)品批次來源在本質(zhì)上是未知的��,參照藥批次間的相關(guān)性(如不同參照藥批次可能來自同一原液批次)直接影響了相似性評(píng)價(jià)的設(shè)計(jì)和評(píng)估[7]��。也有研究指出[9][10]��,在進(jìn)行等效性檢驗(yàn)時(shí)��,通過計(jì)算樣品標(biāo)準(zhǔn)差s作為總體標(biāo)準(zhǔn)差σR��,并在假設(shè)檢驗(yàn)中視之為常數(shù)��,以此在正態(tài)分布假設(shè)中進(jìn)行統(tǒng)計(jì)量的計(jì)算,會(huì)導(dǎo)致第一類錯(cuò)誤(Type I error��,即等效性檢驗(yàn)中結(jié)果符合可接受標(biāo)準(zhǔn)��,但實(shí)際上不符合)的概率膨脹��,并使檢驗(yàn)效能(power)下降[11]��。
為了降低這種不良影響,一種替代的方式是將σR作為參數(shù)��,然后使用Wald檢驗(yàn)��,將Wald統(tǒng)計(jì)量應(yīng)用于等效性檢驗(yàn)的假設(shè)中[5][11]。在這種方法下��,為滿足檢驗(yàn)效能大于85%��,在產(chǎn)品批次數(shù)量n=10并假設(shè)產(chǎn)品變異性相等時(shí)��,f的取值應(yīng)從1.5提高至1.7(即 δ = 1.7×σR)��。
另外��,參照藥和候選藥批次數(shù)量的不均等��,也會(huì)提高第一類錯(cuò)誤的概率并影響檢驗(yàn)效能��。對(duì)此��,除了推薦批次數(shù)量不小于10以外��,通常也建議參照藥和候選藥的批次數(shù)量比例在2/3至3/2之間[12]��。當(dāng)批次數(shù)量的不均等非常明顯的時(shí)候��,可采取適當(dāng)?shù)姆椒ㄟM(jìn)行調(diào)整[13]��。在滿足檢驗(yàn)水準(zhǔn)��、檢驗(yàn)效能的前提下��,上述計(jì)算假定σT ≈ σR��,實(shí)際評(píng)估中��,對(duì)于固定的候選藥批次數(shù)量��,當(dāng)參照藥的變異性大于等于候選藥的變異性時(shí)��,參照藥的最小批次數(shù)量可以小于等于候選藥批次數(shù)量��,而當(dāng)候選藥的變異性大于等于參照藥的變異性時(shí)��,參照藥的最小批次數(shù)量則需要大于等于候選藥批次數(shù)量��,在這種情況下��,甚至存在參照藥批次數(shù)量無法滿足2/3至3/2候選藥批次數(shù)量的可能��。
而且��,通常來說��,被歸類為Tier 1的關(guān)鍵質(zhì)量屬性一般會(huì)少于4個(gè)。當(dāng)Tier 1質(zhì)量屬性只有一個(gè)的時(shí)候��,相關(guān)的樣本量和檢驗(yàn)效能計(jì)算可按上述討論進(jìn)行��,而當(dāng)有不止一個(gè)Tier 1質(zhì)量屬性的時(shí)候��,這些質(zhì)量屬性之間通常是具有相關(guān)性的��,那么��,通過多個(gè)等效性檢驗(yàn)的檢驗(yàn)效能計(jì)算會(huì)更為復(fù)雜[13]��。檢驗(yàn)效能的計(jì)算��,同時(shí)也與樣本量的計(jì)算有關(guān),因?yàn)榈刃詸z驗(yàn)的參照藥樣本量 k��,會(huì)受到以下幾個(gè)參數(shù)的影響:1. 檢驗(yàn)的總I類錯(cuò)誤率(α)��;2. II類錯(cuò)誤率(β��,即等效性檢驗(yàn)中結(jié)果不符合可接受標(biāo)準(zhǔn)��,但實(shí)際上符合的概率)或者說檢驗(yàn)效能power(1-β)��;3. 臨床或科學(xué)有意義的差異(μT-μR)��;4. 參照藥的變異性σR(假定σT ≈ σR)��。樣本量k即上述參數(shù)的函數(shù)��,k = f(α, β, μT-μR, σR)[14]��。對(duì)于檢驗(yàn)效能��,通常設(shè)定不低于80%��,當(dāng)進(jìn)行樣本量調(diào)整時(shí)��,建議調(diào)整后的檢驗(yàn)效能也不低于80%��。
基于實(shí)際的相似性評(píng)價(jià)場景��,只要能夠進(jìn)行適當(dāng)?shù)目剂亢驮u(píng)估,等效性檢驗(yàn)的可接受標(biāo)準(zhǔn)設(shè)置仍有探討的空間��。
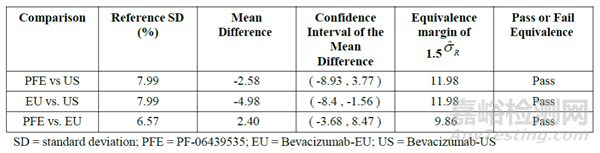
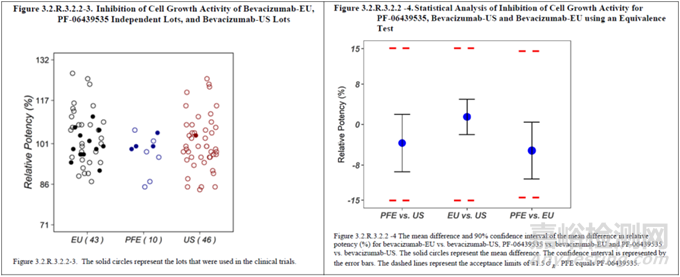
圖 3 等效性檢驗(yàn)示例(統(tǒng)計(jì)量計(jì)算表格��、散點(diǎn)圖及結(jié)果的可視化呈現(xiàn),其中��,PFE為擬申報(bào)的生物類似藥,EU和US分別為不同地區(qū)的參照藥)[15]
4��、Tier 2 (Quality range) 質(zhì)量范圍
對(duì)于風(fēng)險(xiǎn)高至中等的質(zhì)量屬性��,可采用質(zhì)量范圍的方式進(jìn)行評(píng)估��。中美指導(dǎo)原則[2][6]中均有類似描述��,質(zhì)量范圍即(μR-XσR, μR+XσR)��,其中μR為參照藥質(zhì)量屬性的平均值��,σR為其標(biāo)準(zhǔn)偏差��,系數(shù)X的設(shè)定應(yīng)根據(jù)質(zhì)量屬性的風(fēng)險(xiǎn)等級(jí)進(jìn)行科學(xué)論證��。只要有足夠數(shù)量的候選藥批次數(shù)據(jù)(如90%以上)落在質(zhì)量范圍內(nèi)��,即可認(rèn)為該質(zhì)量屬性與參照藥相似(highly similar)。此外��,F(xiàn)DA建議,對(duì)于風(fēng)險(xiǎn)更高的質(zhì)量屬性��,應(yīng)設(shè)置更窄的質(zhì)量范圍進(jìn)行評(píng)估��。
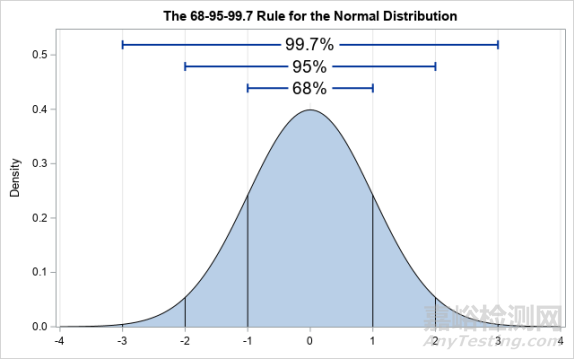
質(zhì)量范圍評(píng)估相似性的統(tǒng)計(jì)邏輯容易理解��,不嚴(yán)謹(jǐn)?shù)卣f��,質(zhì)量范圍即參照藥質(zhì)量屬性的分布范圍��,在正態(tài)分布的假設(shè)下��,當(dāng)X=3時(shí)��,質(zhì)量范圍即參照藥質(zhì)量屬性的均值±3SD的范圍��,即大約是參照藥質(zhì)量屬性的99.7%的數(shù)據(jù)所在的范圍。在假設(shè)μT ≈ μR��,σT ≈ σR的前提下��,如果候選藥的質(zhì)量屬性數(shù)據(jù)也落在同一個(gè)范圍內(nèi)��,說明二者很可能服從同一個(gè)正態(tài)分布��,因此可以說明二者的相似性��。
我們知道��,基于樣本數(shù)據(jù)來推測指定比例的總體所在的統(tǒng)計(jì)概率區(qū)間��,通常使用的是容忍區(qū)間的方法��。這里僅使用正態(tài)分布的范圍進(jìn)行總體數(shù)據(jù)范圍的推測��,而未使用容忍區(qū)間進(jìn)行總體數(shù)據(jù)范圍推測,估計(jì)也與FDA不推薦容忍區(qū)間的原因類似��。當(dāng)數(shù)據(jù)量較少的時(shí)候��,容忍區(qū)間會(huì)得到很寬的接受范圍��,這個(gè)范圍也許并不能產(chǎn)生足夠的意義��,反而增加過高的通過機(jī)會(huì)(注意��,這不代表可比性研究中不能使用容忍區(qū)間��,需要考慮使用條件)��。
對(duì)于X的取值��,在2015年的杜克大學(xué)工業(yè)統(tǒng)計(jì)研討會(huì)上��,一位FDA的發(fā)言者指出��,X應(yīng)選擇2~3之間的數(shù)值[13]��。在正態(tài)分布的假設(shè)下��,即代表有95%(當(dāng)X=2)至99.7%(當(dāng)X=3)的均值數(shù)據(jù)落在范圍內(nèi)��。
圖4 正態(tài)分布示例
當(dāng)然��,上述的檢驗(yàn)并不完全嚴(yán)謹(jǐn)��。首先,我們只能使用有限批次的參照藥質(zhì)量屬性檢測結(jié)果的均值(x-bar)和標(biāo)準(zhǔn)差(s)來代表總體的均值(μ)和標(biāo)準(zhǔn)差(σ)��,雖然樣品標(biāo)準(zhǔn)差(s)是總體標(biāo)準(zhǔn)差(σ)的無偏估計(jì)��,但確實(shí)缺少了對(duì)參照藥相關(guān)變異性的考量��,當(dāng)批次數(shù)量有限的時(shí)候��,這個(gè)問題會(huì)更為明顯��。其次��,雖然指導(dǎo)原則[2][6]中也提及��,需要關(guān)注參照藥與候選藥的平均值和標(biāo)準(zhǔn)偏差的異同��,但在實(shí)際評(píng)估中��,我們通常無法確保μT ≈ μR��,σT ≈ σR(畢竟我們只能獲得 x-bar和s,而非μ和σ)��,只能基于數(shù)據(jù)是否滿足可接受標(biāo)準(zhǔn)這一結(jié)果來判斷相似或不相似��,當(dāng)出現(xiàn)μT = μR��,σT ≠ σR��,或μT ≠ μR��,σT = σR��,或 μT ≠ μR��,σT ≠ σR的情況時(shí)��,其結(jié)果可能會(huì)產(chǎn)生誤導(dǎo)且變得不可靠��。
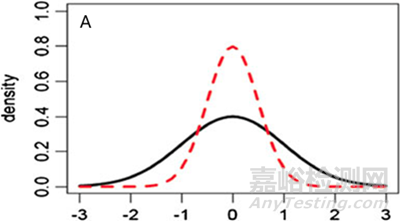
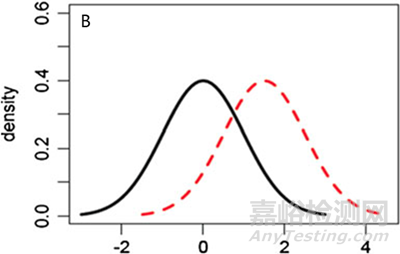
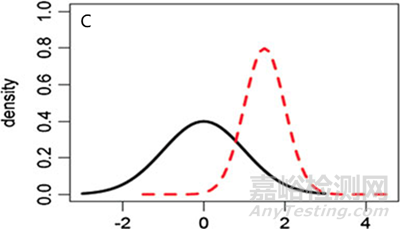
圖5 參照藥和候選藥不同分布情形的圖形化示例 (A) μT = μR��,σT ≠ σR, (B) μT ≠ μR��,σT = σR, (C) μT ≠ μR��,σT ≠ σR.
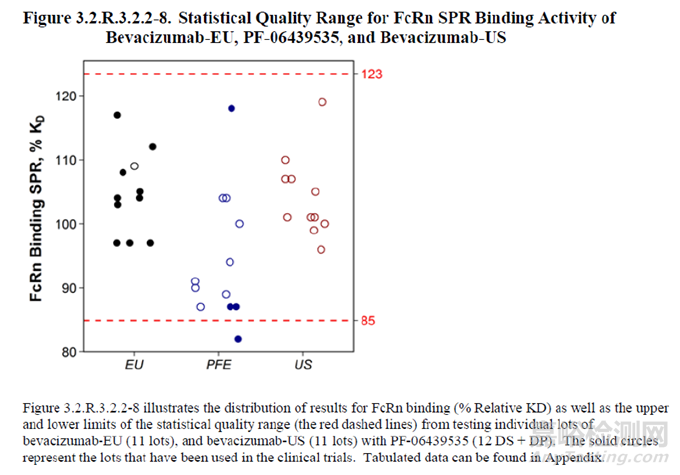
圖6 質(zhì)量范圍示例 (mean±3×SD��,以散點(diǎn)圖形式的可視化呈現(xiàn)��,其中��,PFE為擬申報(bào)的生物類似藥,EU和US分別為不同地區(qū)的參照藥) [15]
5��、Tier 3 (Visual comparisons) 直觀對(duì)比
對(duì)于風(fēng)險(xiǎn)低或者無法定量的質(zhì)量屬性��,可采用直觀對(duì)比的方式進(jìn)行評(píng)估��。部分質(zhì)量屬性,如蛋白序列��、高級(jí)結(jié)構(gòu)等��,也不適用于定量分析��,通常也是用直觀對(duì)比的方式進(jìn)行��。類似的不適用內(nèi)容��,需要進(jìn)行清晰的規(guī)定��,并進(jìn)行合理化說明。
對(duì)Tier 3的質(zhì)量屬性��,可以對(duì)實(shí)際檢測數(shù)據(jù)以恰當(dāng)?shù)姆绞剑ㄈ缟Ⅻc(diǎn)圖)進(jìn)行直觀對(duì)比��。從已公開的各家生物類似藥文章和FDA申報(bào)資料來看��,原始圖譜和散點(diǎn)圖是被最廣泛采用的形式��,不僅是在直觀對(duì)比中��,也在等效性檢驗(yàn)及質(zhì)量范圍的評(píng)估中(這也是FDA指南[6]中推薦的��,對(duì)于Tier 1和Tier 2的質(zhì)量屬性��,也需要進(jìn)行可視化的展示��,以呈現(xiàn)參照藥和候選藥產(chǎn)品的質(zhì)量分布)��。
原始數(shù)據(jù)和圖像化的呈現(xiàn)��,不僅主觀��,而且可能有偏向性��。顯然��,Tier 1的等效性檢驗(yàn)和Tier 2的質(zhì)量范圍評(píng)估都比Tier 3的直觀對(duì)比更為嚴(yán)格。能夠通過Tier 1和Tier 2的檢驗(yàn)��,一定能通過Tier 3的檢驗(yàn)��。而對(duì)于等效性檢驗(yàn)和質(zhì)量范圍評(píng)估而言��,通過Tier 1的檢驗(yàn)并不代表能夠通過Tier 2的檢驗(yàn)��,反之亦然[14]。
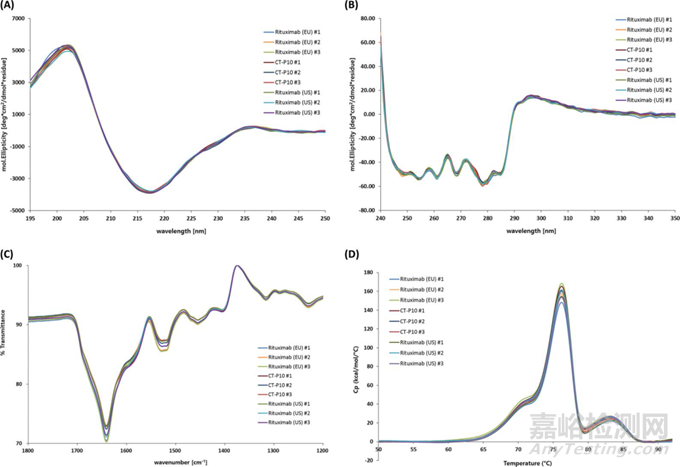
圖7 直觀對(duì)比示例 (通過CD��、FT-IR和DSC進(jìn)行的高級(jí)結(jié)構(gòu)分析) [17]
6��、分析方法
分析方法是質(zhì)量相似性評(píng)價(jià)的基石��,只有可靠的檢測結(jié)果才能支持進(jìn)行可靠的相似性評(píng)價(jià)��。
指導(dǎo)原則[2]鼓勵(lì)采用先進(jìn)的��、敏感的��、正交的技術(shù)和方法對(duì)候選藥和參照藥開展全面的質(zhì)量比對(duì)研究,并盡可能使用不同原理的分析手段檢測潛在的質(zhì)量差異��。并且��,首選采用與參照藥一致的分析方法��,采用其他技術(shù)和方法的��,應(yīng)評(píng)估其優(yōu)勢和局限性��,確保其符合檢測目的和相似性評(píng)價(jià)需求��。用于放行檢測的分析方法應(yīng)進(jìn)行全面的方法學(xué)驗(yàn)證��,用于特性鑒定的分析方法則應(yīng)確保其可適用于分析目的��,分析結(jié)果具有可靠性和重現(xiàn)性��。
此外��,F(xiàn)DA指南[5]中提及��,質(zhì)量屬性的變異包含了批內(nèi)變異和批間變異��,需要關(guān)注��。分析方法的高變異性通常不是設(shè)置更大可接受范圍的合理化說明,而應(yīng)該對(duì)分析方法進(jìn)行優(yōu)化��,或提高每批檢測時(shí)的重復(fù)次數(shù)��,以降低結(jié)果的變異性��。
7��、案例分享
通過查閱FDA官網(wǎng)公開的信息[16]��,近年來(2018至2023年)獲批的生物類似藥,其中的質(zhì)量相似性評(píng)價(jià)統(tǒng)計(jì)分析方法及其可接受標(biāo)準(zhǔn)情況��,從中也能推測FDA在質(zhì)量相似性評(píng)價(jià)中的審評(píng)態(tài)度��,(表格中僅呈現(xiàn)部分公開了相關(guān)信息的藥物資料):
*該項(xiàng)目有的質(zhì)量屬性(ADCC)同時(shí)采用了等效性檢驗(yàn)(1.5σR)和質(zhì)量范圍(X=2)
從資料來看��,各項(xiàng)目均基于風(fēng)險(xiǎn)使用了分級(jí)的策略進(jìn)行質(zhì)量相似性評(píng)價(jià)��。其中��,使用了等效性檢驗(yàn)的項(xiàng)目中,基本均采用了FDA推薦的1.5σR作為等效界值��,當(dāng)然��,作為BLA申報(bào)階段��,參照藥批次數(shù)量通常已經(jīng)不是很大的問題(Zirabev和Vegzelma項(xiàng)目使用了46批參照藥進(jìn)行評(píng)估)��,這也使等效性檢驗(yàn)?zāi)軌虮WC足夠的檢驗(yàn)效能��。也有部分項(xiàng)目未使用等效性檢驗(yàn)方法��,而是采取了質(zhì)量范圍的方法��,根據(jù)質(zhì)量屬性的風(fēng)險(xiǎn)大小��,設(shè)置了不同的可接受標(biāo)準(zhǔn)��。而這類策略進(jìn)行合理化說明后��,都能被FDA所接受��。
結(jié)語
從質(zhì)量相似性評(píng)價(jià)的統(tǒng)計(jì)工具角度出發(fā)��,回顧質(zhì)量相似性評(píng)價(jià)的設(shè)計(jì)��,我們需要關(guān)注如下幾個(gè)方面:
參照藥批次的代表性:其批間變異性直接影響了統(tǒng)計(jì)分析結(jié)果的可靠性��;
參照藥與候選藥的批次數(shù)量:為了滿足統(tǒng)計(jì)分析的檢驗(yàn)效能��,需要一定的批次數(shù)量和比例��;在藥物研發(fā)的早期階段��,因?yàn)榕螖?shù)量不足��,部分統(tǒng)計(jì)分析方法可能不適用��;
質(zhì)量屬性的分級(jí)和可接受標(biāo)準(zhǔn)設(shè)置:質(zhì)量屬性的分級(jí)��,以及可接受標(biāo)準(zhǔn)設(shè)置的合理性需要基于對(duì)數(shù)據(jù)的理解和對(duì)相關(guān)影響的評(píng)估��,統(tǒng)計(jì)分析方法本身的局限性也可能影響到可接受標(biāo)準(zhǔn)的設(shè)置��。
提及統(tǒng)計(jì)分析��,我們總難免會(huì)有一些畏難情緒��,部分公司的CMC團(tuán)隊(duì)擁有專門的統(tǒng)計(jì)團(tuán)隊(duì)��,可以由專業(yè)人士進(jìn)行相關(guān)支持��,但需要注意的是��,在具體問題的解決中��,面對(duì)的許多問題并不是統(tǒng)計(jì)學(xué)家的問題(如活性數(shù)據(jù)的分布、質(zhì)量數(shù)據(jù)的差異和差異背后的意義等)��,而需要業(yè)務(wù)部門專家進(jìn)行判斷��。數(shù)理統(tǒng)計(jì)已由統(tǒng)計(jì)學(xué)家完成��,我們的重點(diǎn)是理解并應(yīng)用這些知識(shí)和工具解決我們的問題��,比如我們這里想要討論的質(zhì)量相似性(多相似是相似,多大的差異我們可以接受)��。
我們可以使用計(jì)算機(jī)程序來做統(tǒng)計(jì)��,但我們也需要理解我們的用途和使用方向,如何正確地使用統(tǒng)計(jì)工具來獲得正確的結(jié)果��,是我們需要結(jié)合應(yīng)用實(shí)際考慮的問題��。統(tǒng)計(jì)工具與我們常接觸的分析檢測方法并無不同��,粗淺地說��,在執(zhí)行分析檢測或者統(tǒng)計(jì)分析時(shí)��,我們都需要先理解分析檢測方法和統(tǒng)計(jì)工具的適用對(duì)象��、操作注意點(diǎn)��,才能獲得正確的結(jié)果��。
統(tǒng)計(jì)分析工具在生物制藥CMC的應(yīng)用日趨廣泛��,不斷更新的藥典��、指南��、文獻(xiàn)中多處提及了不同的統(tǒng)計(jì)分析工具在各個(gè)領(lǐng)域的應(yīng)用��,工藝表征研究(等效性檢驗(yàn)��、容忍區(qū)間)��、工藝變更可比性研究(等效性檢驗(yàn)��、容忍區(qū)間)��、穩(wěn)定性研究(效期預(yù)測)��、分析方法的適用性評(píng)估(等效性檢驗(yàn)��、容忍區(qū)間)��、分析方法變更對(duì)比評(píng)估(等效性��、非劣性檢驗(yàn))��、異常值識(shí)別(Dixon法��、ESD法��、ROUT法等)��、分析方法驗(yàn)證(方差成分分析��、統(tǒng)計(jì)過程控制)等等,因此��,我們應(yīng)當(dāng)熟悉了解這些統(tǒng)計(jì)工具��,并結(jié)合實(shí)際工作進(jìn)行使用��,使其成為我們解決實(shí)際問題的利刃��。
參考文獻(xiàn):
1.《生物類似藥研發(fā)與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》
2.《生物類似藥相似性評(píng)價(jià)和適應(yīng)癥外推技術(shù)指導(dǎo)原則》
3.Guidance for Industry - Quality Considerations in Demonstrating Biosimilarity of a Therapeutic Protein Product to a Reference Product.
4.Guidance for Industry - Scientific Considerations in Demonstrating Biosimilarity to a Reference Product.
5.Guidance for Industry - Statistical Approaches to Evaluate Analytical Similarity (withdrawn).
6.Guidance for Industry - Development of Therapeutic Protein Biosimilars, Comparative Analytical Assessment and Other Quality-Related Considerations.
7.Meiyu Shen, Tianhua Wang & Yi Tsong (2017) Statistical considerationsregarding correlated lots in analytical biosimilar equivalence test, Journal of BiopharmaceuticalStatistics, 27:2, 213-219, DOI: 10.1080/10543406.2016.1265541.
8.Yi Tsong, Xiaoyu Dong & Meiyu Shen (2016): Development of StatisticalMethods for Analytical Similarity Assessment, Journal of Biopharmaceutical Statistics.
9.Dong X, Bian Y, Tsong Y, Wang T (2017) Exact test-based approach for equivalence test with parameter margin. J Biopharm Stat 27: 317-330.
10.Burdick RK, Thomas N, Cheng A (2017) Statistical considerations in demonstrating CMC analytical similarity for a biosimilar product. Statistics in Biopharmaceutical Research 9: 249-257.
11.Yu-Ting Weng, Tsong Y, Shen M, Wang C (2018) Improved Wald Test for Equivalence Assessment of Analytical Biosimilarity. Int J Clin Biostat Biom 4:016. doi.org/10.23937/2469-5831/1510016
12.Wang, Tianhua & Tsong, Yi & Shen, Meiyu. (2019). Sample Size Consideration for Equivalent Test of Tier-1 Quality Attributes for Analytical Biosimilarity Assessment. 10.1007/978-3-319-67386-8_3.
13.Xiaoyu (Cassie) Dong, Yu-Ting Weng & Yi Tsong (2017) Adjustmentfor unbalanced sample size for analytical biosimilar equivalence assessment, Journal ofBiopharmaceutical Statistics, 27:2, 220-232, DOI: 10.1080/10543406.2016.1265544.
14Chow SC, Song F, Bai H. Analytical Similarity Assessment in Biosimilar Studies. AAPS J. 2016 May;18(3):670-7. doi: 10.1208/s12248-016-9882-5. Epub 2016 Feb 12. PMID: 26873509; PMCID: PMC5256601.
15.FDA Application number:761099Orig1s000 Product Quality Reviews
16.https://www.fda.gov/drugs/biosimilars/biosimilar-product-information
17.Kyoung Hoon Lee, Jihun Lee, Jin Soo Bae, Yeon Jung Kim, Hyun Ah Kang, Sung Hwan Kim, So Jung Lee, Ki Jung Lim, Jung Woo Lee, Soon Kwan Jung & Shin Jae Chang (2018) Analytical similarity assessment of rituximab biosimilar CT-P10 to reference medicinal product, mAbs, 10:3, 380-396, DOI: 10.1080/19420862.2018.1433976