摘要:生物等效性試驗(yàn)是評(píng)價(jià)仿制藥與原研藥質(zhì)量和療效一致性的重要方法��,試驗(yàn)方法的科學(xué)性�、評(píng)價(jià)標(biāo)準(zhǔn)的適用性、數(shù)據(jù)資料的規(guī)范性直接影響對(duì)仿制藥質(zhì)量和療效評(píng)價(jià)的準(zhǔn)確性��。對(duì)中國(guó)2020年8月以來(lái)累計(jì)發(fā)布的48個(gè)特定藥物生物等效性研究技術(shù)指導(dǎo)原則(含征求意見(jiàn)稿16個(gè))進(jìn)行逐個(gè)匯總、梳理��,從多個(gè)維度對(duì)已發(fā)布的特定藥物生物等效性研究技術(shù)指導(dǎo)原則的發(fā)布情況進(jìn)行概括��,結(jié)合美國(guó)�、歐盟及日本等國(guó)際先進(jìn)監(jiān)管機(jī)構(gòu)相關(guān)工作經(jīng)驗(yàn),對(duì)中國(guó)特定藥物生物等效性研究技術(shù)指導(dǎo)原則的發(fā)布情況提出一般考慮��,以期提高仿制藥質(zhì)量和療效��,進(jìn)一步滿足臨床需求的同時(shí)減輕患者用藥負(fù)擔(dān)����。
仿制藥一般指原研藥在專利期滿后由非專利廠商生產(chǎn)的具有相同活性成分、規(guī)格��、劑型��、給藥途徑和治療作用����,并經(jīng)證明具有等同的有效性和安全性的藥品�。中國(guó)是仿制藥生產(chǎn)與使用大國(guó),仿制藥的有效和質(zhì)量可控一直是藥品監(jiān)管重點(diǎn)��,為解決現(xiàn)有仿制藥與原研藥間的差距�,化學(xué)仿制藥質(zhì)量與療效一致性評(píng)價(jià)專項(xiàng)工作自2012年首次提出至今,政策體系逐漸完善��、技術(shù)要求不斷規(guī)范��,一致性評(píng)價(jià)專項(xiàng)工作漸入常態(tài)[1-2]����。
生物等效性(BE)是指在相似的試驗(yàn)條件及合理試驗(yàn)設(shè)計(jì)前提下����,給予相同劑量的藥物等效體或替代體,其活性成分或活性基團(tuán)在藥物作用部位的吸收速度和程度不存在顯著差異[3]�。生物等效性研究是目前國(guó)際公認(rèn)判斷仿制藥與原研藥質(zhì)量和療效一致的金標(biāo)準(zhǔn)[4]�,而仿制藥生物等效性研究技術(shù)指導(dǎo)原則以及特定藥物生物等效性技術(shù)指導(dǎo)原則的發(fā)布則顯得尤為重要。與美國(guó)�、歐盟等先進(jìn)監(jiān)管機(jī)構(gòu)相比�,中國(guó)特定藥物生物等效性研究起步較晚,自2020年8月首批特定藥物生物等效性研究指導(dǎo)原則(征求意見(jiàn)稿)[5]發(fā)布以來(lái)����,截至2023年12月31日,累計(jì)發(fā)布48個(gè)特定藥物生物等效性研究技術(shù)指導(dǎo)原則(含征求意見(jiàn)稿16個(gè))����。本文對(duì)已發(fā)布特定藥物生物等效性技術(shù)指導(dǎo)原則逐個(gè)進(jìn)行匯總、梳理��,從多個(gè)維度對(duì)已發(fā)布技術(shù)指導(dǎo)原則的特點(diǎn)進(jìn)行總結(jié)�,結(jié)合美國(guó)食品藥品管理局(FDA)、歐盟藥品管理局(EMA)�、日本藥事及醫(yī)療器材管理局(PMDA)等先進(jìn)監(jiān)管機(jī)構(gòu)特定藥物生物等效性研究指南發(fā)布情況提出一般考慮,以期提高中國(guó)仿制藥質(zhì)量和療效����,進(jìn)一步滿足臨床需求的同時(shí)減輕患者用藥負(fù)擔(dān)。
1��、 美國(guó)����、歐盟及日本生物等效性研究技術(shù)指導(dǎo)原則發(fā)布概述
1.1 美國(guó)FDA
美國(guó)FDA自1980年發(fā)布第1版《具有治療等效性的已批準(zhǔn)藥物》(通常被稱作橙皮書)以來(lái),每年9月發(fā)行����,現(xiàn)行版的橙皮書為第43版[6],其中明確指定了用于仿制藥藥學(xué)和生物等效性研究的參比制劑。FDA自2010年6月開(kāi)始����,陸續(xù)公布和更新《特定藥物的生物等效性指導(dǎo)原則[7],截至2023年11月30日已累計(jì)發(fā)布特定藥物生物等效性指導(dǎo)原則2157個(gè)[8]��?�!短囟ㄋ幬锏纳锏刃灾笇?dǎo)原則》是對(duì)其頒布的《生物利用度的食物效應(yīng)以及餐后生物等效性試驗(yàn)》[9]����、《以藥動(dòng)學(xué)為終點(diǎn)評(píng)價(jià)指標(biāo)的仿制藥生物等效性技術(shù)指導(dǎo)原則》[10]等涉及生物等效性研究指導(dǎo)原則總則的進(jìn)一步解讀�,特別是在生物等效性試驗(yàn)設(shè)計(jì)、受試者����、檢測(cè)物質(zhì)、豁免原則等方面在具體品種上作了具體的補(bǔ)充與明確����。
1.2 EMA
EMA作為歐盟官方藥 品監(jiān)管機(jī)構(gòu)之一��,于2010年頒布《生物等效性研究指導(dǎo)原則》[11]�,對(duì)既往指導(dǎo)原則作了修訂與補(bǔ)充,增加了基于生物藥劑學(xué)分類系統(tǒng)的生物等效性研究豁免的相關(guān)規(guī)定�;2013年6月開(kāi)始�,陸續(xù)公布和更新《特定藥物的生物等效性指導(dǎo)原則》��,截至2023年11月30日已累計(jì)發(fā)布特定藥物生物等效性指導(dǎo)原則77個(gè)[12]��,對(duì)具體藥物從生物等效性試驗(yàn)設(shè)計(jì)����、受試者、生物藥劑學(xué)分類�、檢測(cè)物質(zhì)、豁免原則和生物等效性性評(píng)價(jià)參數(shù)等方面 作了指導(dǎo)說(shuō)明��。
1.3 日本PMDA
PMDA作為日本負(fù)責(zé)藥品和醫(yī)療器械監(jiān)管以及技術(shù)審評(píng)的官方機(jī)構(gòu)��,發(fā)布有關(guān)生物等效性研究相關(guān)指南主要是1997年公布��、2012年以及2020年修訂的《仿制藥生物等效性試驗(yàn)指導(dǎo)原則》[13]�,該指導(dǎo)原則全面闡述了對(duì)仿制藥生物等效性試驗(yàn)的相關(guān)要求;日本從1998年起�,開(kāi)始編著出版《日本醫(yī)療用醫(yī)藥品品質(zhì)情報(bào)集》(橙皮書),2017年4月日本厚生省網(wǎng)站正式推出仿制藥質(zhì)量信息藍(lán)皮書[14]�,累計(jì)收載品種信息78個(gè),對(duì)具體藥品有效成分�、制劑類型、制劑規(guī)格、參比制劑�、溶出試驗(yàn)參數(shù)和溶出曲線、生物等效性試驗(yàn)結(jié)果等做了介紹����。截至2023年12月31日,PMDA尚未發(fā)布特定藥物生物等效性指導(dǎo)原則�。
2、 中國(guó)特定藥物生物等效性研究技術(shù)指導(dǎo)原則特征
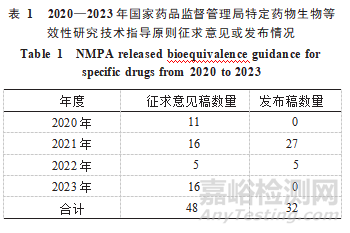
中國(guó)在積累了大量生物等效性研究數(shù)據(jù)的基礎(chǔ)上����,國(guó)家藥品監(jiān)督管理局(NMPA)于2020年8月發(fā)布了首批《特定藥物生物等效性研究指導(dǎo)原則》(征求意見(jiàn)稿)[5]�,截至2023年12月31日,累計(jì)發(fā)布48個(gè)特定藥物生物等效性研究技術(shù)指導(dǎo)原則��,其中已發(fā)布正式稿32個(gè)����,尚在征求意見(jiàn)稿16個(gè)(見(jiàn)表2)。本文著重對(duì)這些特定藥物生物等效性研究技術(shù)指導(dǎo)原則內(nèi)容進(jìn)行梳理��,以正式發(fā)布稿相關(guān)內(nèi)容為準(zhǔn)����。
2.1 適應(yīng)證和制劑劑型
在適應(yīng)證方面,累計(jì)發(fā)布的48個(gè)品種特定藥物生物等效性研究技術(shù)指導(dǎo)原則中,涉及抗腫瘤藥物12個(gè)��、心血管疾病藥物10個(gè)����、精神神經(jīng)疾病藥物6個(gè)、消化系統(tǒng)疾病藥物6個(gè)��、呼吸系統(tǒng)及麻醉藥物各3個(gè)����、其他疾病用藥8個(gè)。其中����,抗腫瘤藥物在全部已發(fā)布特定藥物生物等效性研究技術(shù)指導(dǎo)原則中占比25.0%。
在制劑劑型方面����,累計(jì)發(fā)布的48個(gè)品種特定藥物生物等效性研究技術(shù)指導(dǎo)原則中(見(jiàn)表2),固體口服制劑共42個(gè)品種(其中片劑37個(gè)��、膠囊劑3個(gè)����、 顆粒劑和混懸劑各1個(gè))����,占比87.5%��;注射劑5個(gè)品種�,分別為丙泊酚中長(zhǎng)鏈脂肪乳注射液、注射用兩性霉素B脂質(zhì)體��、依托咪酯乳狀注射液�、注射用醋酸奧曲肽微球和注射用亮丙瑞林微球,均為復(fù)雜注射劑����;乳膏劑1個(gè)品種,即利丙雙卡因乳膏����。
2.2 試驗(yàn)類型及設(shè)計(jì)方案
試驗(yàn)類型方面��,累計(jì)發(fā)布的48個(gè)特定藥物生物等效性研究技術(shù)指導(dǎo)原則中����,46個(gè)品種開(kāi)展人體內(nèi)生物等效性研究,2個(gè)品種(醋酸鈣片�、碳酸鑭咀嚼片)采用體外磷結(jié)合試驗(yàn)方式開(kāi)展生物等效性研究��。
試驗(yàn)設(shè)計(jì)方面����,46個(gè)開(kāi)展人體內(nèi)生物等效性試驗(yàn)品種中��,23 個(gè)品種建議采用兩制劑��、兩周期��、兩序 列交叉試驗(yàn)設(shè)計(jì)��;13個(gè)品種建議采用兩制劑�、兩周 期、兩序列交叉試驗(yàn)設(shè)計(jì)��,也可采用部分重復(fù)或完全重復(fù)交叉設(shè)計(jì)��;2個(gè)品種(利伐沙班片�、卡馬西平片)則明確建議采用兩制劑、四周期��、完全重復(fù)交叉試驗(yàn)設(shè)計(jì)����;4個(gè)品種建議采用兩制劑����、兩周期����、兩序列交叉設(shè)計(jì)或平行試驗(yàn)設(shè)計(jì);2個(gè)抗腫瘤復(fù)雜注射劑(注射用醋酸奧曲肽微球�、注射用亮丙瑞林微球) 建議采用平行試驗(yàn)設(shè)計(jì);1個(gè)品種(氯氮平片)建議采用兩制劑�、兩周期、兩序列交叉設(shè)計(jì)����,開(kāi)展穩(wěn)態(tài)人體生物等效性研究,2周期間可不設(shè)置洗脫期����;1個(gè)品種(甲氨蝶呤片)未明確具體試驗(yàn)設(shè)計(jì)建議 ,僅提出開(kāi)展空腹和餐后條件下的人體生物等效性研究����。
46個(gè)開(kāi)展人體內(nèi)生物等效性試驗(yàn)品種中����,25個(gè)品種建議開(kāi)展空腹和餐后生物等效性試驗(yàn)����,18個(gè)品種建議僅開(kāi)展空腹生物等效性試驗(yàn)�,1個(gè)品種(甲磺酸伊馬替尼片)建議僅開(kāi)展餐后生物等效性試驗(yàn),2個(gè)品種(注射用兩性霉素B脂質(zhì)體�、注射用亮丙瑞林微球)則均未提及。
2.3 受試者
46個(gè)開(kāi)展人體內(nèi)生物等效性試驗(yàn)品種中��,35個(gè)品種建議選擇健康受試者(男女兼有)開(kāi)展生物等效性試驗(yàn)����;考慮適應(yīng)證因素,6個(gè)品種建議選擇單性別受試者開(kāi)展生物等效性試驗(yàn)�,其中5個(gè)品種建議選擇男性健康受試者開(kāi)展試驗(yàn),1個(gè)品種(地屈孕酮片)建議選擇健康女性受試者開(kāi)展試驗(yàn)��;考慮安全風(fēng)險(xiǎn)����,4個(gè)品種建議選擇患者開(kāi)展生物等效性試驗(yàn),1個(gè)品種(甲氨蝶呤片)建議選擇患者或健康受試者開(kāi)展試驗(yàn)����。
2.4 檢測(cè)物質(zhì)與等效性評(píng)價(jià)
參考中國(guó)2016年發(fā)布的《以藥動(dòng)學(xué)參數(shù)為終點(diǎn)評(píng)價(jià)指標(biāo)的化學(xué)藥物仿制藥人體生物等效性研究技術(shù)指導(dǎo)原則》[15]相關(guān)要求,一般推薦僅測(cè)定原形藥物����,并建議以原形藥物評(píng)價(jià)生物等效性�,代謝產(chǎn)物的相關(guān)數(shù)據(jù)用于進(jìn)一步支持臨床療效的可比性����。在46個(gè)開(kāi)展人體內(nèi)生物等效性試驗(yàn)品種中,34個(gè)品種僅需進(jìn)行原形藥物的檢測(cè)(含復(fù)方品種)��,12個(gè)則需同時(shí)對(duì)原形藥物及代謝產(chǎn)物進(jìn)行檢測(cè)��;45個(gè)品種采集血漿作為生物樣本進(jìn)行檢測(cè)��,1個(gè)品種(氯化鉀緩釋片)則采集尿液作為生物樣本進(jìn)行檢測(cè)[16]����。
生物等效性評(píng)價(jià)方面,46個(gè)開(kāi)展人體內(nèi)生物等效性試驗(yàn)品種中��,31個(gè)品種建議采用平均生物等效性(ABE)進(jìn)行生物等效性評(píng)價(jià)�,12個(gè)品種因體內(nèi)變異較大,建議采用ABE或參比制劑標(biāo)度的平均生物等效性(RSABE)方法進(jìn)行生物等效性評(píng)價(jià)��,2個(gè)品種(卡馬西平片����、利伐沙班片)因?qū)儆谡委熤笖?shù)藥物,建議采用參比制劑標(biāo)度的平均生物等效性(RSABE)方法進(jìn)行生物等效性評(píng)價(jià)�,1個(gè)品種(氯化鉀緩釋片)因選擇尿液作為生物樣本進(jìn)行檢測(cè),其生物等效性評(píng)價(jià)建議以經(jīng)基線校正后鉀的0~24h累積尿排泄量(Ae0 24h)和尿排泄最大速率(Rmax)為評(píng)價(jià)指標(biāo)��,接受標(biāo)準(zhǔn)為受試制劑與參比制劑的Ae0 24h和Rmax的幾何均值比的90%置信區(qū)間均應(yīng)不低于80.00%����,且不超過(guò)125.00%。
2.5 生物等效性試驗(yàn)豁免
在已發(fā)布的48個(gè)特定藥物生物等效性研究技術(shù)指導(dǎo)原則中����,23個(gè)品種在滿足以下條件情況下,可申請(qǐng)其他規(guī)格生物等效性試驗(yàn)的豁免:(1)申報(bào)的最高規(guī)格制劑符合生物等效性要求����、(2)各規(guī)格制劑在不同pH值介質(zhì)中體外溶出曲線相似、(3)各規(guī)格制劑的處方比例相似�;25個(gè)品種因?yàn)閲?guó)內(nèi)僅上市單一規(guī)格,不適用于其他規(guī)格生物等效性試驗(yàn)豁免����。
3、 特定藥物生物等效性研究技術(shù)指導(dǎo)原則的幾點(diǎn)考慮
對(duì)比美國(guó)FDA��、歐盟等先進(jìn)監(jiān)管機(jī)構(gòu)特定藥物生物等效性研究指南發(fā)布情況可見(jiàn),中國(guó)仿制藥生物等效性試驗(yàn)審評(píng)技術(shù)體系構(gòu)建的起步時(shí)間較晚����,特定藥物生物等效性研究技術(shù)指導(dǎo)原則的發(fā)布數(shù)量以及發(fā)布頻次等較美國(guó)FDA有不小的差距。自2015年中國(guó)藥品和醫(yī)療器械審評(píng)審批制度改革實(shí)施以來(lái)����,中國(guó)堅(jiān)持臨床需求導(dǎo)向,積極借鑒美國(guó)FDA��、歐盟等先進(jìn)藥品監(jiān)管機(jī)構(gòu)現(xiàn)有經(jīng)驗(yàn)����,在積累的大量生物等效性研究數(shù)據(jù)基礎(chǔ)上,中國(guó)生物等效性試驗(yàn)審評(píng)審批技術(shù)體系基本建立并逐漸得以完善�,積極制修訂共性技術(shù)指導(dǎo)原則10余個(gè)、特定藥物生物等效性研究技術(shù)指導(dǎo)原則40余個(gè)��,有效地促進(jìn)了中國(guó)化學(xué)仿制藥一致性評(píng)價(jià)專項(xiàng)工作的開(kāi)展�。
3.1 生物等效性試驗(yàn)審評(píng)技術(shù)體系日趨完善
藥品審評(píng)中心2015年11月《以藥動(dòng)學(xué)參數(shù)為終點(diǎn)評(píng)價(jià)指標(biāo)的化學(xué)藥物仿制藥人體生物等效性研究技術(shù)指導(dǎo)原則》公開(kāi)征求意見(jiàn)以來(lái)[17],先后發(fā)布了《生物等效性研究的統(tǒng)計(jì)學(xué)指導(dǎo)原則》[18]�、《高變異藥物生物等效性研究技術(shù)指導(dǎo)原則》[18]、《經(jīng)口吸入制劑仿制藥生物等效性研究指導(dǎo)原則》[19]以及《窄治療指數(shù)藥物生物等效性研究技術(shù)指導(dǎo)原則》[20]等10余個(gè)仿制藥生物等效性試驗(yàn)相關(guān)共性技術(shù)指導(dǎo)原則����;先后發(fā)布《人體生物等效性試驗(yàn)豁免指導(dǎo)原則的通告》[21]以及2批《可豁免或簡(jiǎn)化人體生物等效性試驗(yàn)品種》目錄[22-23],共涉及可以豁免或簡(jiǎn)化人體生物等效性試驗(yàn)品種60余個(gè);累計(jì)發(fā)布48個(gè)特定藥物生物等效性技術(shù)指導(dǎo)原則(含征求意見(jiàn)稿)����,中國(guó)生物等效性試驗(yàn)審評(píng)審批技術(shù)體系基本建立并逐漸得以完善�。
3.2 堅(jiān)持臨床導(dǎo)向制定生物等效性技術(shù)指導(dǎo)原則
在已發(fā)布48個(gè)特定藥物生物等效性技術(shù)指導(dǎo)原則(含征求意見(jiàn)稿)中,藥品審評(píng)中心始終堅(jiān)持臨床價(jià)值導(dǎo)向����,一方面,對(duì)于臨床急需的抗腫瘤藥物(如甲磺酸伊馬替尼片����、巰嘌呤片等)、心血管藥物(如硫酸氫氯吡咯雷片��、阿司匹林腸溶片等)及時(shí)明確生物等效性試驗(yàn)評(píng)價(jià)要求����,盡早公開(kāi)征求意見(jiàn)并發(fā)布,滿足業(yè)界對(duì)于相關(guān)品種開(kāi)展仿制的迫切需求�;另一方面,為進(jìn)一步滿足國(guó)內(nèi)仿制藥一致性評(píng)價(jià)以及品種研發(fā)的需求�,及時(shí)制定國(guó)際先進(jìn)監(jiān)管國(guó)家或機(jī)構(gòu)尚暫未發(fā)布的特定藥物生物等效性技術(shù)指導(dǎo)原則(如甲氨蝶呤片、復(fù)方甘草酸苷片)��,經(jīng)梳理累計(jì)達(dá)10余個(gè)。
在特定藥物生物等效性技術(shù)指導(dǎo)原則制定品種遴選上����,對(duì)部分在國(guó)際先進(jìn)監(jiān)管國(guó)家或機(jī)構(gòu)間,生物等效性試驗(yàn)評(píng)價(jià)存在爭(zhēng)議的品種(如利伐沙班片��、他達(dá)拉非片等)����,經(jīng)專家審議、公開(kāi)征求意見(jiàn)后及時(shí)予以發(fā)布�,進(jìn)一步規(guī)范、統(tǒng)一了中國(guó)上述特定藥物生物等效性評(píng)價(jià)標(biāo)準(zhǔn)����;在劑型方面,在固體口服制劑仿制藥一致性評(píng)價(jià)穩(wěn)步推進(jìn)的前提下��,累計(jì)發(fā)布固體口服制劑42個(gè)品種����,同時(shí)為有效促進(jìn)其他劑型仿制藥一致性評(píng)價(jià)工作,發(fā)布5個(gè)復(fù)雜注射劑品種以及1個(gè)外用乳膏劑品種(利丙雙卡因乳膏)的特定藥物生物等效性技術(shù)指導(dǎo)原則����。
3.3 推進(jìn)特定藥物生物等效性技術(shù)指導(dǎo)原則制修訂
截至2023年12月31日��,中國(guó)已累計(jì)發(fā)布48個(gè)特定藥物生物等效性研究技術(shù)指導(dǎo)原則(含征求意見(jiàn)稿16個(gè))��,但與國(guó)際先進(jìn)監(jiān)管國(guó)家或機(jī)構(gòu)相比����,仍處于起步階段�。對(duì)于已發(fā)布的技術(shù)指導(dǎo)原則�,申請(qǐng)人如有修訂或補(bǔ)充完善的需求,可在征求意見(jiàn)過(guò)程中��、或者正式發(fā)布以后及時(shí)予以反饋����;另一方面,也鼓勵(lì)申請(qǐng)人通過(guò)溝通交流平臺(tái)��、申請(qǐng)人之窗等����,在品種背景調(diào)研、已有生物等效性試驗(yàn)研究結(jié)果等信息的基礎(chǔ)上提出品種立項(xiàng)建議����,與藥品審評(píng)中心共同起草����、制定中國(guó)暫未明確品種或國(guó)際尚未發(fā)布品種的生物等效性技術(shù)要求或指導(dǎo)原則�,以進(jìn)一步滿足臨床需求,避免臨床資源的浪費(fèi)��。
4��、 結(jié)語(yǔ)
2015年中國(guó)藥品和醫(yī)療器械審評(píng)審批制度改革實(shí)施以來(lái)�,國(guó)務(wù)院、NMPA及其相關(guān)事業(yè)單位����,逐級(jí)聯(lián)動(dòng),有效地推動(dòng)了化學(xué)仿制藥質(zhì)量和療效一致性評(píng)價(jià)專項(xiàng)工作����,隨著2020年版《藥品管理辦法》的實(shí)施[24],以原研為“標(biāo)桿”的仿制藥審評(píng)標(biāo)準(zhǔn)以及已上市仿制藥一致性評(píng)價(jià)的有序開(kāi)展��,使中國(guó)近年來(lái)上市仿制藥的質(zhì)量和療效得到了明顯提升�。生物等效性試驗(yàn)是評(píng)價(jià)仿制藥與原研藥質(zhì)量和療效一致性的重要方法,試驗(yàn)方法的科學(xué)性����、評(píng)價(jià)標(biāo)準(zhǔn)的適用性�、數(shù)據(jù)資料的規(guī)范性直接影響對(duì)仿制藥質(zhì)量和療效評(píng)價(jià)的準(zhǔn)確性�,這需要藥品監(jiān)管部門對(duì)申請(qǐng)人進(jìn)行生物等效性研究的科學(xué)引導(dǎo)、管理和監(jiān)督��。從已發(fā)布生物等效性共性技術(shù)指導(dǎo)原則��、特定藥物生物等效性研究技術(shù)指導(dǎo)原則可見(jiàn)中國(guó)藥品監(jiān)管部門的努力和決心����,但也應(yīng)明顯看到,在生物等效性研究評(píng)價(jià)�、監(jiān)管體系建設(shè)等方面�,中國(guó)與國(guó)際先進(jìn)藥品監(jiān)管機(jī)構(gòu)尚存一定的差距,業(yè)界對(duì)一些尚未明確生物等效性技術(shù)要求的藥品仍存在較為急切的需求�。隨著中國(guó)仿制藥審評(píng)評(píng)價(jià)、日常監(jiān)管工作的持續(xù)推進(jìn)��,相信將有更多“質(zhì)優(yōu)價(jià)廉”的仿制藥進(jìn)入臨床應(yīng)用��,進(jìn)一步提升廣大患者的“獲得感”“幸福感”����。






