醫(yī)療器械注冊是指醫(yī)療器械注冊申請人依照法定程序和要求提出醫(yī)療器械注冊申請,藥品監(jiān)督管理部門依據法律法規(guī)��,基于科學認知,進行安全性�����、有效性和質量可控性等審查��,決定是否同意其申請的活動���。技術審評作為注冊管理的一個重要環(huán)節(jié)��,審的是產品的安全性和有效性,是對與安全有效相關的證據進行系統評價的過程���。
對于首次注冊的產品,技術審評通常以《醫(yī)療器械安全和性能的基本原則》(以下簡稱《基本原則》)和《醫(yī)療器械 風險管理對醫(yī)療器的應用》為抓手開展,上述文件在對產品安全有效性進行系統評價的過程中有著非常關鍵的作用�����。
1���、 基本概念
1.1 安全
按照《醫(yī)療器械風險管理對醫(yī)療器械的應用》(GB/T42062)3.26定義,安全是免除了不可接受的風險的狀態(tài)。醫(yī)療器械是沒有絕對安全,所謂的安全是相對風險而言��。
1.2 有效
有效在字典的定義是“能實現預期用途”,醫(yī)療器械預期都是解決某個醫(yī)療問題。例如,高頻手術設備的預期用途為在外科手術中,用于軟組織的切割和凝血�����。那么實現軟組織切割和凝血的能力即為高頻手術設備的有效性���。
評價一個產品是否能夠上市是受益和風險的權衡,也是安全性和有效性的綜合考慮�����。正如前文所述醫(yī)療器械沒有絕對的安全,所謂的安全是相對風險而言,技術審評最終得出的結論是基于醫(yī)療器的有效性(受益)與醫(yī)療器械的安全性(風險)綜合之后是否能夠得出受益大于風險的結論�����。隨著認知程度���、教育醫(yī)療器梳質量-程度�����、社會經濟��、患者健康狀態(tài)以及其他因素的變化���,對安全有效的認知和判斷可能也會不斷的變化和發(fā)展�����。
1.3 系統性評價
系統性評價是對產品安全有效性進行深度和廣度的綜合評價��。舉例來說,有源醫(yī)療器械需要遞交YY9706.102-2021電磁兼容檢測報告,技術審評需要針對報告內容進行審評��。但這并不是完整的深度評價過程���。完整的深度評價過程應參考《醫(yī)療器械安全和性能基本原則符合性技術指南》,確定產品是否適用《醫(yī)療器械安全和性能基本原則清單》中A5.2c)h)A7.5��、A7.6的相關要求以及證明符合該要求的方法,最后對符合性的證據文件進行評價見圖1�����。
而電磁兼容性只是醫(yī)療器械產品應該考慮的單一風險,開展完整深度評價的同時還應對產品安全有效性進行廣度評價���,例如還應考慮產品的電氣安全方面的風險��、生物學方面的風險、能量相關的風險以及產品的有效性等�����。因此,認為技術審評就是審標準的符合性是有些片面的。符合標準只是證明產品在某一方面達到了行業(yè)共識,完成標準符合性的審評只是系統評價象限中的一個點或者局部面�����。對于技術審評來說,完成系統性評價是需要多年經驗積累���,而基本原則》可提供系統性評價的工具
2��、醫(yī)療器械安全和性能的基本原則
2.1 背景
2005年,國際醫(yī)療器監(jiān)管機構論壇(IMDRF)的前身CHTF(全球協調工作組)發(fā)布了第一版《基本原則》��?����!痘驹瓌t》發(fā)布后在全球范圍內廣泛運用���、歷經2012���、2018年兩次修訂���、完善,形成現行版本為構建科學的醫(yī)療器械監(jiān)管體系,加快與國際接軌�����,國家藥監(jiān)局組織相關部門等同轉化IMDRF2018版基本原則》,于2020年3月發(fā)布�����。
《醫(yī)療器械注冊與備案管理辦法》第十三條規(guī)定:醫(yī)療器械注冊備案應當遵守相關法律��、法規(guī)�����、規(guī)章�����、強制性標準,遵循醫(yī)療器安全和性能基本原則,參照相關技術指導原則,證明注冊�����、備案的醫(yī)療器械安全��、有效���、質量可控,保證全過程信息真實誰確完整和可追溯��。同時,醫(yī)療器械安全和性能基本原則清單也作為非臨床資料列人注冊申報資料要求。
2.2 框架及內容
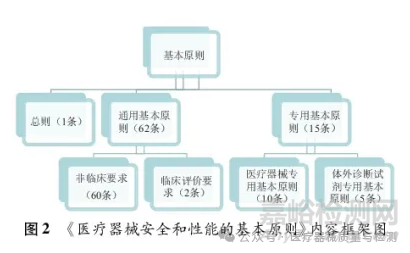
《基本原則》全文共78條,8016字,78條要求分為三個部分���。
第一部分總則,強調了從事醫(yī)療器械行業(yè)的注冊人/備案人所應具備的基本能力,即確定醫(yī)療器械安全和性能要求時應考慮全生命周期下的所有情況,醫(yī)療器械設計和生產不能脫離質量管理體系控制,同時注冊人/備案人應當提供證明產品安全有效的證據第二部分是所有醫(yī)療器械適用的基本原則,明確了非體外診斷醫(yī)療器械和體外診斷醫(yī)療器械在設計生產過程中應關注的風險點,以及相關的性能要求第三部分按照非體外診斷醫(yī)療器械和體外診斷醫(yī)療器械兩大類別,對特定醫(yī)療器械,分別補充了它們所應滿足的安全和性能基本原則��。如可吸收醫(yī)療器械���、醫(yī)學影像醫(yī)療器械���、植人式醫(yī)療器、含藥物成分的組合產品等���。見圖2.
2.3 技術審評過程中的作用
醫(yī)療器械安全和性能基本原則清單作為注冊申報資料要求的一部分,整合了與安全有效性相關的基本要求,并納人了符合性方法和客觀證據,形成了一個從提出要求到證明要求的符合性閉環(huán),構建了系統性評價的基礎。技術審評就是以《基本原則》要求為索引,將注冊申報資料中各項證據緊密聯系起來,從安全性能基本要求出發(fā)對產品進行系統性評價,從而確保不遺漏任何重大風險點���。這樣的評價過程有助于提升醫(yī)療器械的安全性和有效性,保障患者的利益�����。如果《基本原則》中適用的條款完整,證明符合性所采用的方法合理���、恰當,所提交證據全面�����、充分,則可認為產品符合安全有效基本要求,通過技術審評,獲準注冊���。
3�����、醫(yī)療器械風險管理
醫(yī)療器械的安全性和風險之間緊密聯系?�!夺t(yī)療器械風險管理對醫(yī)療器械的應用》(GB/T420622022)旨在幫助醫(yī)療器械制造商識別與醫(yī)療器械相關的風險,估計和評價相關的風險,控制這些風險并監(jiān)視控制的有效性?��!痘驹瓌t》清單的內容是注冊申請人在設計和生產過程中,按照風險控制原則�����,對所形成文件進行邏輯性梳理��。清單中安全性相關的要求,是各制造商在風險管理過程中識別出通用安全特征的總結和提煉,清單中的方法和客觀證據則是用于證明制造商風險控制措施的有效性,最終的審評結論則是基于產品的剩余風險和產品有效性的綜合考量得出的。因此掌握GB/T42062的風險管理思路在審評過程中結合制造商提供的風險管理資料���,對于完成產品安全有效性系統性評價至關重要��?�!痘驹瓌t》是適用于所有醫(yī)療器械的通用要求,已識別出的風險包括生物相容性��、微生物污染���、輻射安全���、環(huán)境和使用條件、電氣安全���、電磁兼容、有源醫(yī)療器械的連接等方面的風險,并不能夠保證窮舉所有產品的風險,風險管理的思路還有助于提出更多安全性相關的問題以查漏補缺��。
4���、變更注冊審評思路
《醫(yī)療器械注冊與備案管理辦法》第八十條規(guī)定,對于變更注冊申請,技術審評機構應當重點針對變化部分進行審評�����,對變化后產品是否安全、有效���、質量可控形成審評意見��。技術審評應以《基本原則》和醫(yī)療器械風險管理對醫(yī)療器的應用》為指導,關注變化部分對產品安全有效性的影響���。如發(fā)現有任何影響,注冊人需提供充分的證據來證明變化后產品的安全有效性���。變化部分對產品安全有效性的影響可能是多方面的,應綜合考慮��。例如產品技術要求中載明的與人體接觸部分的材料發(fā)生變化,就需要根據產品適用范圍和技術特征,全面考慮變化部分對產品技術要求中的性能指標��、生物學特性��、清潔消毒滅菌穩(wěn)定性��、臨床有效性等方面的影響,并提供相應的注冊申報資料�����。
5���、結語
通過合理運用《醫(yī)療器械安全和性能的基本原則》和《醫(yī)療器械風險管理對醫(yī)療器的應用》���,所有的審評意見都將有依據可循。如果注冊申請人能夠提供完整且充分的醫(yī)療器械安全和性能基本原則清單以及風險管理資料���,將有利于提高技術審評的效率和質量。同時,技術審評的一致性�����、規(guī)范性�����、科學性和系統性也將得到大大提升��。