美國 FDA 藥品質(zhì)量辦公室(OPQ)于 4 月 3 日發(fā)布 2023 年年度報告����,這是自 OPQ 成立以來發(fā)布的第七份年報。今年的年報強調(diào)了 OPQ 的四大戰(zhàn)略重點:協(xié)作�����、溝通����、參與、創(chuàng)新�����。介紹了 OPQ 在過去一年中的成就和進展��。
OPQ 通常一年會有兩份比較重要的總結(jié)報告,這是一份����,另一份是 FDA 藥品質(zhì)量狀況報告,一般在年中左右發(fā)布����。
OPQ年度報告
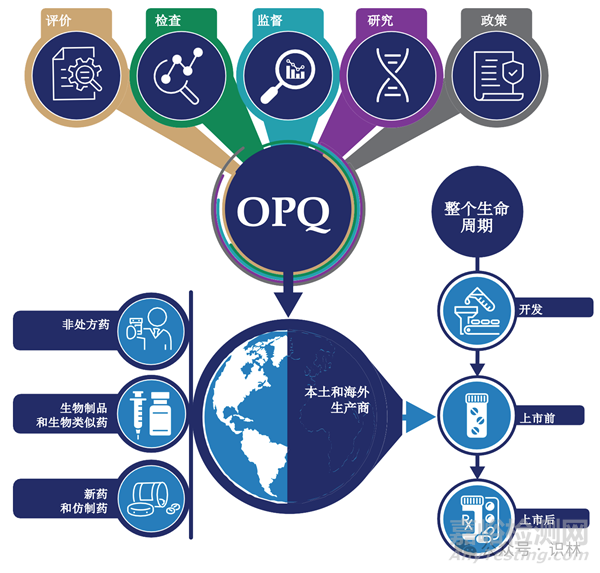
FDA藥品審評與研究中心(CDER)的藥品質(zhì)量辦公室(OPQ)負責確保美國公眾可以獲得優(yōu)質(zhì)藥品�����。藥品質(zhì)量保證了每一劑藥品的可用性��、安全性和有效性��。OPQ監(jiān)督美國本土和海外的生產(chǎn)和每種上市銷售的人用藥品�����,包括新藥和仿制藥�����,生物制品(包括生物類似藥)以及非處方藥��。評價、檢查��、監(jiān)督��、研究和政策協(xié)同工作����,以提供全球范圍內(nèi)以及藥品整個生命周期內(nèi)的監(jiān)管。
OPQ對藥品上市和許可申請的評價由原料藥����、成品制劑、生產(chǎn)和生物制藥方面的專家組成�����,為申請的批準提供質(zhì)量建議�����。設(shè)施檢查和設(shè)施評估替代工具對于確保生產(chǎn)質(zhì)量和符合生產(chǎn)要求至關(guān)重要�����。OPQ是生產(chǎn)生物技術(shù)產(chǎn)品設(shè)施許可前檢查的主導(dǎo)辦公室�����,并在需要時作為其它產(chǎn)品類型的批準前檢查的主題專家參與。
OPQ使用監(jiān)督來持續(xù)監(jiān)測CDER監(jiān)管場所和產(chǎn)品的質(zhì)量狀態(tài)����,并迅速采取行動保護消費者免受質(zhì)量風險。研究產(chǎn)生的知識使與藥品質(zhì)量相關(guān)的基于科學(xué)的決策和政策成為可能�����。OPQ制定的明確而穩(wěn)健的政策為制藥業(yè)利益攸關(guān)方提供了方向和清晰度����。
協(xié)作����、溝通、參與和創(chuàng)新的戰(zhàn)略支柱支持OPQ的核心職能��。合作加強了OPQ的文化以及與FDA業(yè)務(wù)伙伴的關(guān)系����。溝通使OPQ能夠提高對藥品質(zhì)量重要性的認識和承諾。創(chuàng)新致力于促進美國公眾獲得更好的藥品�����,而參與則建立與公共利益攸關(guān)方的伙伴關(guān)系和聯(lián)系。
戰(zhàn)略重點
OPQ使用四個戰(zhàn)略重點來確保美國公眾可以獲得優(yōu)質(zhì)藥品����。本報告分享了2023年(日歷年)與這些優(yōu)先事項相關(guān)的成就。
協(xié)作
加強OPQ的文化以及與FDA業(yè)務(wù)伙伴的關(guān)系
• CDER的藥品目錄包含>140,000種藥品
• CDER的場地目錄包含>4,800個生產(chǎn)場地
• 對>1,100份獲批申請進行質(zhì)量評價
• 118件新藥申請
• 956件仿制藥申請
• 29件生物制品許可申請(包括生物類似藥)
• 支持55個新藥獲批����,包括17個生物技術(shù)產(chǎn)品
• 359項加速質(zhì)量評價以解決藥品短缺問題
• 解決孤兒病的28項優(yōu)先評估
• 在 10 個州和 18 個國家/地區(qū)進行 65 次許可前檢查
溝通
提高對藥品質(zhì)量重要性的認識和承諾
• 支持發(fā)布10份指南文件
• 發(fā)布了7份政策和程序手冊(MAPP)和2份合規(guī)項目
• 2023年6月發(fā)布的藥品質(zhì)量狀況報告,下載量>7,800次
• OPQ員工參加公開研討會�����、會議和網(wǎng)絡(luò)研討會>350次
• 在同行評審文獻中發(fā)表了>90篇文章
參與
與利益攸關(guān)方建立伙伴關(guān)系并建立聯(lián)系
• 進行了12次CDER研討會和活動
• 兩年一度的制藥質(zhì)量研討會吸引了來自122個國家的近7,000名與會者
• 制定了7項關(guān)于質(zhì)量主題的國際指南
• 在國際試點項目中與其它全球監(jiān)管機構(gòu)一起評估了2件申請
• 參與119個美國藥典專家機構(gòu)
• 發(fā)表2篇關(guān)于質(zhì)量管理成熟度的論文
創(chuàng)新
促進更好藥物的可及性
• 接受了15份新興技術(shù)計劃提案
• 舉辦為期兩天的公開研討會��,并發(fā)布了一份關(guān)于藥品生產(chǎn)中的AI的白皮書
• 發(fā)表總結(jié)利益相關(guān)者對分布式制造監(jiān)管框架的反饋的論文
• 舉辦2023年公開研討會����,支持2023年12月發(fā)布先進制造技術(shù)認定計劃指南文件草案
• 知識輔助評價和結(jié)構(gòu)化申請(KASA)簡化了近1,440件申請的評價
協(xié)作
CDER的場地目錄包含全球4,800多個生產(chǎn)場地。盡管OPQ負責確保在美國銷售的人用藥品符合質(zhì)量標準��,但僅憑OPQ孤軍奮戰(zhàn)是不可能的�����。這一使命是通過FDA內(nèi)部的合作實現(xiàn)的,包括仿制藥辦公室��,新藥辦公室�����,合規(guī)辦公室�����,和監(jiān)管事務(wù)辦公室��。
2023年�����,OPQ對1,100多件已獲批或暫時獲批的產(chǎn)品申請進行了質(zhì)量評價�����。其中包括118件新藥申請�����,956件仿制藥申請和29件生物制品許可申請(包括生物類似藥)����。值得注意的是,OPQ支持了55個創(chuàng)新藥的批準(含有以前未提交給FDA的新分子產(chǎn)品)�����,其中包括17個創(chuàng)新的生物技術(shù)產(chǎn)品����。創(chuàng)新藥通常為患者和消費者帶來新的或先進的治療選擇。這些新藥被批準用于治療多種疾病�����,包括一種影響大腦發(fā)育的罕見遺傳性神經(jīng)系統(tǒng)疾病��,以及由慢性腎病引起的貧血��。
所有患者對他們的下一劑藥物都應(yīng)有信心�����。雖然所有在使用者費用計劃下提交的申請都使用目標時間表進行評價��,OPQ加快評價以解決關(guān)鍵的公共衛(wèi)生需求�����,例如,解決藥品短缺和罕見病或孤兒病問題�����。OPQ進行了359次加速質(zhì)量評價以解決藥品短缺��,進行了28次優(yōu)先評估以解決幾乎沒有治療選擇的孤兒病�����。
OPQ檢查世界各地為美國患者生產(chǎn)生物技術(shù)產(chǎn)品的設(shè)施��。2023年�����,OPQ對10個州和18個國家/地區(qū)的生物技術(shù)產(chǎn)品生產(chǎn)設(shè)施進行了65次許可前檢查�����。所有生產(chǎn)在美國上市銷售的人用藥品的設(shè)施����,無論其產(chǎn)地和產(chǎn)品如何,都必須符合相同的要求��。
溝通
FDA和公眾之間的信息交流使OPQ的核心職能得以實現(xiàn)�����。OPQ 的溝通形式多種多樣����,從正式的書面溝通(例如政策文件和正式報告)到 OPQ 員工專家在世界各地的科學(xué)活動中的口頭報告。
2023年����,OPQ支持發(fā)布10篇行業(yè)指南文件,主題包括臨床研究中的大麻��,先進生產(chǎn)技術(shù)認定計劃以及評價生產(chǎn)設(shè)施的替代工具����。這些指南文件有助于描述FDA對監(jiān)管問題政策的解釋,當最終確定時����,代表了目前對某個主題的看法。其它政策文件,例如政策和程序手冊(MAPP) 和合規(guī)計劃����,記錄了FDA的內(nèi)部政策和規(guī)程,其中大部分都是公開的��,以提高透明度�����。2023年��,OPQ發(fā)布了7個MAPP��,主題包括對CDER基于風險的場地選擇模型的修訂����,CDER用它來確定監(jiān)督檢查的生產(chǎn)場地的優(yōu)先次序。OPQ支持發(fā)布兩個合規(guī)計劃����,為參與檢查的FDA人員提供指導(dǎo)。
OPQ每年都會發(fā)布一篇藥品質(zhì)量狀況報告��,報告提供了美國制藥業(yè)的客觀指標和分析��,例如生產(chǎn)商的所在地和收到的產(chǎn)品質(zhì)量缺陷報告����。最新于2023年6月發(fā)布的藥品質(zhì)量狀況報告已被下載超過7,800次。
OPQ專家定期在公開活動中作報告��。2023年�����,OPQ工作人員參加公開研討會��、會議和網(wǎng)絡(luò)研討會超過350次��。OPQ發(fā)布了一個視頻�����,描述FDA和行業(yè)在保護消費者免受藥品質(zhì)量風險方面的作用��。OPQ科學(xué)家和研究人員在同行評議的文獻中發(fā)表了90多篇文章��,主題范圍從評估藥物關(guān)鍵質(zhì)量屬性的分析方法到雙特異性抗體與靶標的結(jié)合��,再到先進生產(chǎn)技術(shù)的使用��。2023年,OPQ研究人員因其關(guān)于癌癥免疫療法的文章獲得美國制藥科學(xué)家協(xié)會(AAPS)2023年高影響力出版物獎�����,這是OPQ研究人員首次獲得這一享有盛譽的外部獎項�����。
參與
參與鼓勵OPQ����、其他組織和公眾之間的積極合作伙伴關(guān)系。2023年�����,OPQ繼續(xù)與CDER的小型企業(yè)和行業(yè)援助(SBIA)計劃開展長期合作����,以開發(fā)12個免費向公眾開放的研討會和活動。這包括兩年一度的藥品質(zhì)量研討會����,吸引了來自 122 個國家的近 7000 名虛擬與會者。FDA的專家小組成員在活動期間回答了聽眾的問題����,所有錄音都可以在線獲取。
OPQ還與國際監(jiān)管機構(gòu)合作�����,努力實現(xiàn)全球監(jiān)管實踐的融合�����。2023年��,OPQ幫助制定了7個國際人用藥品注冊技術(shù)要求協(xié)調(diào)會(ICH)關(guān)于質(zhì)量主題的指南��,包括生物技術(shù)產(chǎn)品的分析方法開發(fā)和病毒安全性評估����。OPQ還通過國際藥品監(jiān)管機構(gòu)聯(lián)盟(ICMRA)試點項目參與國際監(jiān)管界的活動,重點是混合檢查和批準后變更的合作評價�����。這些計劃的目標是為協(xié)作評估和混合檢查制定一個共同的國際框架�����,確定最佳實踐和標準,并統(tǒng)一國際監(jiān)管機構(gòu)的思維��。2023年�����,OPQ與其他全球監(jiān)管機構(gòu)一起評估了ICMRA試點計劃中的兩份申請�����。
藥品質(zhì)量標準允許FDA為所有申請人建立一個公平的競爭環(huán)境����。OPQ與美國藥典(USP)合作制定原料藥和產(chǎn)品的質(zhì)量標準。2023年�����,OPQ作為政府聯(lián)絡(luò)人參加了119個USP專家機構(gòu)��,討論的主題包括輔料��、包裝和含量均一性��。雖然一些標準是強制性的����,但許多由利益攸關(guān)方提出并被FDA認可的非強制性標準被稱為自愿共識標準����。如果使用得當����,這些標準可以減少監(jiān)管提交所需的文件記錄量����。2023年,CDER啟動了一項質(zhì)量標準計劃��,以承認與藥品質(zhì)量相關(guān)的自愿共識標準����,并在仿制藥和生物類似藥生產(chǎn)中提高效率,這是藥品競爭行動計劃和生物類似藥行動計劃的一部分����。
參與也有助于塑造藥品質(zhì)量的未來,例如OPQ的質(zhì)量管理成熟度(QMM)計劃��,旨在鼓勵藥品生產(chǎn)商實施超出現(xiàn)行藥品生產(chǎn)質(zhì)量管理規(guī)范(CGMP)要求的質(zhì)量管理規(guī)范����。采用成熟的質(zhì)量管理實踐����,通過減少與質(zhì)量相關(guān)的失敗��,以及提高生產(chǎn)商在供應(yīng)鏈中斷期間保持績效的能力����,支持更可靠的藥品供應(yīng)鏈。2023年�����,OPQ發(fā)表了一篇同行評議的文章�����,描述了從評價藥品生產(chǎn)設(shè)施QMM的試點項目中汲取的經(jīng)驗教訓(xùn)����。額外的利益攸關(guān)方參與指導(dǎo)了2023年8月發(fā)布的一份關(guān)于QMM評估方案制定的白皮書,以及一份征求意見的公開摘要��,以協(xié)助進一步制定QMM計劃����。
創(chuàng)新
先進的制造技術(shù)��,例如連續(xù)制造和人工智能(AI)�����,有可能使藥品生產(chǎn)更加敏捷和響應(yīng)迅速��。雖然這些技術(shù)可能有助于提高供應(yīng)鏈的彈性��,但它們會給利益相關(guān)者帶來不確定性。CDER新興技術(shù)計劃(ETP)使FDA能夠在提交監(jiān)管申請之前盡早與開發(fā)新興制藥技術(shù)的利益攸關(guān)方接觸��。2023年����,ETP接受了15項提案,并與開發(fā)新興技術(shù)(例如連續(xù)制造����,分布式制造和新型單元操作)的利益攸關(guān)方舉行了會議。截至2023年底��,ETP已支持22個FDA員工視察開發(fā)新興技術(shù)的生產(chǎn)場地�����,CDER共批準了21個使用新興技術(shù)的產(chǎn)品申請。
CDER的監(jiān)管先進制造評估框架(FRAME)倡議通過幫助CDER準備采用先進制造技術(shù)(例如AI和分布式制造)的申請來補充ETP��。FRAME計劃旨在準備一個監(jiān)管框架來支持先進制造技術(shù)的采用��。2023年�����,F(xiàn)DA舉辦了一個為期兩天的關(guān)于AI監(jiān)管框架的公開研討會��,并發(fā)布了一份白皮書�����,希望利益攸關(guān)方就AI在藥品生產(chǎn)中的使用提供意見����。FDA還發(fā)布了一份文件,總結(jié)利益攸關(guān)方對分布式生產(chǎn)監(jiān)管框架的反饋�����,并分享CDER為解決該框架而采取的行動。利益攸關(guān)方的其它參與包括2023年6月的公開研討會�����,支持2023年12月發(fā)布先進制造技術(shù)認定計劃的指南文件草案�����,以促進采用先進技術(shù)生產(chǎn)的藥物的開發(fā)����。
內(nèi)部創(chuàng)新也正在改進OPQ執(zhí)行的質(zhì)量評估。知識輔助評價和結(jié)構(gòu)化申請 (KASA)獲取和管理藥品生命周期中的知識��,并提供結(jié)構(gòu)化質(zhì)量評價的框架����。2023年��,KASA被用于促進審評員之間的一致性����,并簡化對近1440件申請的評價。
邁向未來
2023年末��,OPQ宣布了一項重組,并于2024年1月中旬實施��。此次重組使OPQ能夠通過更加敏捷和高效來適應(yīng)不斷變化的制藥環(huán)境����。此次重組的關(guān)鍵變化包括:
• 將研究職能整合到一個藥品質(zhì)量研究辦公室,以改善研究協(xié)調(diào)并允許OPQ有效地管理基于實驗室的資源�����。
• 創(chuàng)建新的質(zhì)量保證辦公室��,以促進OPQ工作產(chǎn)品的持續(xù)改進��,員工發(fā)展和質(zhì)量����。
• 將現(xiàn)有的評價職能置于新的產(chǎn)品質(zhì)量評價辦公室 I、II 和 III 中�����,以鼓勵關(guān)注生命周期并靈活應(yīng)對不斷變化的工作量��。
此次重組是戰(zhàn)略規(guī)劃的結(jié)果�����,旨在精簡OPQ的結(jié)構(gòu),以適應(yīng)不斷變化的藥品市場和不斷變化的藥品質(zhì)量重點����。外部利益相關(guān)者應(yīng)不會感受到OPQ重組的任何直接影響。OPQ的新組織結(jié)構(gòu)的許多好處是內(nèi)部的��,例如更好地平衡員工工作量和擴展員工的專業(yè)知識和能力�����。在美國公眾需要時��,高質(zhì)量藥品始終可用的未來����,為了繼續(xù)保持OPQ的績效,這種改進是必要的�����。