1�、年度檢查概況
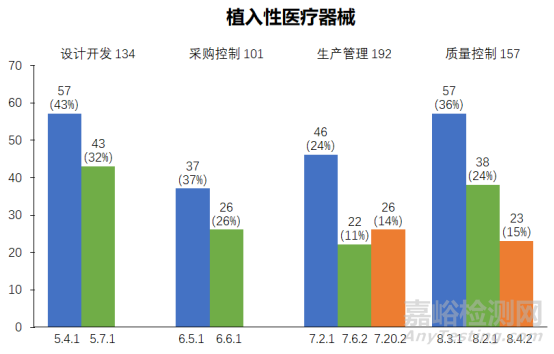
2023年度����,上海市器審中心依據(jù)《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》和《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄植入性醫(yī)療器械》對植入性醫(yī)療器械企業(yè)依申請開展現(xiàn)場核查,合計發(fā)現(xiàn)不符合項共707項次����。從不符合項在《規(guī)范》中各章節(jié)的分布情況來看�,設(shè)計開發(fā)(134項次)、采購控制(101項次)�、生產(chǎn)管理(192項次)、質(zhì)量控制(157項次)涉及的不符合項占比總數(shù)超八成��。
2����、現(xiàn)場核查常見問題
下面將從設(shè)計開發(fā)、采購控制����、生產(chǎn)管理�、質(zhì)量控制四個方面對植入性醫(yī)療器械的常見核查問題進行梳理分析�。
2.1設(shè)計開發(fā)
在設(shè)計開發(fā)方面,常見問題主要集中在條款*5.4.1和5.7.1�。
*5.4.1 設(shè)計和開發(fā)輸出應(yīng)當(dāng)滿足輸入要求,包括采購����、生產(chǎn)和服務(wù)所需的相關(guān)信息、產(chǎn)品技術(shù)要求等����。
(1)產(chǎn)品圖紙、采購質(zhì)量標(biāo)準(zhǔn)等輸出內(nèi)容不完整�。
如產(chǎn)品圖紙僅為示意圖,無尺寸信息或尺寸信息不完整����;當(dāng)有多種規(guī)格時,僅部分規(guī)格有圖紙�。
(2)產(chǎn)品技術(shù)要求、產(chǎn)品圖紙�、采購質(zhì)量標(biāo)準(zhǔn)、成品檢驗指導(dǎo)書等技術(shù)文件之間存在不一致��。
如采購質(zhì)量標(biāo)準(zhǔn)和圖紙規(guī)定的材質(zhì)牌號不一致����。
5.7.1 應(yīng)當(dāng)對設(shè)計和開發(fā)進行驗證����,以確保設(shè)計和開發(fā)輸出滿足輸入的要求�,并保持驗證結(jié)果和任何必要措施的記錄。
(3)設(shè)計驗證缺項��,或發(fā)生變更后�,未及時進行驗證、風(fēng)險評價�。
如產(chǎn)品穩(wěn)定性驗證報告缺少對關(guān)鍵物理、化學(xué)等性能的評價或驗證�,也未提供缺項的依據(jù)����;未對原驗證試驗?zāi)芊窀采w新增規(guī)格產(chǎn)品進行評估。
(4)通過與同類產(chǎn)品的驗證報告進行等同性評估�,但未對產(chǎn)品間差異可能產(chǎn)生的影響進行評價。
如貨架有效期通過與已獲證產(chǎn)品等同評估����,但獲證產(chǎn)品材料種類未涵蓋本產(chǎn)品的所有材料,企業(yè)未對該差異進行評估����。
(5)設(shè)計開發(fā)輸出不滿足輸入的要求�。
如某產(chǎn)品技術(shù)要求規(guī)定靜態(tài)抗壓強度�,“試樣斷裂時最大載荷不低于800N”,但抽查委外驗證檢測報告中顯示斷裂最大載荷為700N��,輸出不滿足輸入要求��。
2.2采購控制
在采購控制方面����,常見問題主要集中在條款6.5.1和6.6.1。
6.5.1采購時應(yīng)明確采購信息�,清晰表述采購要求,包括采購物品類別�、驗收準(zhǔn)則、規(guī)格型號�、規(guī)程、圖樣等內(nèi)容�。
(1)質(zhì)量協(xié)議或采購要求內(nèi)容不完整,如未明確具體的物料��、包裝形式��、驗收要求。
如未明確物料材質(zhì)��、牌號信息��,未規(guī)定色母要求等��;和代理商簽訂的采購質(zhì)量協(xié)議中��,未明確實際生產(chǎn)商信息��;初包裝材料(如透析紙��、盤管等)未明確初始污染菌和微粒要求��。
(2)質(zhì)量協(xié)議內(nèi)容和圖紙等技術(shù)文件的規(guī)定不一致����。
如質(zhì)量標(biāo)準(zhǔn)和圖紙對同一原材料規(guī)定的材質(zhì)、牌號不一致�。
6.6.1應(yīng)當(dāng)對采購物品進行檢驗或驗證��,需要進行生物學(xué)評價的材料��,采購物品應(yīng)當(dāng)與經(jīng)生物學(xué)評價的材料相同����。
(3)進貨檢驗或驗證執(zhí)行不規(guī)范��,實際執(zhí)行和文件規(guī)定不一致�。
如抽查進貨檢驗記錄��,檢驗使用方法和進貨檢驗規(guī)程要求的不一致�;抽樣量與規(guī)程要求不一致。
(4)記錄不完整����。
如未記錄進貨檢使用試劑批號。
2.3生產(chǎn)管理
在生產(chǎn)管理方面����,常見問題主要集中在條款*7.2.1、7.6.2和*7.20.2����。
*7.2.1應(yīng)當(dāng)編制生產(chǎn)工藝規(guī)程、作業(yè)指導(dǎo)書等,明確關(guān)鍵工序和特殊過程�。
(1)作業(yè)指導(dǎo)書未明確某些工藝參數(shù)。
如內(nèi)包裝封口機有多個參數(shù)可調(diào)��,標(biāo)準(zhǔn)操作程序僅規(guī)定封口溫度�,未規(guī)定封口速度�、壓力�。
(2)對關(guān)鍵工序和特殊過程的重要參數(shù)缺少驗證或確認(rèn)。
如未對注塑工藝中注射壓力����、時間、射出速度等參數(shù)進行驗證��;缺少對工藝參數(shù)上下限的驗證����。
7.6.2生產(chǎn)記錄應(yīng)當(dāng)包括:產(chǎn)品名稱、規(guī)格型號����、原材料批號、生產(chǎn)批號或產(chǎn)品編號�、生產(chǎn)日期、數(shù)量�、主要設(shè)備、工藝參數(shù)�、操作人員等內(nèi)容。
(3)生產(chǎn)記錄信息不完整�。
未記錄生產(chǎn)設(shè)備信息����;未記錄程序號����;未記錄工藝參數(shù)等����。
*7.20.2滅菌過程應(yīng)當(dāng)按照相關(guān)標(biāo)準(zhǔn)要求在初次實施前進行確認(rèn),必要時再確認(rèn)�,并保持滅菌過程確認(rèn)記錄。
(4)未按標(biāo)準(zhǔn)要求進行滅菌確認(rèn)��。
如未對環(huán)氧乙烷滅菌過程中關(guān)鍵參數(shù)如溫度����、濕度的上下限開展驗證;環(huán)氧乙烷滅菌驗證記錄中未清晰描述裝載方式�、生物指示劑的放置位置。
2.4質(zhì)量控制
在質(zhì)量控制方面����,常見問題主要集中在條款*8.3.1、8.2.1和8.4.2�。
*8.3.1應(yīng)當(dāng)根據(jù)強制性標(biāo)準(zhǔn)以及經(jīng)注冊或備案的產(chǎn)品技術(shù)要求制定產(chǎn)品的檢驗規(guī)程,并出具相應(yīng)的檢驗報告或證書��。
(1)檢驗規(guī)程不完整,未明確檢測方法��、檢驗條件�、接收標(biāo)準(zhǔn)、抽樣規(guī)則等����,不能有效指導(dǎo)檢驗。
如化學(xué)性能檢驗明確浸提液制備方法����;未規(guī)定周期檢項目檢驗周期;
(2)檢驗規(guī)程和強制性標(biāo)準(zhǔn)��、產(chǎn)品技術(shù)要求不一致����,或風(fēng)險評估不充分。
如出廠檢驗指導(dǎo)書和產(chǎn)品質(zhì)量控制方式清單規(guī)定的抽樣方案不一致����。
(3)檢驗規(guī)程的執(zhí)行不規(guī)范,實際執(zhí)行和文件規(guī)定不一致��。
如未按規(guī)定頻次實施檢測�;未按規(guī)定數(shù)量進行測試�;未按規(guī)定參數(shù)實施檢測��;未按規(guī)定進行檢測結(jié)果判定�。
8.2.1應(yīng)當(dāng)定期對檢驗儀器和設(shè)備進行校準(zhǔn)或檢定����,并予以標(biāo)識。
(4)校準(zhǔn)項目范圍不完整����,校準(zhǔn)范圍未覆蓋實際使用范圍。
如萬能拉伸試驗機校準(zhǔn)報告僅校驗力值��,未對拉伸速率與位移進行校準(zhǔn)����;
8.4.2檢驗記錄應(yīng)當(dāng)包括進貨檢驗、過程檢驗和成品檢驗的檢驗記錄�、檢驗報告或證書等。
(5)檢驗記錄信息不完整��。
如某檢驗項目作業(yè)指導(dǎo)書要求記錄摩擦力平均值和最大值�,但檢驗結(jié)果僅記錄“合格”,未提供原始測試數(shù)據(jù)�。
3��、總結(jié)與建議
醫(yī)療器械質(zhì)量體系管理是實現(xiàn)對醫(yī)療器械生產(chǎn)全過程控制��,保障醫(yī)療器械安全有效的重要手段��。通過對現(xiàn)場核查常見不符合項的匯總分析�,建議企業(yè)在日常質(zhì)量體系運行過程中��,應(yīng)確保各階段程序受控����、分工職責(zé)明確、過程完整��、內(nèi)容真實�、記錄可追溯,落實產(chǎn)品質(zhì)量主體責(zé)任����。