一���、概述
申報資料是開展臨床試驗或藥品上市申請的敲門磚���,無論創(chuàng)新藥還是仿制藥���,申報資料都是說服審評專家獲得審批的重要籌碼,因此遞交一份高質量的申報資料在藥品研發(fā)工作中至關重要���。
隨著CTD格式的推廣���,申報資料逐漸走向規(guī)范化、統(tǒng)一化���、國際化���。申報資料不僅僅是簡單的申報文件格式要求,更是QbD理念的重要體現(xiàn)���,為藥物研發(fā)提供了研發(fā)思路���,并對研究內(nèi)容和研究水平做了系統(tǒng)性技術要求���,因此���,以撰寫完美的申報資料為終點���,反過來指導研發(fā)過程是提升研發(fā)質量,加快研發(fā)速度行之有效的方法���。
二���、申報資料構成及相對應的研發(fā)內(nèi)容
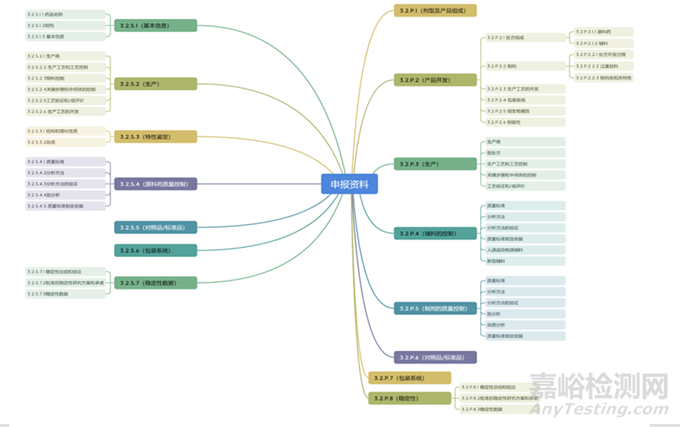
依據(jù)ICH M4,申報資料包含5個模塊���,其中模塊3主要是藥學相關研究工作���,下圖是模塊3的相關內(nèi)容。
基于模塊3構成���,談一談IND階段質量研究相關的具體工作���。
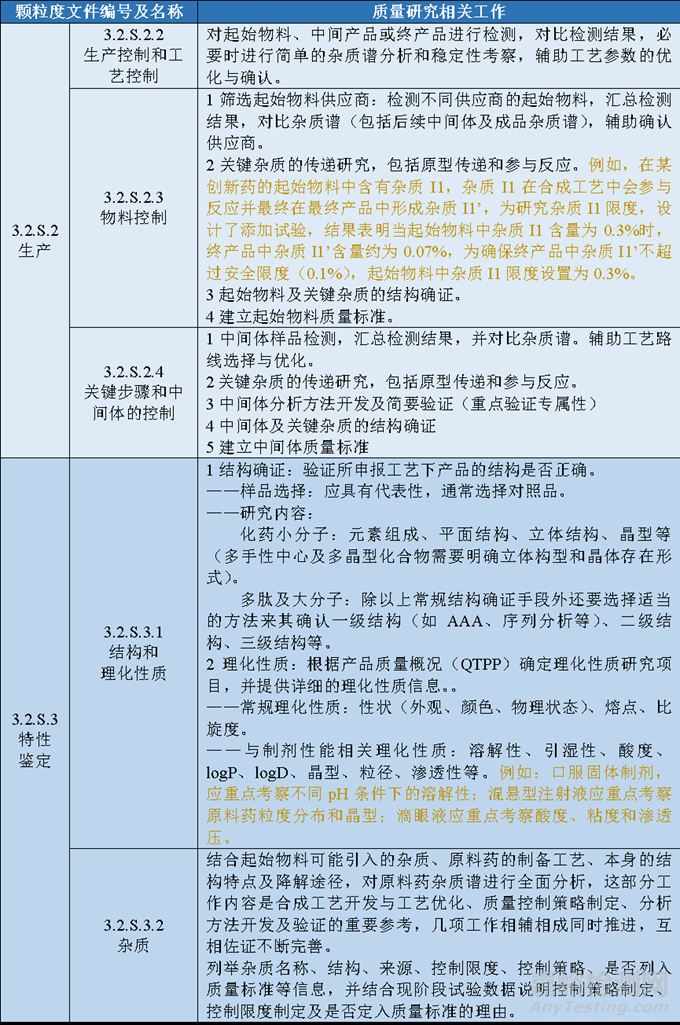
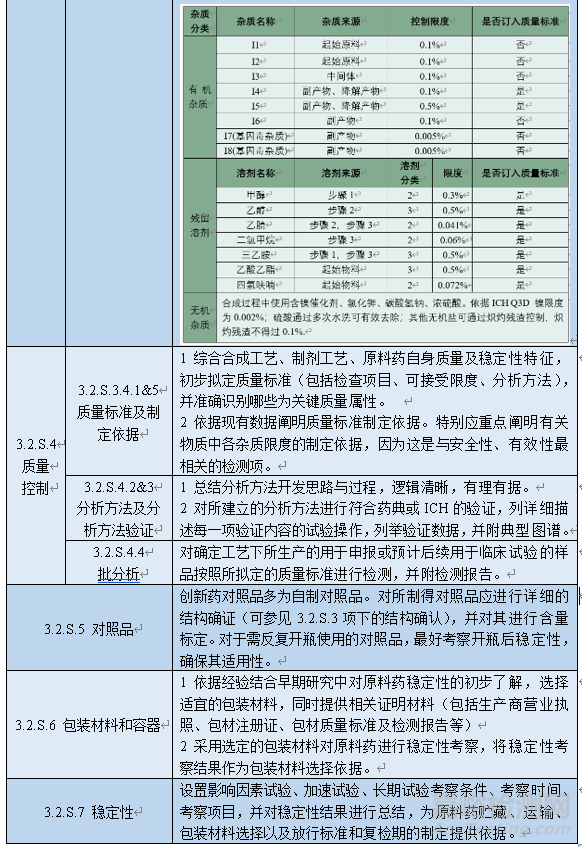
表1 原料藥申報資料及對應的研發(fā)內(nèi)容
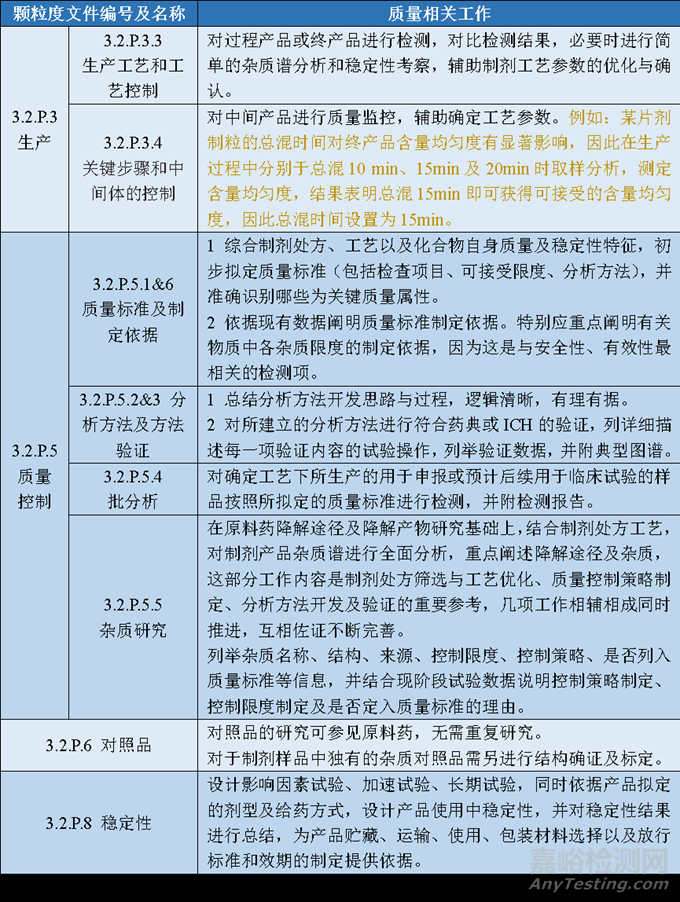
表2 制劑申報資料及對應的研發(fā)內(nèi)容
三、小結
申報資料是科研工作的高度凝練與總結���,科研工作是申報資料的事實依據(jù)���,兩者相輔相成���。在藥品研發(fā)的工作中,埋頭做實驗的同時���,也要及時抬頭站在申報資料的角度審視我們的研發(fā)思路是否符合邏輯���,試驗設計是否合理,研發(fā)內(nèi)容是否全面���,邊做邊梳理���,力爭通過我們精心設計的研發(fā)工作,借助于申報資料���,向審評老師講好自己的新藥故事���。
參考資料:
[1]《新藥I期臨床申請技術指南》
[2]《化學藥品創(chuàng)新藥I期臨床試驗申請藥學共性問題相關技術要求》
[3] 魚剛,CTD 格式申報資料撰寫的探討���,中國藥事���,2015,29(5)。
[4]王亞敏���,CTD 格式申報資料中制劑處方工藝部分解讀���,中國醫(yī)藥工業(yè)雜志,2012, 43(9)���。
[5]康建磊���,CTD格式申報資料中原料藥特性鑒定部分的解讀,新藥申報與審評技術���,2016,26(18)���。