今日頭條
信立泰心衰新藥獲批Ⅱ期臨床�����。信立泰旗下NRG-1融合抗體JK07獲國(guó)家藥監(jiān)局批準(zhǔn)開(kāi)展Ⅱ期臨床�,評(píng)估治療成人慢性心力衰竭(RENEU-HF)患者的安全性與有效性。在美國(guó)Ib期臨床中�����,單次給藥180天后,JK07(0.03mg/kg�、0.09mg/kg和0.27mg/kg)組患者LVEF(左室射血分?jǐn)?shù))平均改善7%、49%和31%�;且耐受性良好。該產(chǎn)品計(jì)劃在美國(guó)�、中國(guó)、加拿大等地開(kāi)展國(guó)際多中心臨床��。
國(guó)內(nèi)藥訊
1.百利天恒雙抗ADC獲突破性療法��。百利天恒的HER3/EGFR雙抗ADC倫康依隆妥單抗(BL-B01D1)獲CDE擬納入突破性療法���,用于既往經(jīng)PD-1/PD-L1單抗治療且經(jīng)至少兩線化療(至少一線含鉑)治療失敗的復(fù)發(fā)性或轉(zhuǎn)移性鼻咽癌(NPC)患者。在I期研究中��,BL-B01D1治療NPC達(dá)到ORR為45.8%�,疾病控制率(DCR)為100%。去年年底���,百利天恒已將該新藥全球除中國(guó)以外的開(kāi)發(fā)和商業(yè)化權(quán)益授予百時(shí)美施貴寶��。
2.禮新ADC啟動(dòng)消化道腫瘤III期臨床��。禮新醫(yī)藥靶向Claudin 18.2的抗體偶聯(lián)創(chuàng)新藥LM-302在clinicaltrials.gov網(wǎng)站上注冊(cè)了一項(xiàng)III期臨床�����,評(píng)估用于三線治療CLDN18.2陽(yáng)性(CLDN18.2+)胃或胃食管交界部腺(G/GEJ)癌的有效性與安全性���。LM-302通過(guò)特異性靶向Claudin18.2陽(yáng)性腫瘤細(xì)胞結(jié)合并內(nèi)吞�����,在腫瘤細(xì)胞溶酶體內(nèi)釋放毒素載荷�����,從而殺傷腫瘤細(xì)胞�����。該新藥已獲得FDA授予針對(duì)胰腺癌��,胃癌和膽管癌的三項(xiàng)孤兒藥資格�����。
3.依生狂犬疫苗Ⅲ期臨床積極���。依生生物宣布皮卡佐劑狂犬疫苗Ⅲ期臨床達(dá)到了主要研究終點(diǎn)��,有望實(shí)現(xiàn)WHO關(guān)于狂犬疫苗實(shí)現(xiàn)一周免疫方案取代目前一個(gè)月免疫方案的目標(biāo)���。中期數(shù)據(jù)顯示,與傳統(tǒng)狂犬疫苗相比�����,皮卡佐劑狂犬疫苗免疫原性達(dá)到了非劣效標(biāo)準(zhǔn)���;同時(shí)能在7天更短時(shí)間內(nèi)實(shí)現(xiàn)免疫響應(yīng)�����。此前,該產(chǎn)品已被FDA授予孤兒藥資格��,用于預(yù)防狂犬病病毒感染��,包括狂犬病暴露后預(yù)防(PEP)��。
4.先聲中美雙報(bào)三抗獲快速通道��。先聲藥業(yè)旗下先聲再明自主研發(fā)的GPRC5D/BCMA/CD3三抗SIM0500獲FDA授予的快速通道資格��,用于既往接受過(guò)≥3線治療(包括一種蛋白酶體抑制劑、一種免疫調(diào)節(jié)劑及一種抗CD38單克隆抗體)的復(fù)發(fā)或難治性多發(fā)性骨髓瘤患者�。在臨床前研究中,SIM0500已顯示出比GPRC5D/CD3雙抗以及BCMA/CD3雙抗有更好的腫瘤殺傷效果�,可潛在克服現(xiàn)有治療手段所導(dǎo)致的耐藥。今年1月����,CDE已受理了SIM0500的IND申請(qǐng)。
5.蘇州同宜Bi-XDC獲孤兒藥資格��。同宜醫(yī)藥第二代Bi-XDC雙配體偶聯(lián)藥物CBP-1019獲FDA孤兒藥資格�����,用于治療食管癌���。CBP-1019的設(shè)計(jì)采用雙配體FRα/TRPV6搭載新一代載藥喜樹(shù)堿衍生物����,具有顯著的抗腫瘤活性和更好的安全性��,擬開(kāi)發(fā)用于治療轉(zhuǎn)移或復(fù)發(fā)的葉酸受體和TRPV6受體雙表達(dá)的晚期惡性腫瘤患者�����。此前,該產(chǎn)品已獲FDA授予用于治療胰腺癌的孤兒藥資格���。
6.京新帕金森新藥獲批臨床����。京新藥業(yè)1類(lèi)化藥JX2105膠囊獲國(guó)家藥監(jiān)局臨床許可���,擬開(kāi)發(fā)用于治療帕金森病�����。帕金森?��。≒D)又稱(chēng)震顫麻痹,是最常見(jiàn)的活動(dòng)障礙性疾病之一���,主要因大腦分泌多巴胺的神經(jīng)細(xì)胞變形死亡,多巴胺的產(chǎn)生明顯減小而發(fā)病����。該藥物針對(duì)帕金森病患者早期癥狀進(jìn)行疾病修飾,延緩疾病進(jìn)程。
國(guó)際藥訊
1.輝瑞RSV疫苗Ⅲ期臨床積極�����。輝瑞呼吸道合胞病毒(RSV)疫苗Abrysvo(RSVpreF)用于罹患RSV相關(guān)疾病風(fēng)險(xiǎn)較高的18至59歲成年人接種的Ⅲ期臨床MONeT達(dá)到了主要終點(diǎn)��。受試者接種疫苗一個(gè)月后�,其RSV-A和RSV-B血清中和滴度較接種前增加至少四倍;受試者針對(duì)RSV-A和RSV-B中和反應(yīng)不劣于Abrysvo在Ⅲ期試驗(yàn)RENOIR中所觀察到的疫苗有效性�����;Abrysvo的安全性與已知研究一致���。輝瑞計(jì)劃盡快提交Abrysvo的補(bǔ)充上市申請(qǐng)�����。
2.創(chuàng)新CETP抑制劑降脂Ⅱ期臨床積極�����。NewAmsterdam公司CETP抑制劑obicetrapib在ACC2024年會(huì)上公布了單藥或與ezetimibe聯(lián)用治療血脂異常患者的Ⅱ期試驗(yàn)積極結(jié)果��。Obicetrapib旨在通過(guò)阻斷CETP的功能�����,在降低低密度脂蛋白膽固醇(LDL-C)的同時(shí)提高高密度脂蛋白膽固醇(HDL-C)的水平���。12周數(shù)據(jù)顯示����,obicetrapib單藥或聯(lián)合用藥均能顯著降低患者的LDL-C水平(43.5%和63.4%���,P<0.05)���、并提高了HDL-C水平(142%和136%);且Obicetrapib耐受性良好�����。
3.BMS結(jié)直腸癌抑制劑最新臨床數(shù)據(jù)積極��。百時(shí)美施貴寶KRAS G12C抑制劑Krazati(adagrasib)在AACR2024年會(huì)上公布了用于治療KRAS G12C突變���、晚期或轉(zhuǎn)移性結(jié)直腸癌(CRC)經(jīng)治患者的I/II期KRYSTAL-1研究積極結(jié)果。數(shù)據(jù)顯示�,Krazati聯(lián)合西妥昔單抗的客觀緩解率達(dá)到34%,中位PFS為6.9個(gè)月,中位OS為15.9個(gè)月�,85%的患者病情得到控制。今年2月��,Krazati相關(guān)sNDA已獲得FDA受理��,并同時(shí)獲得了優(yōu)先審評(píng)資格�����,PDUFA日期為6月21日�����。
4.BioNTech公司癌癥疫苗長(zhǎng)期療效積極�。BioNTech公司可以編碼數(shù)十種新抗原的癌癥疫苗autogene cevumeran(BNT122)在AACR2024年會(huì)上公布了其用于胰腺導(dǎo)管腺癌術(shù)后治療的Ⅰ期臨床3年隨訪結(jié)果。數(shù)據(jù)顯示����,疫苗接種產(chǎn)生T細(xì)胞免疫應(yīng)答的患者中位RFS(無(wú)復(fù)發(fā)生存期)尚未達(dá)到(HR=0.14;95% CI:0.03-0.6���;P=0.007)��,而無(wú)應(yīng)答者中位RFS為13.4個(gè)月�����。此外����,與沒(méi)有發(fā)生復(fù)發(fā)的應(yīng)答者相比,2例復(fù)發(fā)的應(yīng)答者其體內(nèi)疫苗誘導(dǎo)的T細(xì)胞總量較少�。
5.Seaport公司融資開(kāi)發(fā)抗焦慮新藥。Seaport公司宣布完成了1億美元超額認(rèn)購(gòu)的A輪融資���,以用于推進(jìn)其基于淋巴系統(tǒng)遞送的專(zhuān)有Glyph技術(shù)平臺(tái)驅(qū)動(dòng)的神經(jīng)精神疾病創(chuàng)新口服藥開(kāi)發(fā)���,并加速該平臺(tái)候選藥物(SPT-300、SPT-320和SPT-348)的開(kāi)發(fā)進(jìn)程��。SPT-300是一款別孕烷醇酮的口服前藥���,正在Ⅱa期臨床中評(píng)估用于治療焦慮抑郁的潛力�����。SPT-320是一款新型agomelatine前藥����,擬開(kāi)發(fā)用于治療廣泛性焦慮障礙。
6.Nvelop公司完成種子輪融資��。劉如謙聯(lián)合創(chuàng)建的Nvelop Therapeutics日前已完成1億美元的種子輪融資���,以用于推進(jìn)其基于兩種經(jīng)過(guò)體內(nèi)驗(yàn)證的可編程非病毒載體遞送平臺(tái),開(kāi)發(fā)下一代基因藥物�����。此輪融資來(lái)自Newpath Partners���、Atlas venture���、F-Prime capital和5AM Ventures等風(fēng)投公司。劉如謙團(tuán)隊(duì)的第四代eVLP(無(wú)DNA組分的工程化類(lèi)病毒顆粒)���,可以有效包裝和遞送堿基編輯器和CRISPR-Cas9的核糖核蛋白(RNP)形式�,更具安全性?xún)?yōu)勢(shì)����。
醫(yī)藥熱點(diǎn)
1.小林制藥問(wèn)題保健品調(diào)查結(jié)果公布。日本腎臟學(xué)會(huì)9日公布小林制藥“紅曲風(fēng)波”調(diào)查結(jié)果����。日本腎臟學(xué)會(huì)稱(chēng)�����,95例患者中��,大部分被認(rèn)為患有范可尼綜合征��,即腎小管功能障礙疾病���。這些患者的腎小管功能出現(xiàn)異常,無(wú)法回收多種人體需要的物質(zhì)���,而是將這些物質(zhì)排出體外�����。截至4月9日��,服用小林制藥含紅曲成分問(wèn)題保健品的消費(fèi)者中����,已有212人住院治療,1224人赴醫(yī)就診���,相關(guān)咨詢(xún)達(dá)53000件��。
2.北京大學(xué)國(guó)際醫(yī)院成立特色老年醫(yī)學(xué)中心���。日前�����,首都醫(yī)科大學(xué)宣武醫(yī)院國(guó)家老年疾病臨床醫(yī)學(xué)研究中心北京大學(xué)國(guó)際醫(yī)院分中心正式掛牌���,雙方將共同推動(dòng)北京大學(xué)國(guó)際醫(yī)院特色老年醫(yī)學(xué)中心建設(shè)����。中心將依托宣武醫(yī)院在老年疾病臨床診療技術(shù)方面的優(yōu)勢(shì)�,圍繞老年健康和常見(jiàn)慢性疾病,以老年人功能綜合評(píng)估和疾病早篩為重點(diǎn)�,針對(duì)存在功能障礙和慢病風(fēng)險(xiǎn)的老年人,提供多學(xué)科融合��、個(gè)性化健康指導(dǎo)和醫(yī)療服務(wù)��,構(gòu)建預(yù)防�、治療�、康復(fù)一體化綜合防治服務(wù)新模式�����。
3.血檢診斷早期胰腺癌準(zhǔn)確率超97%���。美國(guó)希望之城癌癥研究中心科學(xué)家日前透露�,他們開(kāi)發(fā)出一種血液測(cè)試方法����,診斷早期胰腺癌的準(zhǔn)確率超過(guò)97%。他們將在圣地亞哥舉行的美國(guó)癌癥研究協(xié)會(huì)會(huì)議上公布試驗(yàn)結(jié)果��。這種血檢方法旨在找出胰腺癌脫落的8個(gè)小RNA片段和8個(gè)較大DNA標(biāo)記����,這些物質(zhì)共同構(gòu)成了胰腺癌的基因特征。據(jù)悉�����,早期胰腺癌患者的5年生存率為44%�,但如果癌癥在身體其他部位擴(kuò)散后才被診斷出來(lái),這一比例將降至3%。
評(píng)審動(dòng)態(tài)
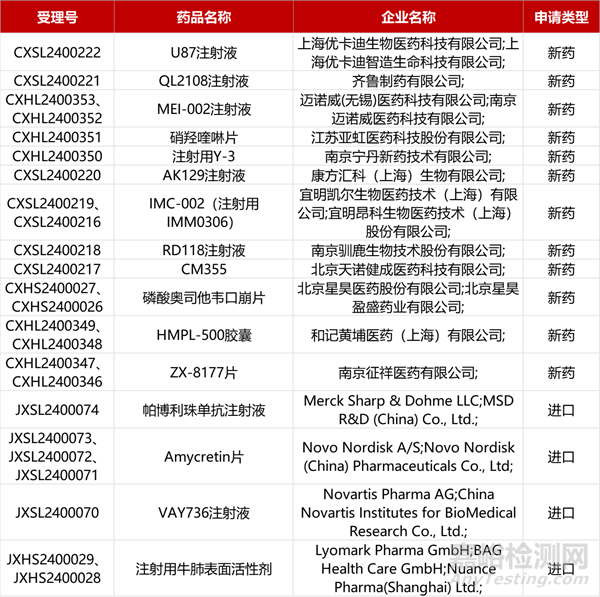
1. CDE新藥受理情況(04月10日)
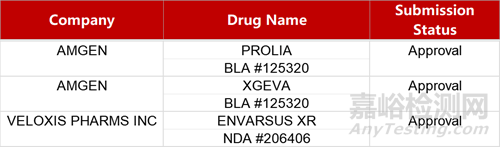
2. FDA新藥獲批情況(北美04月09日)