溶出反應(yīng)的是活性成分在體外溶出介質(zhì)中溶出的速率和程度���,生物利用度反應(yīng)的是活性成分在體內(nèi)到達(dá)作用部位的速度和程度����。
利用藥物的體外溶出數(shù)據(jù)預(yù)測(cè)其在體內(nèi)的吸收情況����,也就是使用簡(jiǎn)單的溶出條件預(yù)測(cè)復(fù)雜的人體胃腸道系統(tǒng)的生理狀態(tài)(保證自制制劑和參比制劑的體外溶出和體內(nèi)生物利用度高度相似)����,首先需要得到有區(qū)分力的溶出條件�����,通過(guò)參比制劑有區(qū)分力的溶出數(shù)據(jù)結(jié)合預(yù)BE數(shù)據(jù)����,有的放矢的調(diào)整自制制劑的處方工藝,提高自制制劑與參比制劑的體內(nèi)外擬合度�����,終結(jié)溶出����、預(yù)BE之間的反復(fù)拉扯。
1��、溶出的簡(jiǎn)單性
1.1溶出的定義
溶出度系指活性藥物從片劑����、膠囊劑或顆粒劑等普通制劑在規(guī)定條件下溶出的速率和程度,在緩釋制劑�、控釋制劑����、腸溶制劑及透皮貼劑等制劑中也稱釋放度���。
1.2影響溶出數(shù)據(jù)的溶出條件
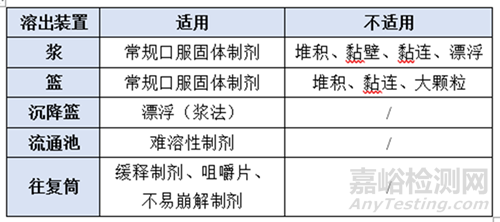
(1)溶出裝置
根據(jù)制劑類型�����、試驗(yàn)現(xiàn)象選擇適宜的溶出裝置,常用的溶出裝置包括槳��、沉降籃��、籃��、往復(fù)筒�����、流通池等���。
(2)溶出介質(zhì)
①溶出介質(zhì):至少在三種溶出介質(zhì)(0.1mol/L鹽酸或 pH1.2 鹽酸����、pH4.5緩沖液、pH6.8緩沖液)����,若標(biāo)準(zhǔn)介質(zhì)與之不同,則增加標(biāo)準(zhǔn)介質(zhì)����。
②pH值:選擇適當(dāng)?shù)木彌_鹽使溶出介質(zhì)在溶出過(guò)程中能夠維持相對(duì)穩(wěn)定的 pH 值。
③表面活性劑:從低到高逐漸增加至滿足漏槽條件�,濃度不超過(guò) 1%。
④有機(jī)溶劑:不使用或使用低濃度有機(jī)溶劑緩慢增至高濃度����。
⑤介質(zhì)體積及溫度:溶出介質(zhì)的體積通常采用 900ml 或更少,溫度為 37±0.5℃����。
⑥攪拌速度:根據(jù)溶出數(shù)據(jù)調(diào)整攪拌速度,如籃法50∼100轉(zhuǎn)/分鐘或槳法50∼75轉(zhuǎn)/分鐘��。
(3)取樣
①取樣時(shí)間:普通口服固體制劑的取樣時(shí)間一般為 5 和/或 10���、15 和/或 20�����、30���、45����、60�、90、120 分鐘���,此后每隔 1 小時(shí)�,再根據(jù)研究數(shù)據(jù)調(diào)整����。連續(xù)兩點(diǎn)溶出量均達(dá) 85%以上����,且差值在 5%以內(nèi),停止取樣��。15 分鐘前的時(shí)間點(diǎn)可以根據(jù)溶出數(shù)據(jù)刪減��,例如 5 分鐘與 10 分鐘的 RSD 均大于 20%�����,則可刪除;但高溶性藥物第一個(gè)時(shí)間點(diǎn)不得晚于 10 分鐘��。
緩釋制劑的取樣時(shí)間一般為 0.5 和/或 1�����、2����、4 小時(shí),此后每隔 2 小時(shí)���,到24 小時(shí)結(jié)束���,再根據(jù)研究數(shù)據(jù)調(diào)整取樣時(shí)間。連續(xù)兩點(diǎn)溶出量均達(dá) 85%以上�,且差值在 5%以內(nèi),停止取樣�。
②取樣方法:需驗(yàn)證取樣濾膜種類,評(píng)估是否需要補(bǔ)液等��。
1.3影響溶出數(shù)據(jù)的制劑因素
(1)關(guān)鍵物料屬性
活性物質(zhì)的的關(guān)鍵物料屬性,如粒徑��、晶型等��,直接影響制劑的溶出速度和程度����。
(2)處方組成
功能性輔料如崩解劑、粘合劑���、潤(rùn)濕劑的種類及用量等�����,直接影響制劑的溶出速度和程度��。
(3)關(guān)鍵工藝參數(shù)
崩解劑的內(nèi)外加�、粘合劑的加入量及加入速度��、制粒的轉(zhuǎn)速�、顆粒堆密度���、粒徑分布����、片的硬度等,不同的制劑工藝可能會(huì)崩解出不同大小和均勻性的顆粒�����,顯示出不同的溶出速度和程度�。
1.4有區(qū)分力的溶出參數(shù)
(1)溶出現(xiàn)象
仔細(xì)觀察試驗(yàn)現(xiàn)象,聯(lián)系現(xiàn)象與溶出數(shù)據(jù)���。需要觀察的現(xiàn)象包括但不限于以下:
①包衣或膠囊破裂的狀態(tài)�����;
②是否完全崩解�,記錄崩解時(shí)間����;
③顆粒分布是否均勻;
④顆粒是否堆積����;
⑤制劑在溶出杯中的位置是否固定;
⑥是否有黏連�����、粘壁,膠囊包裹顆粒等情況�;
自制制劑的溶出現(xiàn)象應(yīng)與參比制劑無(wú)顯著區(qū)別,若溶出現(xiàn)象差別較大需評(píng)估其與溶出數(shù)據(jù)的關(guān)系��。
(2)溶出數(shù)據(jù)
快速溶出與極快速溶出的制劑除外�,使制劑在45min至120min溶出達(dá)到85%(前面取樣點(diǎn)的溶出應(yīng)較均勻不宜溶出太快)最具區(qū)分性,溶出太快和太慢可區(qū)分性都不強(qiáng)��。
(3)篩選有區(qū)分力的溶出參數(shù)
制劑因素:
①適當(dāng)改變活性物質(zhì)的關(guān)鍵物料屬性如粒徑��、晶型等����;
②適當(dāng)改變處方組成如功能性輔料崩解劑、粘合劑�、潤(rùn)濕劑的種類及用量等;
③適當(dāng)改變關(guān)鍵工藝參數(shù)如崩解劑的內(nèi)外加���、粘合劑的加入量及加入速度���、制粒的轉(zhuǎn)速����、顆粒堆密度�、粒徑分布����、片的硬度等;
溶出因素:
①:降低轉(zhuǎn)速(如:漿法:75s降至50s��,籃法:100s降至75s)��;
②:使用低濃度表面活性劑緩慢增至高濃度(0.01%�����、0.02%��、0.05%...)
③:不使用或使用低濃度有機(jī)溶劑緩慢增至高濃度���;
④:警惕使用高溶解度的溶出介質(zhì)�����,需跟常規(guī)的溶出介質(zhì)對(duì)比��;
⑤:使用多條介質(zhì)進(jìn)行擬合�,不限于參比制劑公開的溶出數(shù)據(jù);
有區(qū)分力的溶出是可以反應(yīng)出關(guān)鍵物料屬性�、處方組成、關(guān)鍵工藝參數(shù)變化的����,根據(jù)有區(qū)分力的溶出數(shù)據(jù)調(diào)整自制制劑的處方工藝,做到有的放矢����,抓住重點(diǎn)溶出介質(zhì),提高與參比制劑溶出曲線的相似性��。
2����、BE的復(fù)雜性
(1)生物等效性的定義
生物等效性系指在合理的研究方案中,藥學(xué)等效制劑或藥學(xué)可替代制劑在相同條件下�、相同劑量給藥,活性成分或活性部分到達(dá)作用部位的速度和程度沒(méi)有顯著差別�����。
(2)生物利用度的定義
從藥代動(dòng)力學(xué)的角度來(lái)看�����,生物利用度有兩種類型:絕對(duì)生物利用度和相對(duì)生物利用度。
①絕對(duì)生物利用度
絕對(duì)生物利用度是指血管外給藥劑型與靜脈給藥(IV)劑型系統(tǒng)吸收的比值����。
②相對(duì)生物利用度
相對(duì)生物利用度是指一種制劑(如口服溶液)與另一種制劑(如口服膠囊)吸收速度與程度的比值��。相對(duì)生物利用度也可以是比較一種藥品在兩種不同給藥途徑下(如肌內(nèi)注射和皮下注射)吸收的速度和程度���。
(3)藥動(dòng)學(xué)參數(shù)評(píng)價(jià)生物等效性
可以采用生物利用度中的藥動(dòng)學(xué)參數(shù)AUC���、Cmax等指標(biāo)評(píng)價(jià)制劑間是否具有生物等效性。
①平均生物等效性
采用平均生物等效性(Average bioequivalence, ABE)方法����,等效標(biāo)準(zhǔn)為受試制劑與參比制劑的主要藥動(dòng)學(xué)參數(shù)(AUC和Cmax)幾何均值比的90%置信區(qū)間在80.00%~125.00%范圍內(nèi)。
②參比制劑標(biāo)度的平均生物等效性
對(duì)于安全性較好����、治療窗較寬的高變異藥物,在充分科學(xué)論證的基礎(chǔ)上和保證公眾用藥安全����、有效的前提下,通過(guò)部分重復(fù)或完全重復(fù)交叉設(shè)計(jì)���,根據(jù)參比制劑的個(gè)體內(nèi)變異�,采用參比制劑標(biāo)度的平均生物等效性(Reference-scaled average bioequivalence, RSABE)方法,將等效性判定標(biāo)準(zhǔn)在80.00%~125.00%的基礎(chǔ)上適當(dāng)放寬��,可減少不必要的人群暴露����,達(dá)到科學(xué)評(píng)價(jià)不同制劑是否生物等效的目的。
(4)影響口服藥物生物利用度的因素
口服藥物生物利用度取決于多種因素的共同作用����,包括藥物制劑的理化性質(zhì),以及胃腸道系統(tǒng)的生理狀態(tài)�。
①藥物制劑的理化性質(zhì)
1)活性物質(zhì)的關(guān)鍵物料屬性如粒徑、晶型等����;
2)處方組成如功能性輔料崩解劑、粘合劑����、潤(rùn)濕劑的種類及用量等;
3)關(guān)鍵工藝參數(shù)如崩解劑的內(nèi)外加��、粘合劑的加入量及加入速度�����、制粒的轉(zhuǎn)速、顆粒堆密度�、粒徑分布、片的硬度等�;
②胃腸道系統(tǒng)的生理狀態(tài)
1)藥物活性成分在體內(nèi)的藥物制劑中釋放出來(lái)的能力��;
2)胃腸道中藥物的吸收部位�;
3)藥物制劑和釋放出來(lái)的藥物在吸收部位的停留時(shí)間;
4)胃腸道粘膜吸收藥物的能力���;
5)胃排空和腸蠕動(dòng)的對(duì)藥物制劑位置和藥物吸收的影響��;
固體制劑仿制藥研發(fā)重點(diǎn)在于關(guān)注自制制劑藥物制劑的理化性質(zhì)與參比制劑一致����,關(guān)注藥物制劑在胃腸道中的吸收部位和胃腸道粘膜的吸收能力�,選擇合適的標(biāo)準(zhǔn)介質(zhì),根據(jù)有區(qū)分力的溶出數(shù)據(jù)和預(yù)BE數(shù)據(jù)調(diào)整自制制劑的處方工藝���,做到有的放矢���,提高自制制劑與參比制劑溶出曲線的相似性��,進(jìn)而提高正式BE的通過(guò)率���。
3、溶出與BE的關(guān)聯(lián)性
溶出反應(yīng)的是活性成分在體外溶出介質(zhì)中溶出的速率和程度��,溶出的速率和程度與藥物制劑的理化性質(zhì)和溶出條件有關(guān)����,生物利用度反應(yīng)的是活性成分在體內(nèi)到達(dá)作用部位的速度和程度,生物利用度與藥物制劑的理化性質(zhì)和復(fù)雜的人體胃腸道系統(tǒng)的生理狀態(tài)有關(guān)����。
利用藥物體外溶出數(shù)據(jù)預(yù)測(cè)藥物在體內(nèi)吸收情況,也就是使用簡(jiǎn)單的溶出條件預(yù)測(cè)復(fù)雜的人體胃腸道系統(tǒng)的生理狀態(tài)(保證自制制劑和參比制劑的體外溶出和體內(nèi)生物利用度高度相似)����。
溶出一致BE一致的前提在于自制制劑的理化性質(zhì)與參比制劑一致����,關(guān)鍵在于篩選出有區(qū)分力的溶出條件(保證自制制劑和參比制劑的體外溶出和體內(nèi)生物利用度高度相似),通過(guò)有區(qū)分力的參比制劑溶出數(shù)據(jù)調(diào)整自制制劑的處方工藝���,提高自制制劑與參比制劑溶出曲線的相似性���,再結(jié)合參比制劑的預(yù)BE數(shù)據(jù),有的放矢的調(diào)整自制制劑的處方工藝��,提高自制制劑與參比制劑預(yù)BE數(shù)據(jù)的相似性�����,進(jìn)而提高正式BE的通過(guò)率,終結(jié)溶出�、預(yù)BE之間的反復(fù)拉扯���。
4���、實(shí)例解析
(1)預(yù)BE實(shí)驗(yàn)設(shè)計(jì)
某仿制藥XXX片,為薄膜包衣片����,參比制劑資料顯示個(gè)體內(nèi)變異系數(shù)<0.3����,該制劑為低變異短半衰期品種�,該制劑預(yù)BE采用兩制劑����、單次給藥����、交叉試驗(yàn)設(shè)計(jì),餐后8例���。
(2)溶出與預(yù)BE數(shù)據(jù)
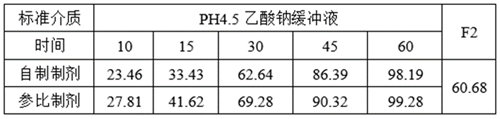
①溶出數(shù)據(jù)
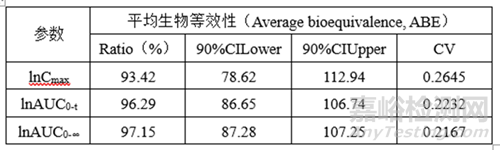
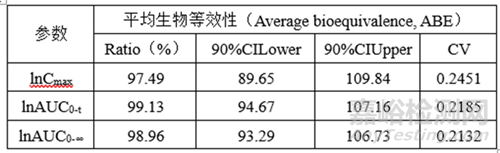
②預(yù)BE數(shù)據(jù)
(3)預(yù)BE數(shù)據(jù)分析
lnCmax的90%CILower78.62低于80%��,lnCmax的T/R的Ratio為93.42%�,自制制劑體外溶出慢于參比制劑,推測(cè)這可能是導(dǎo)致自制制劑體內(nèi)Cmax低于參比制劑的主要原因�。
lnCmax90%CI置信區(qū)間較寬(78.62%-112.94)�����,可以通過(guò)增加正式BE樣本量解決這一問(wèn)題���。
(4)完善BE實(shí)驗(yàn)設(shè)計(jì)
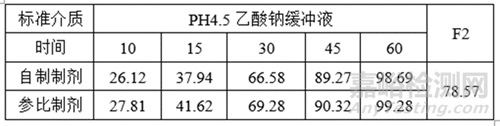
①調(diào)整自制制劑處方工藝����,提高自制制劑體外溶出速率約5%�;
②增加正式BE樣本量至24例����;
(5)BE實(shí)驗(yàn)預(yù)分析
①溶出數(shù)據(jù)
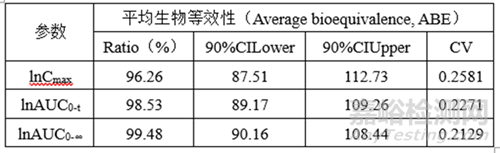
②計(jì)算機(jī)模擬BE數(shù)據(jù)
(6)正式BE數(shù)據(jù)
(7)小結(jié)
①研發(fā)前期需開發(fā)出具有區(qū)分力的溶出參數(shù)��;
②根據(jù)具有區(qū)分力的參比制劑溶出數(shù)據(jù)調(diào)整自制制劑處方工藝,提高自制制劑與參比制劑的體外溶出擬合度����;
③獲得預(yù)BE數(shù)據(jù)���,根據(jù)預(yù)BE數(shù)據(jù)調(diào)整自制制劑處方工藝,通過(guò)提高自制制劑與參比制劑的體外溶出擬合度進(jìn)而提高自制制劑與參比制劑的體內(nèi)擬合度���;
④根據(jù)預(yù)BE數(shù)據(jù)調(diào)整試驗(yàn)方案���,如增加樣本量,降低偶然性風(fēng)險(xiǎn)�����,進(jìn)而提高正式BE的通過(guò)率����;
5、總結(jié):只在此山中�,云深不知處
終結(jié)溶出����、預(yù)BE之間的反復(fù)拉扯的關(guān)鍵在于首先篩選出有區(qū)分力的溶出參數(shù),提高自制制劑與參比制劑的體外溶出擬合度��,其次通過(guò)對(duì)藥物制劑體內(nèi)藥動(dòng)學(xué)的理解以及有限次數(shù)的預(yù)BE數(shù)據(jù)�����,提高自制制劑與參比制劑的體內(nèi)擬合度����,進(jìn)而提高正式BE的通過(guò)率。
6����、參考文獻(xiàn)
1.國(guó)家食品藥品監(jiān)督管理總局《普通口服固體制劑溶出曲線測(cè)定與比較指導(dǎo)原則》(2016 年 3 月).
2.國(guó)家食品藥品監(jiān)督管理總局《普通口服固體制劑溶出度試驗(yàn)技術(shù)指導(dǎo)原則》(2015 年 2 月).
3.國(guó)家食品藥品監(jiān)督管理總局《以藥動(dòng)學(xué)參數(shù)為終點(diǎn)評(píng)價(jià)指標(biāo)的化學(xué)藥物仿制藥人體生物等效性研究技術(shù)指導(dǎo)原則》(2016 年 3 月).
4.國(guó)家食品藥品監(jiān)督管理總局《人體生物等效性試驗(yàn)豁免指導(dǎo)原則》(2016 年 5 月).
5.國(guó)家食品藥品監(jiān)督管理總局《已上市化學(xué)藥品藥學(xué)變更研究技術(shù)指導(dǎo)原則(試行)》溶出曲線研究的問(wèn)答(2022 年11 月).
6. 《固體口服制劑的研發(fā)-藥學(xué)理論與實(shí)踐》邱怡虹、陳義生�����、