摘 要 / Abstract
近年來,mRNA修飾技術(shù)及遞送技術(shù)的發(fā)展很大程度上解決了mRNA疫苗穩(wěn)定性差及體內(nèi)遞送低效的問題��?;谥圃旌唵巍⒀挟a(chǎn)速度快�,安全性高、免疫原性好等優(yōu)勢�,mRNA疫苗在抗擊COVID-19大流行過程中發(fā)揮了重要作用。截至目前���,已有多個針對新冠病毒(SARS-CoV-2)的mRNA疫苗獲批上市或被授權(quán)緊急使用�����。此外�,mRNA疫苗在其他傳染病�、腫瘤免疫等領(lǐng)域的研發(fā)及產(chǎn)業(yè)化也成為近期研究熱點�。本文總結(jié)了mRNA疫苗研發(fā)管線以及供應(yīng)鏈方面的發(fā)展?fàn)顩r����,期望為后續(xù)mRNA疫苗開發(fā)和產(chǎn)業(yè)化提供參考。
In recent years, significant progress in mRNA modification and delivery technologies has largely solved the issues of poor stability and inefficient in vivo delivery of mRNA vaccines. Leveraging advantages such as simplicity in manufacturing,rapid research and production, high safety, and strong immunogenicity, mRNA vaccines have played a pivotal role in the fight against the COVID-19 pandemic. So far, multiple mRNA vaccines against the SARS-COV-2 have been approved for marketing or authorized for emergency use. In addition, the research and industrialization of mRNA vaccines in areas such as other infectious diseases, tumor immunology have also become the focus of recent research. This paper provides an overview of the development status of mRNA vaccine research pipelines and supply chains, with the aim of offering references for the subsequent development and industrialization of mRNA vaccines.
關(guān) 鍵 詞 / Key words
mRNA 疫苗�����;mRNA 疫苗研產(chǎn)��;大規(guī)模生產(chǎn)�����;供應(yīng)鏈��;產(chǎn)業(yè)化
mRNA vaccine; mRNA vaccine research and production; commercial scale manufacture; supply chain; commercialization
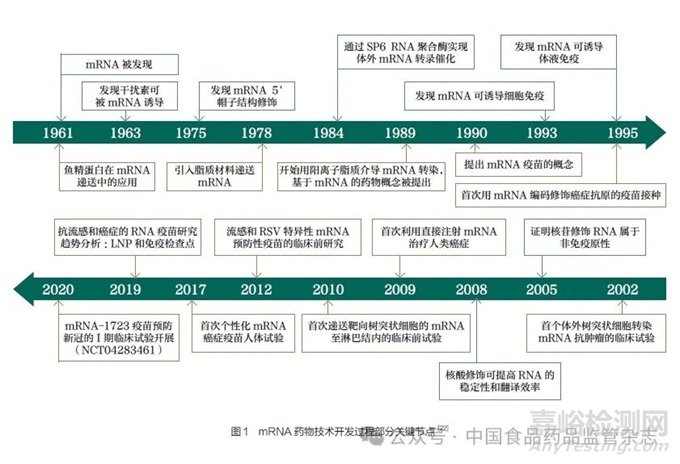
1989年�,有研究者發(fā)現(xiàn)在脂質(zhì)包裹下mRNA可以在真核細(xì)胞內(nèi)轉(zhuǎn)染和表達(dá),mRNA作為藥物的概念被提出[1]����。1990年����,研究者成功完成了體外轉(zhuǎn)錄mRNA在小鼠體內(nèi)的表達(dá)����,證明了mRNA作為藥物的可行性[2]����。1995年,又有研究者用小鼠模型開發(fā)了第一種編碼癌胚抗原(CEA)的mRNA腫瘤疫苗�����,證明mRNA疫苗在腫瘤治療領(lǐng)域具有較好前景[3]�����。然而���,由于mRNA穩(wěn)定性差�����、先天免疫原性高�、體內(nèi)遞送效率低下���,mRNA藥物開發(fā)在很長一段時間內(nèi)受到限制[4]��。近年來���,mRNA修飾技術(shù)和遞送技術(shù)不斷進(jìn)步�。2005年有研究者發(fā)現(xiàn)使用修飾尿苷合成的mRNA可以避免被免疫系統(tǒng)識別和降解���,有效解決了mRNA在體內(nèi)的不穩(wěn)定性和高免疫原性問題�����;非翻譯區(qū)的優(yōu)化和poly(A)尾優(yōu)化技術(shù)提高了mRNA的穩(wěn)定性和翻譯效率����;純化方法的改進(jìn)有效去除了雙鏈RNA雜質(zhì)�����,從而減少先天免疫的非特異性激活�;通過將mRNA配制成納米顆粒,如脂質(zhì)納米顆粒(LNP)�����、聚合物納米顆粒和脂質(zhì)-聚合物雜化納米顆粒���,mRNA技術(shù)逐漸成為傳染病和腫瘤防治領(lǐng)域的焦點[4-17]�。2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎授予了科學(xué)家Katalin Karikó和Drew Weissman����,以表彰他們在核苷堿基修飾方面的發(fā)現(xiàn),推動了mRNA疫苗在抗擊COVID-19大流行過程中發(fā)揮巨大作用���;同時��,mRNA疫苗也在此期間取得了快速發(fā)展[12,18-21]����。mRNA藥物技術(shù)開發(fā)過程中的部分關(guān)鍵節(jié)點見圖1[22]���。
1�、mRNA疫苗簡介
1.1 mRNA疫苗的作用機(jī)制
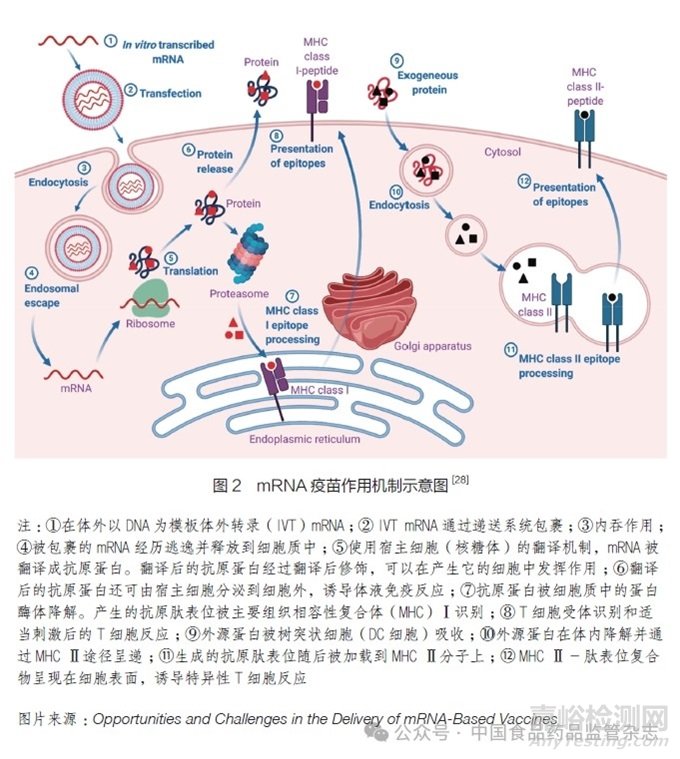
如圖2所示�����,接種mRNA疫苗后�,體外轉(zhuǎn)錄(IVT)mRNA通過遞送載體進(jìn)入靶細(xì)胞的細(xì)胞質(zhì)中,通過靶細(xì)胞的表達(dá)系統(tǒng)合成具有特定藥理活性的抗原蛋白,翻譯的抗原蛋白被蛋白酶降解為抗原肽�,然后被轉(zhuǎn)運(yùn)到內(nèi)質(zhì)網(wǎng)中,并通過主要組織相容性復(fù)合體(MHC)Ⅰ途徑呈遞給CD8+T細(xì)胞����,以誘導(dǎo)細(xì)胞介導(dǎo)的免疫反應(yīng)。部分抗原蛋白由宿主細(xì)胞分泌并被附近的抗原呈遞細(xì)胞(APC)吸收�,通過MHCⅡ途徑呈遞給抗原特異性CD4+T細(xì)胞,分泌細(xì)胞因子引發(fā)細(xì)胞免疫反應(yīng)���,并激活B細(xì)胞產(chǎn)生抗體��?���?乖鞍滓部梢酝ㄟ^一種交叉呈遞的機(jī)制被處理�����,并通過MHCⅠ途徑激活抗原特異性CD8+T細(xì)胞�����,從而殺死腫瘤細(xì)胞或病毒感染的細(xì)胞���,以達(dá)到預(yù)防和治療疾病的目的[16,23-27]���。
1.2 mRNA疫苗的結(jié)構(gòu)
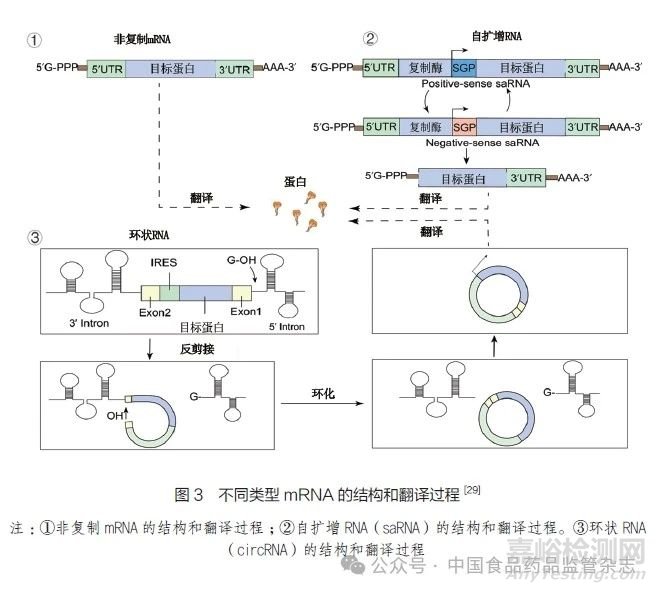
目前用于疫苗研究的mRNA主要有3種類型:非復(fù)制mRNA�����、自擴(kuò)增RNA(sa RNA)和環(huán)狀RNA(circ RNA)。其中���,非復(fù)制mRNA最為常用�。環(huán)狀mRNA模仿了病毒感染過程����,其復(fù)制機(jī)制可以大幅降低疫苗劑量;環(huán)狀mRNA的閉環(huán)結(jié)構(gòu)保護(hù)其免受核酸外切酶降解�����,穩(wěn)定性更好�。mRNA含有幾個必要的結(jié)構(gòu),包括帽子結(jié)構(gòu)(Cap)�����、5'非翻譯區(qū)(5'UTR)、編碼抗原蛋白的開放閱讀框(ORF)���、3'非翻譯區(qū)(3'UTR)和poly(A)尾結(jié)構(gòu)��。自擴(kuò)增mRNA疫苗的開放閱讀框還包括編碼細(xì)胞內(nèi)RNA擴(kuò)增所需的非結(jié)構(gòu)蛋白�����,環(huán)狀mRNA則是一個沒有5'UTR和3'UTR的閉環(huán)結(jié)構(gòu)[29]���。不同類型mRNA的結(jié)構(gòu)和翻譯過程見圖3。
如前文所述����,mRNA疫苗必須被輸送到人體的靶細(xì)胞才能引發(fā)免疫反應(yīng),但是mRNA進(jìn)入人體后很容易被核酸酶降解����,且難以透過細(xì)胞膜屏障到達(dá)細(xì)胞質(zhì),因此mRNA疫苗還需要合適的遞送載體�����。另外�����,mRNA疫苗通常需要冷凍儲存,需要冷凍保護(hù)劑保護(hù)遞送系統(tǒng)不被破壞�����。因此���,mRNA疫苗的主要組成部分包括編碼抗原蛋白的mRNA,用于包埋�、遞送mRNA的脂質(zhì)載體(最常用的是LNP),緩沖溶液(如PBS buffer或Tris buffer)��,冷凍保護(hù)劑(如蔗糖)�。以新冠mRNA疫苗為例,輝瑞(Pfizer)與Bio NTech公司合作開發(fā)的BNT162b2以及莫德納公司開發(fā)的mRNA-1273這兩款疫苗的結(jié)構(gòu)組成見圖4�。
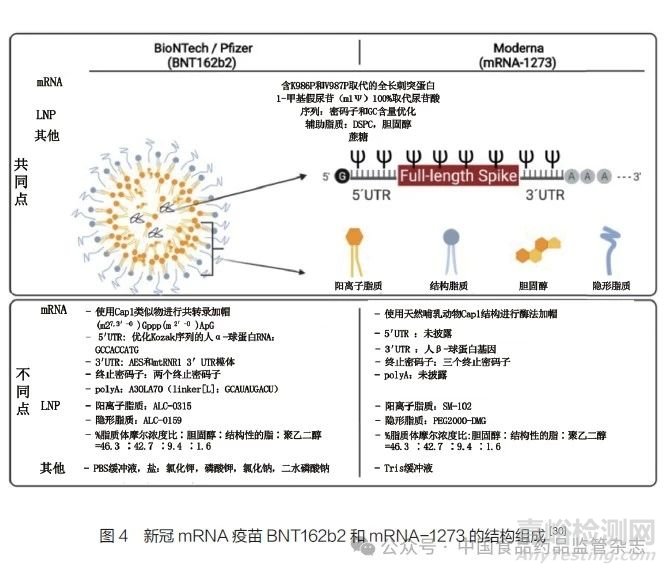
其中,mRNA制劑依靠陽離子脂質(zhì)在低p H環(huán)境下有效地復(fù)合帶負(fù)電荷的mRNA�,形成LNP的核心[31-33]。磷脂在LNP中發(fā)揮結(jié)構(gòu)作用��,有助于脂質(zhì)雙分子層的形成和破壞��,以促進(jìn)內(nèi)體逃逸[34-35]�����。膽固醇在LNP中起穩(wěn)定作用,在細(xì)胞轉(zhuǎn)染中至關(guān)重要[36-37]��。聚乙二醇(PEG)脂質(zhì)在LNP表面充當(dāng)屏障�����,在空間上穩(wěn)定LNP并減少與蛋白的非特異性結(jié)合[38]��。
1.3 mRNA疫苗生產(chǎn)方式
基于目的mRNA的特性及臨床應(yīng)用�,其合成方式主要有化學(xué)合成、重組生產(chǎn)����、酶法合成等,其中體外轉(zhuǎn)錄(酶法)被認(rèn)為是大規(guī)模生產(chǎn)mRNA金標(biāo)準(zhǔn)[39]���。mRNA疫苗制備流程如圖5所示��,在上游���,疫苗靶序列被導(dǎo)入質(zhì)粒中,DNA模板被生成��、擴(kuò)增、純化和線性化�����;在中游����,使用T7RNA聚合酶在體外轉(zhuǎn)錄反應(yīng)后合成RNA,并使用5'帽類似物共轉(zhuǎn)錄(或轉(zhuǎn)錄后加帽)實現(xiàn)RNA的5'加帽����,再通過純化得到高純度的mRNA;在下游�,將獲得的高純度mRNA配制在LNP中��,并裝入小瓶或容器中�����,用于大規(guī)模接種或使用[5,40-41]�����。
上述方法幾乎適用于生產(chǎn)任何mRNA序列�,批次間變異性低�,與其他平臺相比�,有助于節(jié)省時間并降低經(jīng)濟(jì)成本。對mRNA原料藥和制劑藥物產(chǎn)品進(jìn)行測試和過程分析�,以評估鑒別、外觀�����、含量�����、純度�����、RNA完整性�����、殘留DNA�����、包封率、粒徑�、生物活性內(nèi)毒素污染和無菌性[5,43]。對于特定的mRNA�����,制備mRNA藥物的程序可能會稍作調(diào)整���,包括修飾核苷�,以及采用加帽策略或純化策略等�����。
生產(chǎn)mRNA所需的所有設(shè)備均符合良好生產(chǎn)規(guī)范(GMP)級別�����,在有限的工業(yè)規(guī)模的生產(chǎn)設(shè)施內(nèi)���,每年可生產(chǎn)數(shù)千萬劑基于RNA的產(chǎn)品[5]。
1.4 mRNA疫苗優(yōu)勢
首先���,mRNA疫苗是一種無感染���、安全的平臺�����,沒有感染或插入基因組突變的潛在風(fēng)險性[11,44]��。其次���,mRNA體內(nèi)半衰期可以通過使用mRNA修飾和遞送方法來調(diào)節(jié)[45]。再次��,mRNA疫苗允許同時遞送多種抗原�����,特別是對于腫瘤疫苗�,可以覆蓋各種腫瘤相關(guān)抗原(TAA)、腫瘤特異性抗原(TSA)或細(xì)胞因子���,以引發(fā)體液和細(xì)胞介導(dǎo)的免疫反應(yīng)����,從而增強(qiáng)抗腫瘤功效[46]��。最后,如前文所述����,mRNA疫苗具有可擴(kuò)展性,可以通過無細(xì)胞的體外轉(zhuǎn)錄(IVT)獲得高產(chǎn)量的mRNA����,且一旦建立了成熟的mRNA疫苗平臺,就可以通過該平臺快速開發(fā)不同的mRNA疫苗��。
2���、mRNA疫苗產(chǎn)業(yè)發(fā)展?fàn)顩r
2.1 mRNA疫苗研發(fā)進(jìn)展
目前�,大量mRNA疫苗正在研制中�,部分已應(yīng)用于臨床治療各種疾病,包括新冠mRNA疫苗��、其他傳染病mRNA疫苗和腫瘤mRNA疫苗���。此外����,mRNA疫苗也會與其他療法(如化學(xué)療法和免疫療法)聯(lián)合使用����。
2.1.1 新冠mRNA疫苗
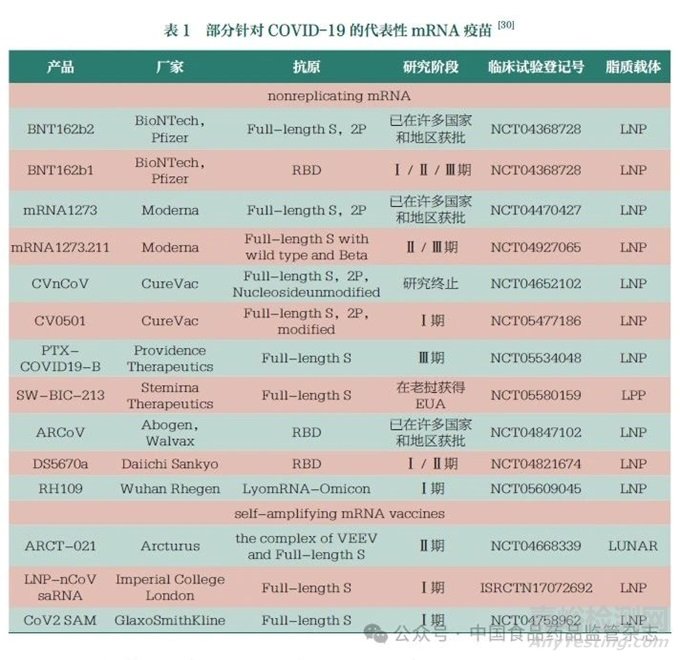
新冠病毒(SARS-Co V-2)感染引起的COVID-19大流行仍在持續(xù),對人類健康和全球經(jīng)濟(jì)造成巨大影響����,疫苗是抗擊COVID-19大流行的主要途徑。2023年1月24日世界衛(wèi)生組織發(fā)布的數(shù)據(jù)顯示���,全球有300多種新冠候選疫苗�����,其中176種已進(jìn)入臨床試驗階段�����?���;趍RNA疫苗在預(yù)防傳染病方面的優(yōu)勢��,新冠mRNA疫苗在COVID-19大流行期間得以快速開發(fā)及迭代���,并為抗擊COVID-19作出了重要貢獻(xiàn)����。輝瑞/Bio NTech公司聯(lián)合開發(fā)的BNT162b2(Comirnaty)于2020年12月在美國獲得緊急使用授權(quán)(EUA),其生物制品許可證申請(BLA)亦于2021年8月在美國獲批�����,是全球第一個上市的mRNA疫苗��;莫德納(Moderna)公司的mRNA-1273(Spikevax)于2020年12月在美國獲得EUA,BLA于2022年2月1日在美國獲批���,是全球第二個上市的mRNA疫苗�;我國軍事醫(yī)學(xué)科學(xué)院��、蘇州艾博生物和云南沃森生物共同研發(fā)的AWcorna于2022年9月在印度尼西亞獲得EUA���,這也是我國在海外獲得的第一個EUA���;石藥集團(tuán)的SYS6006于2023年3月在我國獲得EUA,為國內(nèi)首款[47]�����。部分針對COVID-19的代表性mRNA疫苗見表1����。
莫德納公司的mRNA-1273和輝瑞/Bio NTech公司的BNT162b2均于2020年1月開始研發(fā),并在12個月內(nèi)獲得EUA���,目前仍在全球范圍內(nèi)使用�����,證明了mRNA疫苗預(yù)防病毒感染的有效性�����。臨床結(jié)果表明�����,BNT162b2和mRNA-1273都可以誘導(dǎo)產(chǎn)生高水平的中和抗體��,并引發(fā)強(qiáng)大的T輔助因子1細(xì)胞反應(yīng)����,因此在預(yù)防野生型病毒感染方面具有較好的效果(~95%)[30]���。
COVID-19暴發(fā)以來��,參考SARS-Co V-2序列(h Co V-19/Wuhan/WIV04/2019)觀察到超過12 000個突變�,大約每11天發(fā)生一次核苷酸替換[48-49]。SARS-Co V-2的特定突變引發(fā)不同的表型改變�����,其中一些由于可能導(dǎo)致病毒的傳播性或毒力增強(qiáng)�����,通過自然感染或疫苗接種獲得的中和抗體減少����,使治療或疫苗接種的有效性降低,被歸為關(guān)注變體(VOC)[50-51]���。截至目前����,已經(jīng)確定了5種VOC����,包括Alpha、Beta����、Gamma�����、Delta和Omicron變體[51]。莫德納公司的mRNA-1273和輝瑞/Bio NTech公司的BNT162b2對于上述5種VOC的保護(hù)效果均出現(xiàn)了不同程度的下降��,尤其是對于突變位點達(dá)30多個的Omicron變體的保護(hù)效果下降更為顯著[52]�����。目前���,已有多種針對SARS-Co V-2 VOC����,尤其是Omicron變體的mRNA疫苗正在開發(fā)中��,包括云南沃森生物與上海藍(lán)鵲生物合作開發(fā)的RQ3013���、RQ3033疫苗�����,并有數(shù)種已被授權(quán)使用[51-53]��。
2.1.2 其他傳染病mRNA疫苗
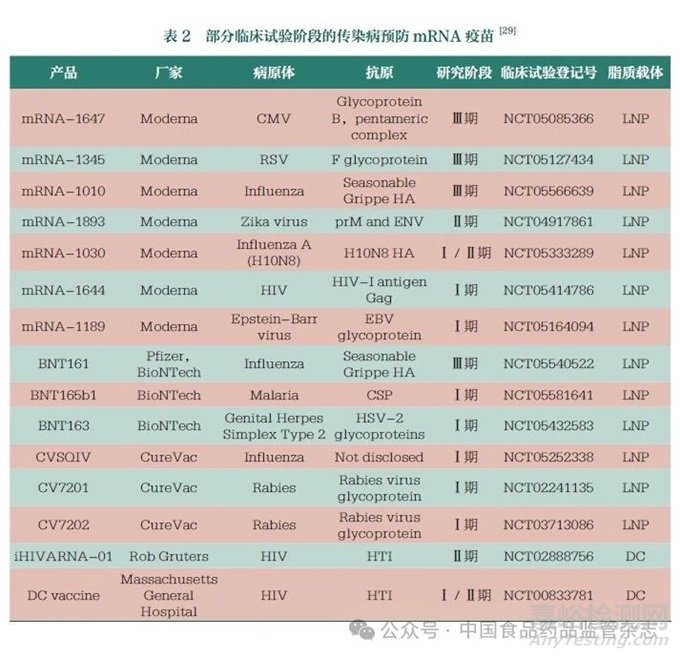
基于mRNA疫苗在傳染病預(yù)防方面的優(yōu)勢以及在COVID-19預(yù)防中取得的效果����,近年來,預(yù)防其他傳染病病毒[如流感病毒�����、寨卡病毒�����、呼吸道合胞病毒(RSV)����、帶狀皰疹病毒]的mRNA疫苗也成為研發(fā)熱點,且部分已進(jìn)入臨床試驗階段(表2)�。其中,莫德納公司研發(fā)的針對巨細(xì)胞病毒(CMV)的mRNA-1647�、針對RSV的mRNA-1345以及針對流感病毒的mRNA-1010進(jìn)度較快[29]。
2.1.3 腫瘤mRNA疫苗
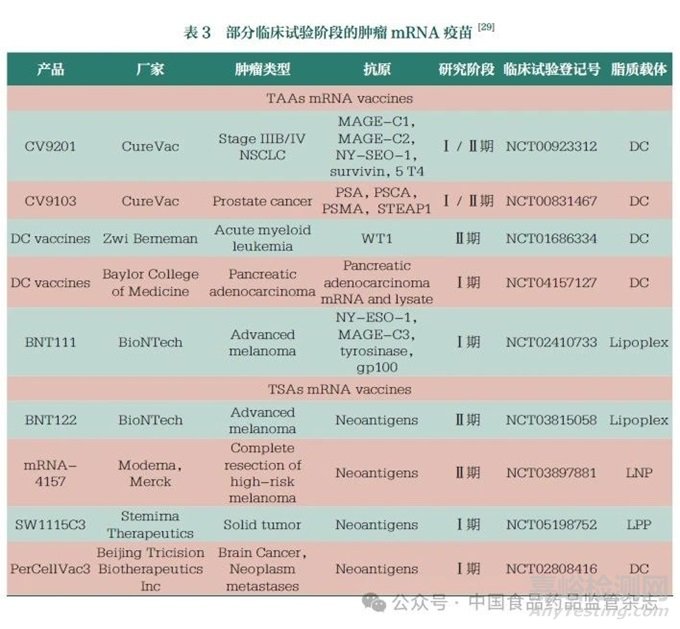
基于可編碼多種腫瘤抗原�、安全給藥和誘導(dǎo)強(qiáng)大T細(xì)胞反應(yīng)的高免疫原性等優(yōu)點,mRNA疫苗已成為一種越來越受歡迎的腫瘤治療方法。腫瘤疫苗的開發(fā)主要針對TAA和TSA����。其中,TAA是由正?�;蚍g而來的蛋白質(zhì)����,在腫瘤細(xì)胞表面異常或過度表達(dá)����,但同時也存在于正常組織中�����,特異性較低�����。TSA在正常組織中不存在����,但在個體腫瘤細(xì)胞中表達(dá),具有高度特異性,因此被認(rèn)為是理想的腫瘤疫苗抗原����。目前,腫瘤mRNA疫苗大多仍處于Ⅰ/Ⅱ期臨床試驗階段(表3)[29,54-55]��。
2.2 mRNA疫苗的GMP生產(chǎn)
2.2.1 國內(nèi)外對于mRNA疫苗GMP生產(chǎn)的要求及差異
我國對疫苗生產(chǎn)實施嚴(yán)格的準(zhǔn)入制度��,疫苗上市許可持有人自身應(yīng)當(dāng)具備疫苗生產(chǎn)能力�����,一般情況下不允許委托生產(chǎn)�。因此,在我國預(yù)防用mRNA疫苗上市許可持有人必須自建GMP生產(chǎn)線�����,具備生產(chǎn)和檢驗放行的能力���;但若不是預(yù)防用mRNA疫苗��,則不受此限制����,可以委托生產(chǎn)。國外藥品監(jiān)管機(jī)構(gòu)對于自建生產(chǎn)線無具體限制要求��。因此�����,我國mRNA疫苗企業(yè)普遍選擇自建生產(chǎn)線����;而國外相關(guān)企業(yè)更多的是基于企業(yè)自身發(fā)展戰(zhàn)略選擇自建生產(chǎn)線、與其他企業(yè)合作或委托生產(chǎn)��。
預(yù)防傳染病用mRNA疫苗的質(zhì)粒DNA(pDNA)是否能委托生產(chǎn)�����,也是一個值得關(guān)注的問題。表3部分臨床試驗階段的腫瘤mRNA疫苗[29]歐盟相關(guān)指南(Questions and Answers on the Principles of GMP for the Manufacturing of Starting Materials of Biologicalorigin Used to Transfer Genetic Material for the Manufacturing of ATMPs)把pDNA作為起始物料進(jìn)行監(jiān)管���,允許企業(yè)委托醫(yī)藥合同生產(chǎn)組織(contract manufacture organization,CMO)生產(chǎn)pDNA���。在我國����,根據(jù)《疫苗管理法》《新型冠狀病毒預(yù)防用疫苗研究階段臨床試驗登記號脂質(zhì)載體研發(fā)技術(shù)指導(dǎo)原則(試行)》等相關(guān)規(guī)定���,pDNA模板定義為原液的生產(chǎn)工藝,企業(yè)應(yīng)當(dāng)自主生產(chǎn)pDNA[47]����。
2.2.2 國內(nèi)外mRNA疫苗GMP生產(chǎn)基地概況
疫苗生產(chǎn)必須通過GMP符合性檢查,每個工廠都必須具備符合資質(zhì)要求的人員和基礎(chǔ)設(shè)施���,因此大規(guī)模集中生產(chǎn)是mRNA疫苗生產(chǎn)現(xiàn)狀�?��;趪鴥?nèi)外疫苗監(jiān)管要求的差異,國外mRNA疫苗企業(yè)主要通過與有生產(chǎn)能力的企業(yè)合作或委托生產(chǎn)�����,以快速擴(kuò)大產(chǎn)能�����,同時啟動新建生產(chǎn)基地�,可能用于生產(chǎn)質(zhì)粒、mRNA原液���、LNP(DP)或者進(jìn)行灌裝和分發(fā)�����;而我國的大部分mRNA疫苗企業(yè)在項目早期就啟動建設(shè)GMP生產(chǎn)基地,大多涵蓋從質(zhì)粒生產(chǎn)到最終灌裝和分發(fā)的功能�。
莫德納公司和輝瑞/Bio NTech公司的新冠mRNA疫苗生產(chǎn)工廠幾乎都分布在歐美地區(qū)。為了更好地實現(xiàn)疫苗的全球供應(yīng)��,莫德納公司����、輝瑞/Bio NTech公司與包括我國�、澳大利亞、加拿大�����、新加坡�、南非和韓國在內(nèi)的幾個國家或地區(qū)的企業(yè)建立了合作關(guān)系�,并在部分國家和地區(qū)布局了生產(chǎn)基地建設(shè)計劃。
mRNA疫苗企業(yè)三巨頭之一Cure Vac��,在德國總部擁有自己的GMP級別臨床樣品生產(chǎn)車間和產(chǎn)業(yè)化工廠�����,其產(chǎn)業(yè)化工廠面積達(dá)8800m2��,設(shè)計年產(chǎn)能為3000萬劑���。此外����,Cure Vac還與諾華(Novartis)公司合作�����,計劃在位于奧地利的工廠生產(chǎn)mRNA原液和制劑�����,年產(chǎn)能可達(dá)2億劑[53]�����。
云南沃森生物是國內(nèi)最早布局mRNA疫苗產(chǎn)業(yè)化的企業(yè)���,早在2021年9月就在云南省玉溪市高新區(qū)疫苗產(chǎn)業(yè)園建成mRNA疫苗模塊化工廠,原液年產(chǎn)能可達(dá)10億劑�����,制劑產(chǎn)能可達(dá)2.4億劑�。石藥集團(tuán)的SYS6006由其子公司巨石生物負(fù)責(zé)生產(chǎn)�,巨石生物的mRNA生產(chǎn)廠房產(chǎn)能可達(dá)15億劑,其中新冠mRNA疫苗10億劑���。此外�����,國藥中生復(fù)諾健位于上海嘉定的GMP生產(chǎn)基地���,設(shè)計最高年產(chǎn)能為20億劑�����;云頂新耀位于浙江嘉善的GMP生產(chǎn)車間年產(chǎn)能預(yù)計可達(dá)7億劑次��;啟辰生生物在珠海金灣國際健康港的GMP生產(chǎn)車間�����,建筑面積超1300m2�����,能實現(xiàn)全鏈條生產(chǎn)���;還有成都威斯津位于成都天府國際生物城的在建生產(chǎn)基地,規(guī)劃年產(chǎn)能1億劑���;藍(lán)鵲生物在上海寶山規(guī)劃了10 000m2 GMP生產(chǎn)基地;康希諾在上海臨港規(guī)劃了約17 000m2生產(chǎn)廠房[53]����。
現(xiàn)階段,由于新冠疫苗的需求大幅下降�����,mRNA生產(chǎn)基地的發(fā)展目標(biāo)由快速擴(kuò)大產(chǎn)能轉(zhuǎn)變?yōu)榕cmRNA疫苗企業(yè)自身戰(zhàn)略相適應(yīng)?����;趍RNA疫苗高度平臺化的特點����,這些生產(chǎn)基地可以迅速用于其他mRNA疫苗的開發(fā)��。
3��、mRNA疫苗供應(yīng)鏈概況
3.1 國內(nèi)外mRNA疫苗供應(yīng)鏈概況
隨著新冠mRNA疫苗的發(fā)展�����,基于傳統(tǒng)生物藥物的供應(yīng)鏈����,mRNA疫苗供應(yīng)鏈也愈發(fā)成熟�。mRNA疫苗供應(yīng)鏈主要包括主要設(shè)備���、原材料及關(guān)鍵耗材�,其中比較關(guān)鍵的是酶、核苷酸底物�����、帽子結(jié)構(gòu)類似物、脂質(zhì)輔料��、分離純化設(shè)備與耗材�����、LNP包封設(shè)備與質(zhì)控設(shè)備等��。
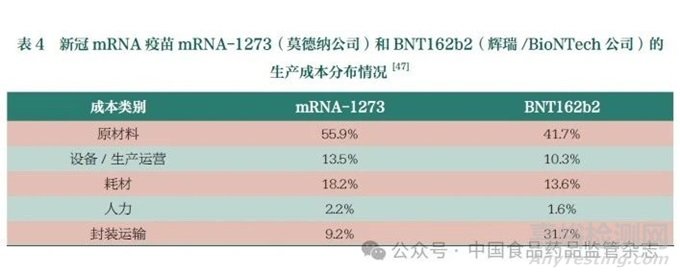
已上市的新冠mRNA疫苗中����,莫德納公司的mRNA-1273和輝瑞/Bio NTech公司的BNT162b2的原材料成本占比分別為55.9%和41.7%(表4)��,可見原材料在mRNA疫苗生產(chǎn)中的重要性�。其中��,帽子結(jié)構(gòu)類似物(46%)、酶類(約30%)占據(jù)了大部分原材料成本(表5)[47]�����。
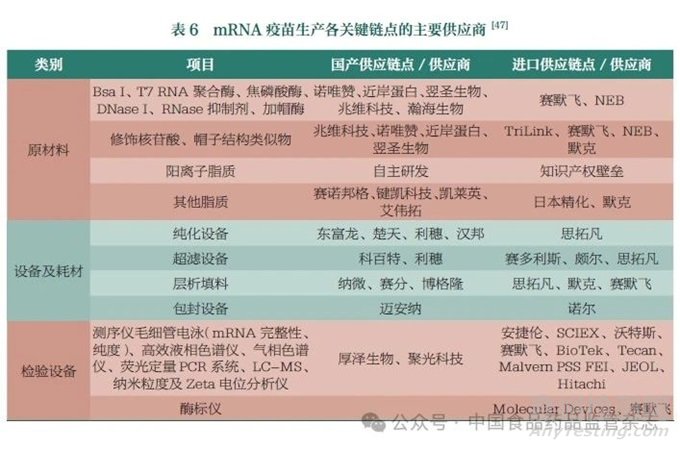
mRNA疫苗生產(chǎn)各關(guān)鍵鏈點的主要供應(yīng)商詳見表6����。從表中可以看出�,mRNA疫苗生產(chǎn)所需原材料和設(shè)備等已基本實現(xiàn)國產(chǎn)替代,進(jìn)步巨大����。部分原輔料和耗材由于生產(chǎn)工藝和質(zhì)量的局限性和穩(wěn)定性,目前仍難以實現(xiàn)國產(chǎn)替代����。尤其是mRNA合成純化及后續(xù)制劑工藝中的關(guān)鍵耗材�����,由于色譜填料和中空纖維柱等生產(chǎn)用高值耗材研發(fā)周期較長���,且涉及材料學(xué)�、流體動力學(xué)、工程力學(xué)及精細(xì)化工等多學(xué)科交叉���,尚存在國產(chǎn)化水平較低、產(chǎn)品質(zhì)量有待提高等情況�����;基于對檢測儀器的高精度要求�����,大部分檢驗儀器仍依賴進(jìn)口�。另外�,遞送系統(tǒng)����、核苷酸修飾�����、帽子結(jié)構(gòu)類似物����、LNP制備設(shè)備還存在一些專利問題����。因此���,為了實現(xiàn)國產(chǎn)mRNA疫苗的國際化,開發(fā)具有自主知識產(chǎn)權(quán)的國產(chǎn)物料將成為未來我國mRNA疫苗產(chǎn)業(yè)化的重點之一�。
許多國內(nèi)mRNA疫苗研發(fā)企業(yè)出于降低供應(yīng)鏈風(fēng)險的考慮�����,正積極開展關(guān)鍵原材料的國產(chǎn)化替代研究工作��,如對限制性內(nèi)切酶(BsaⅠ)�����、DNA核酸酶(DNaseⅠ)開展了全面的質(zhì)量標(biāo)準(zhǔn)和工藝對比研究���。結(jié)果表明,國產(chǎn)物料質(zhì)量標(biāo)準(zhǔn)在一定程度上比進(jìn)口物料的質(zhì)量標(biāo)準(zhǔn)更加完善���;對于同一物料�����,國產(chǎn)供應(yīng)商和進(jìn)口供應(yīng)商來源對產(chǎn)品質(zhì)量的影響無明顯差異���。
目前,從mRNA疫苗物料供應(yīng)商調(diào)研和審計情況來看��,大部分原輔料均可實現(xiàn)國產(chǎn)替代�。極少部分原輔料的純度對于LNP結(jié)構(gòu)穩(wěn)定非常重要���,國產(chǎn)物料純度尚不能滿足產(chǎn)品工藝質(zhì)量需求����,仍然采用進(jìn)口物料����。
4��、總結(jié)與展望
mRNA疫苗因具有靈活�����、安全���、可調(diào)控以及快速開發(fā)等特點��,成為生物制藥領(lǐng)域的一顆冉冉升起的新星�����。其不僅在抗擊COVID-19大流行中發(fā)揮了巨大作用�,也將在腫瘤免疫和傳染病領(lǐng)域成為應(yīng)用熱點��。相關(guān)研產(chǎn)管線及供應(yīng)鏈也將更加成熟�����,同時已建成或在建的平臺化mRNA疫苗研產(chǎn)管線將推動mRNA疫苗產(chǎn)業(yè)高速發(fā)展���。此外,個體化醫(yī)療也有望成為mRNA疫苗研產(chǎn)管線布局的重要方向之一����。但需要關(guān)注的是,目前mRNA疫苗生產(chǎn)成本尤其是原材料成本仍較高�,降低原材料成本可大大提高疫苗的產(chǎn)品可及性。開發(fā)自擴(kuò)增RNA(sa RNA)疫苗以降低mRNA疫苗的劑量要求可能是前景較好的方法之一�,另外也有報道采用類似重組蛋白的方式基于細(xì)菌/細(xì)胞系統(tǒng)生產(chǎn)mRNA,從而在保證mRNA疫苗質(zhì)量的同時有效降低生產(chǎn)成本���。目前�,mRNA疫苗的專利壁壘仍較多����,為了實現(xiàn)國產(chǎn)mRNA疫苗的國際化���,具有自主知識產(chǎn)權(quán)的國產(chǎn)物料的開發(fā)力度需要進(jìn)一步加強(qiáng)�。
引用本文
劉財旺,龍新華,包嫄,李薇*.mRNA疫苗技術(shù)和產(chǎn)業(yè)發(fā)展概況[J].中國食品藥品監(jiān)管,2023(12):74-84.