今日頭條
來凱FIC減肥抗體獲批IND���。來凱醫(yī)藥潛在“first-in-class”ActRIIA單抗LAE102獲FDA臨床許可����,擬用于治療肥胖癥患者�。LAE102針對參與調(diào)控肌肉再生和脂代謝的新靶點(diǎn)ActRIIA���,對腫瘤生長����、免疫激活����、肌肉再生和造血發(fā)育等都有調(diào)控作用���。去年5月�,該新藥已獲FDA批準(zhǔn)開展用于治療非小細(xì)胞肺癌等實(shí)體瘤的I/II期臨床����。在國內(nèi),該新藥用于晚期/轉(zhuǎn)移性實(shí)體瘤的適應(yīng)癥也獲批臨床許可���。
國內(nèi)藥訊
1.梯瓦偏頭痛新藥III期臨床成功�。梯瓦CGRP抑制劑瑞瑪奈珠單抗(Fremanezumab)用于中國成年患者偏頭痛預(yù)防性治療的III期研究達(dá)到了主要終點(diǎn)和所有次要終點(diǎn)���。與安慰劑相比�,F(xiàn)remanezumab治療使患者每月偏頭痛天數(shù)顯著減少�;且藥物耐受性良好���,未出現(xiàn)任何安全信號���;詳細(xì)結(jié)果將在醫(yī)學(xué)會議上公布。在美國和歐盟����,F(xiàn)remanezumab已獲批用于成年患者偏頭痛的預(yù)防性治療。
2.君圣泰代謝調(diào)節(jié)劑啟動Ⅲ期臨床�。君圣泰生物肝-腸抗炎代謝調(diào)節(jié)劑HTD1801在Clinicaltrials.gov網(wǎng)站上注冊兩項(xiàng)Ⅲ期臨床,擬評估用于治療2型糖尿病的有效性與安全性�。HTD1801是該公司首發(fā)管線,包含小檗堿和熊去氧膽酸有效成分�,擬開發(fā)用于非酒精性脂肪性肝炎(NASH)���、2型糖尿病�、高血脂����、膽管炎等多個(gè)適應(yīng)癥。在Ⅱa期臨床中���,與安慰劑相比,HTD1801(1000mg)顯著減少了患者18周后的肝臟脂肪含量。
3.輝大RNA編輯療法獲兒科RPDD����。FDA授予輝大基因公司迷你型dCas13X-RNA堿基編輯器(mxABE)療法兒科罕見病藥物資格(RPDD),用于治療OTOF(otoferlin)基因中Q829X突變相關(guān)的兒童聽力損失���。這是一種先天性耳聾����,由OTOF基因突變導(dǎo)致表達(dá)的耳鐵蛋白(otoferlin)功能失常,從而影響聲音刺激信號由耳朵傳向大腦�。此前���,該產(chǎn)品已獲FDA授予孤兒藥資格���。
4.深圳萊芒CAR-T早期臨床積極����。深圳萊芒生物代謝增強(qiáng)型CD19 CAR-T產(chǎn)品在 AACR 2024年會上公布了一項(xiàng)研究者發(fā)起����、用于治療復(fù)發(fā)難治性晚期CD19陽性血液瘤患者的臨床試驗(yàn)(IIT)的積極結(jié)果����。該臨床試驗(yàn)首批入組了包括罹患彌漫大B細(xì)胞淋巴瘤(DLBCL)和B細(xì)胞急性淋巴細(xì)胞白血?。˙-ALL)共12例晚期患者,接受極低的給藥劑量治療后����,全部患者均獲得完全緩解(CR)����,并且患者僅經(jīng)歷輕微的細(xì)胞因子風(fēng)暴(CRS)���。
5.元宋溶瘤病毒獲批IND。元宋生物溶瘤病毒產(chǎn)品YSCH-01(重組L-IFN腺病毒注射液)獲CDE批準(zhǔn)開展臨床試驗(yàn)�,用于治療晚期實(shí)體瘤(包括但不限于頭頸部鱗癌�、卵巢癌、非小細(xì)胞肺癌等)���。YSCH-01利用具有靶向腫瘤雙重調(diào)控的溶瘤腺病毒載體攜帶了多功能抗癌的重組免疫抗癌基因L-IFN,已在臨床前多個(gè)實(shí)體腫瘤研究中顯示出90-100%的抑瘤效果�。此前,該新藥已獲FDA批準(zhǔn)開展新藥研究。
6.丹碼中美雙報(bào)單抗獲批IND����。丹碼生物1類生物制品DM919注射液獲國家藥監(jiān)局批準(zhǔn)開展I期試驗(yàn),擬評估用于治療晚期實(shí)體瘤的安全性與有效性�。DM919是該公司首個(gè)管線研發(fā)產(chǎn)品����,是一款MIC A/B單抗。MIC A/B在癌變����、感染����、DNA損傷等應(yīng)激反應(yīng)中顯著上調(diào)�,進(jìn)而激活表達(dá)NKG2D的NK細(xì)胞����、CD8+T細(xì)胞來清除表達(dá)MICA/B的腫瘤細(xì)胞等���。去年年底,該新藥已獲得FDA臨床批件�。
國際藥訊
1.新型眼科基因療法獲批Ⅲ期臨床�。Ocugen公司宣布其新型基因療法OCU400的Ⅲ期臨床IND補(bǔ)充件已獲得FDA批準(zhǔn)�,即將開展評估用于治療色素性視網(wǎng)膜炎(RP)患者的有效性與安全性���,且無需考慮RP患者的基因突變類型���。該療法采用AAV載體����,將核激素受體基因NR2E3的功能性拷貝遞送至視網(wǎng)膜中的靶細(xì)胞,有助于重置視網(wǎng)膜穩(wěn)態(tài)�,具有穩(wěn)定細(xì)胞和挽救光感受器變性的潛力。在歐盟�,OCU400已獲得用于治療RP和Leber先天性黑矇(LCA)的孤兒藥資格����。
2.Geneos公司癌癥疫苗見刊����。Geneos公司基于質(zhì)粒編碼至多40個(gè)腫瘤新抗原的個(gè)性化癌癥疫苗GNOS-PV02與PD-1抑制劑派姆單抗聯(lián)合治療晚期肝細(xì)胞癌(HCC)的Ⅰ/Ⅱ期臨床成果發(fā)表于Nature Medicine期刊上。數(shù)據(jù)顯示���,GNOS-PV02聯(lián)合治療在36例經(jīng)治患者中達(dá)到了30.6%的客觀緩解率����,包括3例患者完全緩解和8例患者部分緩解����。GNOS-PV02聯(lián)合治療較派姆單抗單藥治療提高了患者的臨床緩解(30.6%vs16.9%)����,且藥物安全性良好。
3.Obsidian公司TIL療法早期臨床積極。Obsidian公司自體腫瘤浸潤淋巴細(xì)胞(TIL)療法OBX-115治療黑色素瘤患者的首個(gè)人體臨床結(jié)果積極。OBX-115通過基因工程改造表達(dá)與細(xì)胞膜結(jié)合的IL-15����,旨在提高TIL細(xì)胞療法的抗癌活性和安全性。數(shù)據(jù)顯示�,OBX-115治療12周后達(dá)到了50%的客觀緩解率(ORR)和33%的完全緩解率;疾病控制率(DCR)為100%�;6個(gè)月時(shí)的無進(jìn)展生存率為67%。此外�,藥物安全性良好。
4.Tr1X公司T細(xì)胞療法獲批臨床���。FDA批準(zhǔn)Tr1X公司同種異體調(diào)節(jié)性T細(xì)胞療法TRX103開展首個(gè)人體臨床試驗(yàn),用于預(yù)防HLA不匹配的造血干細(xì)胞移植患者的移植物抗宿主病���。這是該公司首個(gè)現(xiàn)貨型調(diào)節(jié)性T細(xì)胞療法����,擬開發(fā)用于治療多種自身免疫和炎癥性疾病。該公司還計(jì)劃在2024年第三季度提交TRX103治療難治性克羅恩病的IND�。
5.Century公司布局自免病領(lǐng)域管線�。Century公司宣布以4500萬美元總交易金額收購Clade公司����,并獲得其iPSC來源的NK細(xì)胞療法及平臺,增強(qiáng)其在癌癥和自身免疫性疾病領(lǐng)域的應(yīng)用���。Century同時(shí)也完成6000萬美元融資���,以支持其靶向CD19的誘導(dǎo)自然殺傷細(xì)胞(iNK)療法CNTY-101開展治療系統(tǒng)性紅斑狼瘡(SLE)的相關(guān)臨床試驗(yàn)(CALiPSO-1)�。目前�,CNTY-101也正在臨床試驗(yàn)(ELiPSE-1)中評估用于治療B細(xì)胞惡性腫瘤的潛力。
6.富士膠片旗下CDMO公司增資擴(kuò)廠�。富士膠片旗下CDMO公司Fujifilm Diosynth 計(jì)劃在20億美元基礎(chǔ)上再增資12億美元,以進(jìn)一步擴(kuò)建位于北卡羅來納州(North Carolina)霍利斯普林斯的大型生物制造工廠���。該工廠將于2025年正式運(yùn)營,新投資將使其基地20,000升哺乳動物細(xì)胞培養(yǎng)生物反應(yīng)器總數(shù)達(dá)到16個(gè),增加了大規(guī)模生產(chǎn)能力����。預(yù)計(jì)到2031年,這項(xiàng)投資將新增680個(gè)工作崗位�。
醫(yī)藥熱點(diǎn)
1.北京:每個(gè)街道至少建設(shè)1個(gè)養(yǎng)老服務(wù)中心���。4月10日,《北京市街道(鄉(xiāng)鎮(zhèn))區(qū)域養(yǎng)老服務(wù)中心建設(shè)管理指引(試行)》發(fā)布���,要求每個(gè)街道(鄉(xiāng)鎮(zhèn))原則上至少建設(shè)1個(gè)養(yǎng)老服務(wù)中心�,建筑面積原則上不少于2000平方米�,應(yīng)包括托養(yǎng)服務(wù)區(qū)、社區(qū)餐廳����、老年學(xué)堂、醫(yī)養(yǎng)服務(wù)區(qū)和綜合服務(wù)區(qū)等功能分區(qū)����。其中�,托養(yǎng)服務(wù)區(qū)床位不少于10張���,護(hù)理型床位占比原則上不低于60%,具備條件的可設(shè)置失智照護(hù)專區(qū)���;醫(yī)養(yǎng)服務(wù)區(qū)內(nèi)部可設(shè)置診所���、衛(wèi)生所(室)���、醫(yī)務(wù)室、護(hù)理站或引入醫(yī)療機(jī)構(gòu)����。
2.百濟(jì)神州廣州生物藥生產(chǎn)基地ADC園區(qū)啟用。近日�,百濟(jì)神州廣州生物藥生產(chǎn)基地抗體偶聯(lián)藥物(ADC)生產(chǎn)園區(qū)竣工啟用�,旨在依托廣州和大灣區(qū)的政策支持和產(chǎn)業(yè)資源���,加速創(chuàng)新藥物的研發(fā)、生產(chǎn)和商業(yè)化進(jìn)程�,打造生物醫(yī)藥全產(chǎn)業(yè)鏈卓越中心。該園區(qū)占地5.8萬平方米���,建設(shè)有兩個(gè)主要生產(chǎn)車間�,前期已建成包括抗體偶聯(lián)���、超濾純化和無菌灌裝凍干在內(nèi)的生產(chǎn)線,并配備了ADC專用的QC分析實(shí)驗(yàn)室���,以及MST和工藝開發(fā)實(shí)驗(yàn)室�,以全面支持技術(shù)轉(zhuǎn)移和商業(yè)化生產(chǎn)�。
3.阿斯利康CEO 2024薪酬2370萬美元。路透社報(bào)道:阿斯利康股東批準(zhǔn)了2024年的薪酬政策,其中首席執(zhí)行官(CEO)Pascal Soriot 2024薪酬提高12%至1890萬英鎊(約2370萬美元)����。Soriot 2023年薪酬為1685.3萬英鎊(約2103萬美元),主要由于他在創(chuàng)新���、股東回報(bào)和環(huán)境可持續(xù)發(fā)展等領(lǐng)域的表現(xiàn)掛鉤的長期激勵(lì)�。2023年阿斯利康全年?duì)I收458億美元����,完成了450億美元的預(yù)期目標(biāo)�。阿斯利康已成為英國第二大市值上市公司,目前市值為2134.3億美元����。
評審動態(tài)
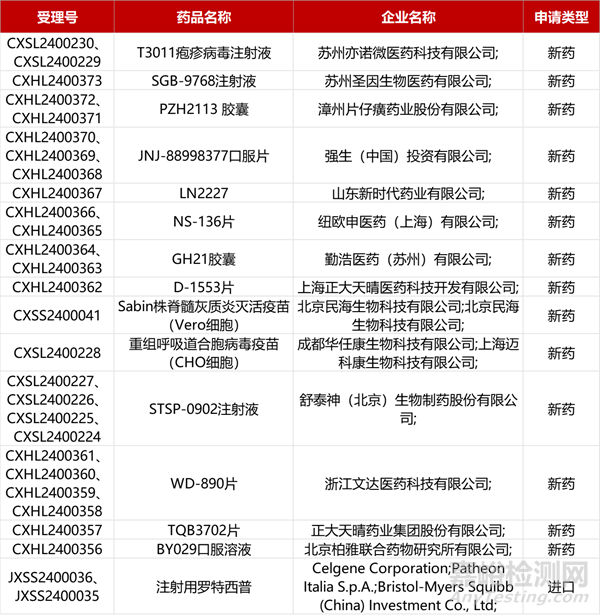
1. CDE新藥受理情況(04月13日)
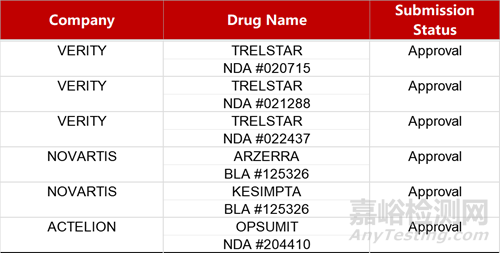
2. FDA新藥獲批情況(北美04月12日)