寡核苷酸安全工作組小組委員會(huì)(Subcommittee of the Oligonucleotide Safety Working Group, OSWG)是由AstraZeneca����、Novo Nordisk����、Cardior Pharmaceuticals�、Alnylam Pharmaceuticals等公司組成�。近期��,OSWG發(fā)布了關(guān)于寡核苷酸類(lèi)藥物(oligonucleotides, ONs)吸收、分布����、代謝�、排泄研究的白皮書(shū)。
ONs是由化學(xué)合成的寡核苷酸單鏈或雙鏈組成的一類(lèi)藥物����,一般由12-30個(gè)核糖核苷酸或脫氧核苷酸單鏈或雙鏈組成。ONs通過(guò)沃森克里克堿基互補(bǔ)配對(duì)作用于目的核苷酸序列上�,干擾基因的解旋�、復(fù)制��、轉(zhuǎn)錄、翻譯等各個(gè)環(huán)節(jié)��,使編碼異常的基因喪失功能�,進(jìn)而矯正“錯(cuò)誤”蛋白質(zhì)的表達(dá),達(dá)到治療疾病的目的��。
ONs包括反義核酸(ASO)��、小干擾RNA(siRNA)、微小RNA(miRNA)�、小激活RNA(saRNA)�、核酸適配體(aptamer)��、核酶(ribozyme)等。其中ASO和siRNA應(yīng)用最為廣泛�。
涉及藥代動(dòng)力學(xué)研究?jī)?nèi)容的指南很多�,羅列如下�。但特別針對(duì)寡核苷酸的很少�,大多是通用原則����,未特指某一類(lèi)產(chǎn)品��。OSWG從這一需求出發(fā)��,對(duì)寡核苷酸的ADME研究策略和特點(diǎn)進(jìn)行了介紹�,以期獲得這類(lèi)產(chǎn)品的最佳實(shí)踐�。
2010, ICH M3(R2): Nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals.
1995, ICH S3A: guideline for industry, toxicokinetics: the assessment of systemic exposure in toxicity studies.
1995, ICH S3B: pharmacokinetics: guidance for repeated dose tissue distribution studies.
2020, FDA: Safety testing of drug metabolites, guidance for industry.
2012, EMA: Guideline on the investigation of drug interactions.
2020, FDA: Draft guidance: drug-drug interaction assessment for therapeutic proteins guidance for industry.
2022, FDA: Draft guidance: Clinical pharmacology considerations for the development of oligonucleotide therapeutics.
2018, FDA: Guidance for industry, liposome drug products: Chemistry, manufacturing, and controls; Human pharmacokinetics and bioavailability; and labeling documentation.
2010, ICH S9: Guidance for industry, S9 nonclinical evaluation for anticancer pharmaceuticals.
2018, EMA: Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products.
2013, FDA: Preclinical assessment of investigational cellular and gene therapy products.
吸收
通常來(lái)講,寡核苷酸藥物的PK/ADME研究目的�、設(shè)計(jì)原則����、數(shù)據(jù)分析�,與小分子或者生物藥是相似的����。ONs藥物在分子量、電荷和親水性方面有一定特殊性����。ONs給藥方式包括靜脈注射(IV)����、皮下注射(SC)����、鞘內(nèi)給藥(IT)�、側(cè)腦室給藥(ICV)����、吸入給藥和玻璃體內(nèi)注射給藥(IVT)�。
單次給藥PK研究
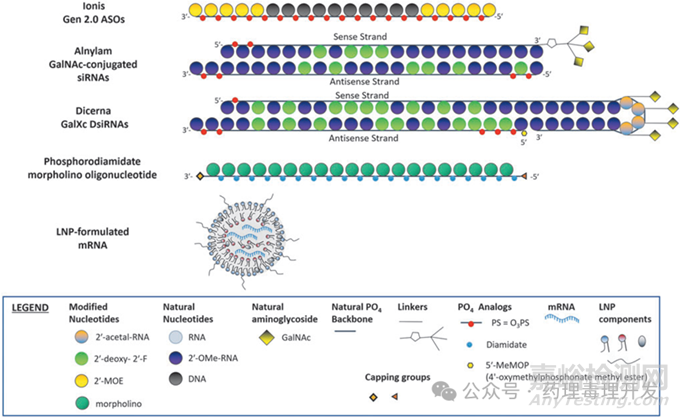
對(duì)于新分子ONs��,通常需要開(kāi)展單獨(dú)的單次給藥PK研究,有助于建立血液/腦脊液和組織中藥物濃度相關(guān)性��,并方便可能的建模(PK modeling)。但是�,如果一個(gè)ONs平臺(tái)已經(jīng)進(jìn)行過(guò)充分研究��,有著豐富的背景數(shù)據(jù)����,常不需要開(kāi)展單獨(dú)的PK研究����,因來(lái)自同一平臺(tái)的化合物往往具備相似的ADME屬性��。比如下圖中的Ionis公司的Gen2.0 ASOs平臺(tái)、Alnylam公司的GalNAc-conjugated siRNAs平臺(tái)��、Dicerna公司的GalXc DsiRNAs平臺(tái)等��。
還有一種獲得單次給藥PK數(shù)據(jù)的路徑來(lái)自重復(fù)給藥毒理研究中的Day1的PK/TK數(shù)據(jù)�。具體優(yōu)缺點(diǎn)將在重復(fù)給藥PK/TK部分討論�。
給藥途徑與臨床擬用途徑一致����。如果臨床非IV給藥,如SC����、IT或IVT����,需要開(kāi)展非臨床IV給藥PK研究��,考察絕對(duì)生物利用度����。但關(guān)于這點(diǎn)還有些爭(zhēng)議����,因?yàn)镺Ns產(chǎn)品的PD或者毒性�,與生物利用度并不總是相關(guān)的��。故�,不同監(jiān)管機(jī)構(gòu)對(duì)生物利用度的要求也有區(qū)別。
劑量選擇方面與小分子類(lèi)似�,需要考量動(dòng)物模型中的藥理活性劑量、種屬間異速放大或臨床擬用劑量范圍����。同類(lèi)化合物的臨床前PK/PD����、體外活性等數(shù)據(jù)也是可以參考的�。當(dāng)然��,最好還要有些動(dòng)物耐受性試驗(yàn)數(shù)據(jù),用于設(shè)計(jì)PK試驗(yàn)的高劑量����。
PK研究用動(dòng)物種屬與藥理學(xué)和毒理學(xué)研究種屬一致�,通常是嚙齒類(lèi)+猴����。如果該分子所在的技術(shù)平臺(tái)已經(jīng)有充分的研究背景數(shù)據(jù)�,一個(gè)種屬的PK研究也是可以接受的(如前文所列平臺(tái)),否則還是需要在兩個(gè)種屬中進(jìn)行單次給藥PK研究��。
ONs性別差異在小鼠中偶然存在��,在大鼠、猴和人中卻非常少見(jiàn)����。因此����,單次給藥PK研究可以在單性別中考察。性別差異可以放在后續(xù)重復(fù)給藥毒性研究中進(jìn)行評(píng)估��。
單次給藥PK研究中其它指標(biāo)如研究持續(xù)時(shí)間、采樣時(shí)間點(diǎn)�、樣本基質(zhì)、分析方法�、GLP依從性等與小分子或生物藥一致��。研究周期應(yīng)足夠長(zhǎng)�,以充分評(píng)估ONs的PK行為��,至少覆蓋產(chǎn)品的3個(gè)消除半衰期��。采集時(shí)間點(diǎn)應(yīng)能滿足Cmax����、Tmax��、AUC表征的目的����。消除相參數(shù)如t1/2�、清除率和表觀分布容積對(duì)于PK/PD或PK建模比較關(guān)鍵,如果可能��,也盡量獲取?;贑max或AUC的劑量-反應(yīng)關(guān)系需要評(píng)估�。ONs系統(tǒng)給藥采集的樣本基質(zhì)通常是血漿或血清,局部給藥則視具體解剖位置��,可能是腦脊液或玻璃體液。血樣通常置于冰上�,低溫離心,并盡快凍存����。如果是mRNA-LNP類(lèi)藥物,還需要添加額外的穩(wěn)定劑����。
單次給藥PK研究通常檢測(cè)血藥濃度和組織濃度�。通常消除相血藥濃度與組織中的濃度是呈一定比例的。
單次給藥PK研究通常不檢測(cè)ADA��。
重復(fù)給藥PK/TK研究
TK研究在non-GLP毒理試驗(yàn)中是建議開(kāi)展的,在GLP毒理中則幾乎是必須要伴隨進(jìn)行的�。同樣的�,ONs類(lèi)產(chǎn)品的TK研究原則與小分子/生物藥也是類(lèi)似的。前文提到����,可以采用第一天PK/TK數(shù)據(jù)代替單次給藥PK研究��。這樣做的優(yōu)勢(shì)是省時(shí)����、省成本、省動(dòng)物�。缺點(diǎn)是頻繁采血操作可能影響毒性結(jié)果評(píng)估����,而且毒性劑量下的線性與藥效劑量可能也有區(qū)別,對(duì)劑量設(shè)計(jì)的要求比較高�。
重復(fù)給藥PK在給藥途徑��、劑量��、種屬選擇、樣品基質(zhì)��、分析方法等方面的要求與單次給藥PK一致����,不再贅述。
ONs重復(fù)給藥PK/TK持續(xù)時(shí)間方面與其他產(chǎn)品略有不同,需要考慮供試品在組織中的半衰期,而不只是外周血中的暴露和消除情況�。采樣時(shí)間點(diǎn)方面��,首先需要有充分的時(shí)間點(diǎn)保障AUC、Cmax����、Tmax的獲取����。其次,建議每次藥前采集1個(gè)時(shí)間點(diǎn)�,用于考察Ctrough。首末次給藥后的AUC����、Cmax的劑量-比例關(guān)系����、蓄積情況也需要評(píng)估��。
ADA的檢測(cè)可以參照ICH S6(R1)及FDA免疫原性指導(dǎo)原則進(jìn)行����。OSWG強(qiáng)調(diào),只有當(dāng)PK����、PD或毒性發(fā)現(xiàn)一些改變�,需要ADA解釋時(shí)��,方進(jìn)行動(dòng)物ADA測(cè)定(The measurement of ADA in animals should be conducted only if there is evidence of changes in PK, PD, or toxicity that could be explained by ADA)��。畢竟動(dòng)物ADA結(jié)果的臨床轉(zhuǎn)化存在種屬差異。此外�,F(xiàn)DA對(duì)治療性蛋白產(chǎn)品的ADA方法開(kāi)發(fā)和驗(yàn)證要求適用于ONs�。ADA的采集時(shí)間點(diǎn)可以在首次給藥前����、給藥期間谷濃度、恢復(fù)期處死或TK采集時(shí)�。ADA的分析結(jié)果應(yīng)能反應(yīng)發(fā)生率、出現(xiàn)時(shí)間及持續(xù)時(shí)間����。
另外值得注意的一點(diǎn)是�,對(duì)于ASOs類(lèi)產(chǎn)品�,ADA對(duì)PK谷濃度的影響比較大,ADA陽(yáng)性的動(dòng)物較ADA陰性的血藥濃度更高��。由于僅對(duì)低濃度的供試品有影響��,故Cmax和AUC不受影響�,但消除半衰期可能受影響��。因此計(jì)算消除參數(shù)時(shí)�,注意區(qū)分ADA陽(yáng)性和陰性動(dòng)物�。
對(duì)于LNP包裹的ONs產(chǎn)品��,如果采用了之前未在任何上市藥物中出現(xiàn)的新的制劑成分����,需要額外對(duì)該組分的PK和ADA情況進(jìn)行考察。
對(duì)于偶聯(lián)的ONs,建議對(duì)完整偶聯(lián)的ONs及其代謝物(未偶聯(lián)的ONs)的PK行為均進(jìn)行考察����。偶聯(lián)物如GalNAc則很少進(jìn)行考察。
分布
分布試驗(yàn)的目的主要是獲取組織和器官的暴露量����,以解釋潛在的靶器官毒性�,并為給藥頻率�,非臨床PK/PD及臨床研究提供支持。
體外血漿蛋白結(jié)合試驗(yàn)(Plasma protein binding, PPB)
藥物與血漿蛋白的結(jié)合潛在降低腎小球?yàn)V過(guò)率和腎臟排泄�,延長(zhǎng)藥物的循環(huán)時(shí)間�。但PPB對(duì)于小分子來(lái)講,會(huì)降低藥物的組織滲透和藥理活性�。相反��,ONs類(lèi)產(chǎn)品由于細(xì)胞的內(nèi)吞作用����,反而會(huì)增加活性����。原因之一��,ONs與血漿蛋白結(jié)合特點(diǎn)與小分子不同����,親和力更低且是短暫的����。另外�,不同修飾對(duì)ONs的PPB結(jié)合也有很大影響����,比如PS修飾會(huì)增加PPB結(jié)合�,2’-MOE��、2’-cEt結(jié)合則會(huì)降低結(jié)合����,2’F則對(duì)結(jié)合無(wú)影響�。單鏈ONs表現(xiàn)出比雙鏈更高的結(jié)合��;鏈的靈活性也影響結(jié)合����,polyA的親和力比polyT低100倍。GalNAc降低PPB結(jié)合��,但PS的影響更占據(jù)主導(dǎo)地位�。
建議檢測(cè)不同種屬PPB間的差異��,包括人��、非臨床藥理學(xué)和毒理學(xué)相關(guān)研究種屬��。PPB檢測(cè)濃度至少覆蓋臨床擬用劑量對(duì)應(yīng)濃度和非臨床研究的Cmax濃度,至少設(shè)置3個(gè)濃度梯度�。系統(tǒng)給藥的可采用血漿進(jìn)行評(píng)價(jià)�,局部給藥的如IT����、ICV、IVT��,可采用局部基質(zhì)如腦脊液����、玻璃體液等��。
ONs類(lèi)產(chǎn)品PPB開(kāi)展的時(shí)間點(diǎn)與小分子也有不同�,后者通常在IND之前開(kāi)展。ONs類(lèi)產(chǎn)品通常種屬間PPB結(jié)合差異不大����,也不涉及游離藥物濃度的劑量校正��,可以在IND之前�,也可以在臨床Phase1/2階段開(kāi)展����。
體內(nèi)組織分布研究
通常生物藥的組織分布研究在大規(guī)模臨床試驗(yàn)如Ⅲ期臨床或上市時(shí)提交�,但對(duì)于ONs則要提前很多��,通常在候選分子選擇時(shí)就開(kāi)展��,作為評(píng)估遞送的關(guān)鍵指標(biāo)�。組織分布可以用于解釋組織暴露和毒性之間的關(guān)系,組織中的藥物滯留時(shí)間還可以指導(dǎo)PD和毒理方案設(shè)計(jì),如給藥間隔��、恢復(fù)期等��。
試驗(yàn)設(shè)計(jì)方面與小分子化藥大體類(lèi)似。單種屬(如嚙齒類(lèi))�、單次給藥、單一性別����,劑量至少包括臨床有效劑量和毒理劑量。通常采集4-7個(gè)時(shí)間點(diǎn)�,時(shí)間點(diǎn)要覆蓋血漿Tmax��、組織Tmax�,直至4-5個(gè)組織半衰期。因此��,ONs的組織分布時(shí)間周期有可能會(huì)很久。
為考察ONs藥物組織中的蓄積情況?���?梢酝ㄟ^(guò)單次給藥組織半衰期和給藥間隔進(jìn)行估算��。也可以收集毒理研究終點(diǎn)的組織樣本進(jìn)行檢測(cè)��。具體收集什么組織��,可以根據(jù)PD和毒理學(xué)研究結(jié)果確定�。至少收集肝、腎這種高攝取的器官����。局部給藥則要增加給藥部位附近相關(guān)基質(zhì)和組織的取材�。
分析方法和組織收集
通常組織分布的藥物濃度檢測(cè)方法不需要“validated”����,只需要“qualified”即可�。有一點(diǎn)需要注意的是,要注意不同動(dòng)物之間的組織取材一致性�,比如腎臟髓質(zhì)和皮質(zhì)之間��、大腦不同區(qū)域之間濃度可能是有差異的����。
胚胎-胎仔發(fā)育毒性研究中也可以伴隨組織分布檢測(cè)����??梢栽谛l(wèi)星組收集母體組織樣本和血漿�,方便與一般毒的TK數(shù)據(jù)進(jìn)行對(duì)比�。胚胎和胎仔的暴露量可以僅檢測(cè)主要臟器如肝臟�,以評(píng)估藥物透過(guò)胎盤(pán)屏障及經(jīng)乳汁吸收的生物利用度��。
放射性標(biāo)記和非標(biāo)記方法各有優(yōu)劣。采用非標(biāo)記方法開(kāi)展組織分布研究的缺點(diǎn)是獲取的組織有限��。不過(guò)��,對(duì)于已經(jīng)有充分背景數(shù)據(jù)的平臺(tái)��,非標(biāo)記的方法是可以接受的��。各監(jiān)管機(jī)構(gòu)對(duì)放射性標(biāo)記方法也沒(méi)有強(qiáng)制要求����。如果采用放射性標(biāo)記方法開(kāi)展�,需要考慮標(biāo)記位置是否容易被代謝掉��。出于穩(wěn)定性和成本考慮����,通常1個(gè)分子僅標(biāo)記1-2個(gè)堿基��。放射性方法無(wú)論周期還是成本,都是高于非放射性的����。
其它特殊考慮
對(duì)于偶聯(lián)的ONs,組織分布既要檢測(cè)完整偶聯(lián)的ONs����,還要檢測(cè)非偶聯(lián)ONs和偶聯(lián)組分(如GalNAc)�。偶聯(lián)組分可以伴隨在重復(fù)給藥毒性中�,僅對(duì)PD靶器官、腎臟��、肝臟及相關(guān)器官進(jìn)行檢測(cè)即可��。
對(duì)于LNP遞送的ONs(siRNAs或mRNAs)�,給藥途徑在模擬臨床擬用途徑的同時(shí)����,建議包含擬產(chǎn)生最大系統(tǒng)暴露量的途徑(如IV)。對(duì)于新的LNP組分�,需要檢測(cè)其濃度和組織半衰期����,數(shù)據(jù)在Ⅲ期臨床前提供。不過(guò)����,如果毒理發(fā)現(xiàn)不是與ON有關(guān)��,懷疑與LNP組分相關(guān)��,則需要在更早階段提供新組分的組織分布數(shù)據(jù)��。另外��,對(duì)于LNP-mRNA,可以對(duì)其表達(dá)的蛋白在組織或血漿中的濃度進(jìn)行檢測(cè)����。
代謝
與小分子化藥很不同,ONs類(lèi)產(chǎn)品在不同種屬間的代謝差異很小��,很少出現(xiàn)僅在人體存在或人體中比例尤其高的特定代謝產(chǎn)物��。ONs主要被核酸內(nèi)切酶�、外切酶代謝�,而這些酶在哺乳動(dòng)物中沒(méi)有種屬����、性別�、年齡相關(guān)的差異。不過(guò)��,這并不意味ONs類(lèi)產(chǎn)品的代謝研究不重要����。ONs產(chǎn)品被切掉少數(shù)核苷酸后��,剩余的大代謝產(chǎn)物可能依然有活性�,僅檢測(cè)原型ONs會(huì)低估該分子的活性����。另外,更小片段的代謝產(chǎn)物可能雜交結(jié)合脫靶序列����,導(dǎo)致非預(yù)期毒性反應(yīng)。故��,ONs的代謝研究非常必要�。
體外代謝穩(wěn)定性
體外代謝在藥物發(fā)現(xiàn)階段用于考察候選分子的穩(wěn)定性比較常用�。雖然種屬間代謝物種類(lèi)通常沒(méi)有區(qū)別��,但代謝速率還是有差異的����。一套理想的體外評(píng)價(jià)體系對(duì)預(yù)測(cè)產(chǎn)品的體內(nèi)穩(wěn)定性頗為關(guān)鍵�。通常血漿��、靶組織細(xì)胞或者勻漿物更被認(rèn)可����。如果是局部給藥,則建議采用局部基質(zhì)��。
體外代謝產(chǎn)物鑒定
前文已經(jīng)提過(guò)����,體外代謝產(chǎn)物鑒定對(duì)小分子非常重要�,但對(duì)于ONs,由于種屬間的代謝相似性����,該研究的意義有限�。有的企業(yè)IND階段不提交代謝產(chǎn)物鑒定的數(shù)據(jù)��,也未影響臨床試驗(yàn)啟動(dòng)����。有的企業(yè)為了降低注冊(cè)風(fēng)險(xiǎn)����,未開(kāi)展體外試驗(yàn)��,僅提供體內(nèi)代謝數(shù)據(jù)。有的企業(yè)則提供了文獻(xiàn)依據(jù)����,合理說(shuō)明不開(kāi)展該項(xiàng)研究的風(fēng)險(xiǎn)并不大��。
體內(nèi)代謝
鑒于ONs類(lèi)產(chǎn)品的代謝路徑具備很好的可預(yù)測(cè)性��,OSWG及ICH相關(guān)指南建議在Ⅲ期臨床前提供該數(shù)據(jù)即可��。
除非在其它PK/TK研究中看到原型藥暴露量的性別差異�,體內(nèi)代謝通常僅在單一性別中考察即可�。代謝主要采集的樣本是血漿或尿����。血漿與組織中的一致性更好��,尿則多了腎臟代謝的環(huán)節(jié)����。組織也是一種選擇����,可以考慮ONs的主要遞送器官或表達(dá)PD靶標(biāo)的器官�,亦或者潛在長(zhǎng)時(shí)間滯留的器官��。當(dāng)然����,組織中的代謝產(chǎn)物考察并不是出于監(jiān)管機(jī)構(gòu)的要求��,完全取決于企業(yè)的研究目的����。體內(nèi)代謝常用檢測(cè)方法是LC-MS�。本研究可以在毒理研究中伴隨考察�。
代謝產(chǎn)物安全性測(cè)試
FDA代謝產(chǎn)物相關(guān)指南中要求����,如果穩(wěn)態(tài)時(shí)代謝產(chǎn)物暴露量超過(guò)原型藥10%�,則會(huì)引發(fā)安全性方面的擔(dān)憂��。這點(diǎn)對(duì)于ONs類(lèi)產(chǎn)品也適用。
對(duì)于新的LNP組分�、多肽����、連接子,如果未在任何已獲批藥物中使用過(guò)��,也需要對(duì)其安全性進(jìn)行評(píng)價(jià)��。
排泄
OSWG及ICH M3建議在Ⅲ期臨床前提供排泄數(shù)據(jù)即可�。同一類(lèi)ONs的排泄路徑是相似的��。大部分ONs主要在組織中代謝�,僅有一小部分以原型藥排泄��。
排泄可以在單獨(dú)的PK試驗(yàn)中考察����,也可以伴隨毒理試驗(yàn)考察��。單次給藥����、單一種屬即可��。嚙齒類(lèi)通常是首選��。既要檢測(cè)原型藥����,也要考察代謝物。臨床擬用劑量水平的單劑量通常是足夠的��,但如果伴隨在組織分布中考察��,還要增加一個(gè)更高劑量��。通常僅檢測(cè)尿中組分就夠了��。但當(dāng)尿液不是主要排泄途徑時(shí)��,需收集其它樣本比如膽汁����。如果供試品出現(xiàn)胃腸道毒性或肺毒性,則建議增加糞便和呼氣中樣品檢測(cè)����。
雖然放射性標(biāo)記方法非監(jiān)管機(jī)構(gòu)強(qiáng)制要求����,但已上市ONs大多采用該方法評(píng)估物料平衡��。但OSWG認(rèn)為ONs產(chǎn)品的代謝和排泄已有充分研究數(shù)據(jù)����,且同類(lèi)產(chǎn)品的特征相似,放射性標(biāo)記并不能帶來(lái)額外價(jià)值����。而且��,如果采用放射性標(biāo)記��,就不能伴隨毒理試驗(yàn)開(kāi)展了����。不過(guò),對(duì)于其它方法靈敏度不夠��、對(duì)于新型ONs類(lèi)產(chǎn)品��、對(duì)于組織滯留時(shí)間過(guò)長(zhǎng)導(dǎo)致臨床無(wú)法開(kāi)展基于放射性標(biāo)記的排泄研究等情況��,動(dòng)物的放射性標(biāo)記物料平衡就有一定意義。前文也有提到��,如果采用放射性方法�,標(biāo)記的位置盡量選擇對(duì)核酸酶比較穩(wěn)定的區(qū)域����。
乳汁分泌則視產(chǎn)品的暴露量和持續(xù)時(shí)間、口服生物利用度��、目標(biāo)人群是否含哺乳期婦女等決定是否需要開(kāi)展�。根據(jù)ICH S5(R3)描述�,一般不需要開(kāi)展��。已經(jīng)上市的ONs類(lèi)產(chǎn)品��,開(kāi)展過(guò)的乳汁分泌研究結(jié)果顯示供試品濃度非常低或檢測(cè)不到����。
另外�,與吸收、分布����、代謝的要求類(lèi)似��,如果偶聯(lián)物�、制劑等非ONs部分含有新組分����,也需要在排泄試驗(yàn)中增加該部分的檢測(cè)。最后����,對(duì)于mRNA治療的產(chǎn)品,因其先天不穩(wěn)定性��,不要求開(kāi)展排泄研究的考察����。
體外藥物相互作用
DDI主要涉及代謝酶和轉(zhuǎn)運(yùn)體��。一個(gè)藥物既可以成為DDI的“受害者”�,也可以作為“加害者”影響其它藥物的PK��。從受害者角度看����,前提是ONs需要成了Ⅰ相或Ⅱ相代謝酶、或轉(zhuǎn)運(yùn)體的底物�。而ONs主要通過(guò)核酸酶代謝�,與CYPs代謝酶和Ⅱ相結(jié)合沒(méi)有關(guān)系,同樣也不是轉(zhuǎn)運(yùn)體的底物����。另外��,ONs通常也不會(huì)影響小分子的PPB結(jié)合����。因此,ONs類(lèi)產(chǎn)品通常不需要開(kāi)展作為代謝酶或轉(zhuǎn)運(yùn)體底物的相關(guān)研究��。當(dāng)然����,事無(wú)絕對(duì)��,對(duì)于偶聯(lián)型ONs或含有新組分的LNP制劑產(chǎn)品可以考慮開(kāi)展代謝酶底物研究�。對(duì)于主要以原型藥物經(jīng)腎臟排泄的ONs��,可以評(píng)估下是否是腎轉(zhuǎn)運(yùn)體的底物��。GalNAc偶聯(lián)的ONs產(chǎn)品則重點(diǎn)關(guān)注下是否是肝臟外排轉(zhuǎn)運(yùn)體的底物�。
從加害者角度看�,ONs確實(shí)有非特異性結(jié)合一些大分子的可能�,雖然親和力比較弱�,但還是可能會(huì)占據(jù)酶或者轉(zhuǎn)運(yùn)體的活性位點(diǎn),影響其它藥物的PK行為����。不僅ONs的骨架有可能引起DDI��,偶聯(lián)組分或制劑組分也有潛在風(fēng)險(xiǎn)。如果是平臺(tái)技術(shù)制備的產(chǎn)品����,DDI背景數(shù)據(jù)是可以參考的。比如前序產(chǎn)品DDI陽(yáng)性��,那后續(xù)基于該平臺(tái)設(shè)計(jì)的產(chǎn)品也需要開(kāi)展相關(guān)研究����。如果陰性��,則提供其他產(chǎn)品數(shù)據(jù)和文獻(xiàn)資料����,不需再額外開(kāi)展DDI研究����。另外�,DDI通常僅評(píng)估全長(zhǎng)供試品��,代謝物不在考察范圍內(nèi)�。因ONs被細(xì)胞內(nèi)吞后��,只有一小部分逃離溶酶體進(jìn)入胞質(zhì),并影響代謝酶��,故肝細(xì)胞能更好模擬這一完整過(guò)程�,而肝微粒體出現(xiàn)假陽(yáng)性的可能性會(huì)高很多��。再來(lái)看轉(zhuǎn)運(yùn)體�,已上市的ONs確實(shí)可以看到對(duì)某些轉(zhuǎn)運(yùn)體抑制的報(bào)道,如casimersen抑制MATE1��,eteplirsen抑制OCT1和OTP1B1等����。所以�,建議開(kāi)展ONs對(duì)外排和內(nèi)流轉(zhuǎn)運(yùn)體的抑制研究����。
除了直接的結(jié)合引發(fā)DDI����,ONs還有可能通過(guò)其PD作用�,影響CYPs或轉(zhuǎn)運(yùn)體的表達(dá)��。因此����,需要進(jìn)行充分的文獻(xiàn)調(diào)研�,評(píng)估擬開(kāi)發(fā)產(chǎn)品的PD作用對(duì)代謝酶和轉(zhuǎn)運(yùn)體表達(dá)的影響。FDA還擔(dān)心ONs通過(guò)間接作用影響CYPs活性�。比如細(xì)胞因子可以影響CYPs的表達(dá)����,而ONs有可能調(diào)節(jié)細(xì)胞因子濃度。這種情況下��,標(biāo)準(zhǔn)的體外CYPs評(píng)估方法就不適用了��,可以考慮采用給藥后患者的血漿添加到肝細(xì)胞中進(jìn)行評(píng)估�。
FDA(2020)和EMA(2012)相關(guān)指導(dǎo)原則建議小分子藥物的DDI研究在Ⅲ期臨床前完成����,這點(diǎn)也適用于ONs類(lèi)產(chǎn)品。
最后
寡核苷酸類(lèi)藥物屬于比較新型的一類(lèi)治療方式����,尚沒(méi)有針對(duì)這類(lèi)產(chǎn)品ADME研究的指導(dǎo)原則��。OSWG這類(lèi)工業(yè)界協(xié)會(huì)發(fā)揮了很好的示范作用��,給出了比較詳細(xì)的ADME開(kāi)展建議。寡核苷酸類(lèi)藥物大部分試驗(yàn)設(shè)計(jì)原則與傳統(tǒng)化藥��、生物藥是相似的��,但又有其特殊性��。比如吸收部分出現(xiàn)性別差異的風(fēng)險(xiǎn)比較低�,可以開(kāi)展單種屬的PK�。生物樣本采集要考慮到組織中的半衰期�。寡核苷酸藥物的組織分布研究是重中之重,比化藥和生物藥的開(kāi)展節(jié)點(diǎn)要提前很多��。另外,因種屬間代謝酶的一致性��,寡核苷酸類(lèi)代謝研究的意義是不如化藥的����。寡核苷酸類(lèi)通常不會(huì)是肝藥酶CYPs的代謝底物�,但確實(shí)有可能會(huì)影響CYPs或轉(zhuǎn)運(yùn)體的活性��,DDI風(fēng)險(xiǎn)還是需要重視的����。當(dāng)然��,不是所有研究均在IND之前完成�,很多試驗(yàn)可以在臨床期間提供。ONs類(lèi)產(chǎn)品還涉及偶聯(lián)組分�、遞送載體組分等引入的風(fēng)險(xiǎn),設(shè)計(jì)方案時(shí)也要注意甄別��,會(huì)影響到檢測(cè)指標(biāo)��。最后����,設(shè)計(jì)ONs類(lèi)產(chǎn)品的技術(shù)平臺(tái)背景數(shù)據(jù)是被OSWG很看重的����,對(duì)于ADME的具體研究?jī)?nèi)容影響很大。當(dāng)然����,本文是基于OSWG白皮書(shū)所寫(xiě)����,并不代表監(jiān)管機(jī)構(gòu)意見(jiàn)��,僅供參考�。