有關(guān)物質(zhì)檢查研究的主要內(nèi)容包括分析方法的建立與驗證、雜質(zhì)限度的確定�。本文將針對這兩方面的內(nèi)容,討論有關(guān)物質(zhì)的研究要求�,并指出申報資料中需要注意的幾個問題。
1�、分析方法的建立與驗證
有關(guān)物質(zhì)研究的首要問題是建立合適的分離和檢測方法。有關(guān)物質(zhì)的檢查方法包括化學(xué)法�����、光譜法和色譜法等���,其中色譜法最為常用�����。通常,可基于原料藥的合成工藝初步分析藥品中可能存在的工藝雜質(zhì)���,同時基于主藥的結(jié)構(gòu)分析其可能的降解途徑及降解產(chǎn)物�����,在此基礎(chǔ)上根據(jù)主藥及雜質(zhì)的理化性質(zhì)���、化學(xué)結(jié)構(gòu)及雜質(zhì)的控制要求等考慮選用合適的檢查方法���,例如HPLC、TLC�����、GC 或CE 等�����。
分析方法的建立包括分離檢測條件的篩選和優(yōu)化�����、方法的驗證兩個方面的研究工作�����。以有關(guān)物質(zhì)檢查最為常用的HPLC-UV 方法為例�,在方法的篩選和優(yōu)化研究中需要完成三部分的工作,即確定分離和檢測條件���、確定待測樣品的制備方法以及雜質(zhì)的定量方法�。其中,分離和檢測條件關(guān)系檢查方法的專屬性和靈敏度�,是方法建立過程中最為重要也最為復(fù)雜的研究內(nèi)容。一般而言�����,分離和檢測條件的確定包括以下幾個步驟:
?��、琶鞔_方法的檢測目標(biāo)并盡可能了解待測物質(zhì)的理化性質(zhì)���,選擇合適的含有潛在工藝雜質(zhì)或降解產(chǎn)物的預(yù)測性樣品(predictive sample)。例如原料藥粗品�、重結(jié)晶母液、破壞試驗樣品及已分離出的雜質(zhì)等用于色譜條件的篩選�。
⑵篩選固定相和流動相條件�����。通常是基于文獻(xiàn)和經(jīng)驗�����、待測物質(zhì)的理化性質(zhì)���,以及研究者對色譜柱�、溶劑和緩沖液等性質(zhì)的了解�����,選擇初步的色譜柱���、流動相�,并采用選定的預(yù)測性樣品對分離條件進(jìn)行考察�。重復(fù)這一篩選過程直至找到一個可以使各主要雜質(zhì)及主藥之間分離情況達(dá)到基本可接受水平的分離條件作為初始色譜條件。
?��、菍Τ跏忌V條件進(jìn)行優(yōu)化�����。設(shè)計一系列試驗考察色譜參數(shù)���,如有機(jī)相比例、pH���、流速���、柱溫和檢測波長等對雜質(zhì)分離和檢出的影響�����,并根據(jù)試驗結(jié)果確定最優(yōu)色譜參數(shù)�����。在優(yōu)化研究過程中還可以觀察到哪些參數(shù)對方法有顯著影響�,對這些參數(shù)應(yīng)在方法驗證研究的耐用性試驗中予以考察�����。
一些仿制藥品的有關(guān)物質(zhì)檢查方法在國內(nèi)外藥典中有收載或已有文獻(xiàn)報道�����,上述過程可能會簡化���。但是�,在無文獻(xiàn)可以參考時�,開發(fā)一個新方法的工作量會比較大���,花費(fèi)的時間也比較長�����。近年來���,在有關(guān)物質(zhì)檢查方法的開發(fā)研究中應(yīng)用了一些高效的方法開發(fā)策略�����,特別是計算機(jī)輔助的HPLC 色譜條件篩選方法發(fā)展很快�����,提高了篩選的效率�。
在確定檢查的色譜條件�����、分析樣品的制備方法以及雜質(zhì)的定量方法后�����,應(yīng)按照相關(guān)技術(shù)指導(dǎo)原則的要求開展方法學(xué)驗證工作( 中國藥典2010年版二部附錄172)���。需要注意的是�����,方法驗證工作是在檢查方法確定后開展的�,其目的是證明采用的方法適用于相應(yīng)檢測要求,檢查方法的篩選優(yōu)化研究不能代替方法的驗證工作�����,盡管二者的部分研究內(nèi)容有交叉���。
在方法的建立和驗證過程中�����,尚需要關(guān)注以下幾個問題:
?����、挪捎肏PLC-UV 法進(jìn)行檢查時�����,使用二極管陣列檢測器有著重要意義���,通過該檢測器可獲得各雜質(zhì)的紫外光譜信息,有助于判斷雜質(zhì)檢測波長選擇的合理性���,避免雜質(zhì)的漏檢�����,同時還可以進(jìn)行峰純度檢查�。
?、苾?yōu)化的檢測波長應(yīng)是主要雜質(zhì)的最大吸收,而不是主藥的最大吸收�,同時,應(yīng)使主藥和各主要雜質(zhì)的響應(yīng)差異最小�����。如果主藥和各主要雜質(zhì)的響應(yīng)差異較大�,例如超出了0.9 ~ 1.1 的范圍時,在采用主成分自身對照法進(jìn)行雜質(zhì)定量時需要加校正因子���。此外���,如用UV 低波長檢測時���,還應(yīng)考慮有機(jī)相中有機(jī)溶劑的截止使用波長。
?、沁m度的破壞試驗可用于考察分析方法對降解產(chǎn)物的檢出能力,也可用于考察主藥的降解途徑和降解產(chǎn)物�����。但是�,破壞試驗的目的不是使活性化合物完全降解,而只是要產(chǎn)生少量的降解產(chǎn)物�,通常在敏感條件下活性化合物降解10%~ 30%較為合適,過分降解將產(chǎn)生一些在生產(chǎn)和貯存條件下不可能生成的二級甚至三級降解產(chǎn)物���,對色譜條件的篩選不利�����。在破壞試驗中應(yīng)關(guān)注物料平衡情況�,但是由于降解產(chǎn)物和主藥的響應(yīng)可能存在差異或降解產(chǎn)物無法被檢出���、降解產(chǎn)物可能進(jìn)一步降解以及存在多條降解途徑等因素���,物料不平衡的現(xiàn)象還是較為常見���。
⑷在方法驗證的耐用性試驗中應(yīng)對色譜系統(tǒng)的適用性進(jìn)行考察�����,并通過耐用性評估�,建立一系列的系統(tǒng)適用性參數(shù)( 例如分離度等)���,以確保在任何時候使用該分析方法都是有效的�����。和方法優(yōu)化研究中對色譜參數(shù)的考察不同�,耐用性試驗中各試驗參數(shù)應(yīng)在一個比較窄的范圍內(nèi)變化以模擬正常的日間變異�。
2、雜質(zhì)限度的確定
雜質(zhì)控制的主要目的是將有害雜質(zhì)控制在安全范圍內(nèi)以保證臨床用藥的安全性�����,次要目的是合理控制藥品批間和有效期內(nèi)雜質(zhì)水平的波動以保證藥品質(zhì)量的均一性�。因此,安全性決定藥品中所能接受的雜質(zhì)水平,是確定雜質(zhì)限度的首要考慮因素�。如果某雜質(zhì)是主藥在動物或人體中的主要代謝產(chǎn)物,則可不考慮其安全性�����。另外�����,對于具有基因毒性和致癌性的雜質(zhì)�����,在確定限度時應(yīng)予以特別關(guān)注�。在符合安全性要求的前提下,確定雜質(zhì)限度還要結(jié)合工藝的可行性和貯存的方便性考慮�����。
獲取雜質(zhì)安全性信息主要有3 種途徑�����。第一�����,針對某雜質(zhì)進(jìn)行安全性研究直接獲取安全性信息,研究用樣品可以采用含有較高水平該雜質(zhì)的原料藥或制劑���,也可以采用分離出的雜質(zhì)單體;第二�����,通過和已上市產(chǎn)品進(jìn)行雜質(zhì)對比研究間接獲取雜質(zhì)的安全性信息;第三�����,通過檢索文獻(xiàn)獲取某特定雜質(zhì)的毒性數(shù)據(jù)。
對于大多數(shù)創(chuàng)新藥���,雜質(zhì)安全性信息主要來源于整個研發(fā)過程中各項安全性研究結(jié)果�,包括非臨床毒理研究和臨床研究�。一般而言,在創(chuàng)新藥開發(fā)過程中�����,按照毒理研究樣品���、臨床研究樣品和上市產(chǎn)品的順序���,其中的雜質(zhì)含量應(yīng)依次遞減�,毒理研究用樣品中的雜質(zhì)含量應(yīng)該最高���。上市產(chǎn)品雜質(zhì)限度的確定要基于對整個研發(fā)過程中雜質(zhì)數(shù)據(jù)的積累和分析�,特別是臨床前主要安全性研究�����、臨床研究所用樣品的雜質(zhì)數(shù)據(jù)�����,以及規(guī)?����;a(chǎn)條件下產(chǎn)品的雜質(zhì)數(shù)據(jù)�。例如,某一創(chuàng)新藥的日給藥量為0.5 g�,原料藥雜質(zhì)數(shù)據(jù)和擬定限度見表1。
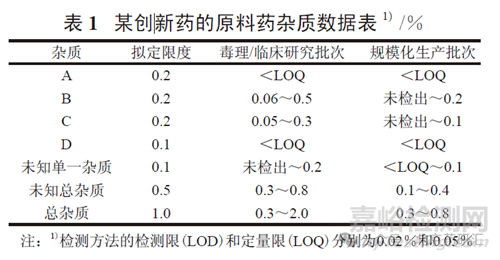
基于表1 中的雜質(zhì)數(shù)據(jù)對原料藥擬定雜質(zhì)限度的合理性分析如下:
對于雜質(zhì)A���,0.2%的擬定限度高于毒理和臨床研究用批次的檢測結(jié)果���,也高于規(guī)?;a(chǎn)批次的實測結(jié)果�����,限度依據(jù)不充分;按照雜質(zhì)研究相關(guān)技術(shù)指導(dǎo)原則的要求���,同時考慮到規(guī)?��;a(chǎn)批次雜質(zhì)數(shù)據(jù),降低到0.1%較為合理�����。
對于雜質(zhì)B�,0.2%的限度有毒理/ 臨床研究批次的雜質(zhì)數(shù)據(jù)支持�����,但和規(guī)?;a(chǎn)批次的實測結(jié)果相比過緊;放寬到0.3%仍可以保證安全性�����,同時也可避免實際生產(chǎn)的雜質(zhì)B 含量在0.2%~ 0.3%之間的產(chǎn)品被判為“ 不合格”���。
對于雜質(zhì)C,0.2%的限度有毒理/ 臨床研究批次的雜質(zhì)數(shù)據(jù)支持�����,也和規(guī)?����;a(chǎn)批次的實測結(jié)果相當(dāng)�,因此可認(rèn)為是合理的。
對于雜質(zhì)D���,0.1%的限度高于毒理/ 臨床研究批次�、規(guī)?;a(chǎn)批次的檢測結(jié)果,但符合相關(guān)指導(dǎo)原則的要求�,是可以接受的。
單個未知雜質(zhì)0.1%的限度符合相關(guān)指導(dǎo)原則的規(guī)定���。未知雜質(zhì)總量(0.5% ) 和雜質(zhì)總量(1.0% ) 分別與各種批次的雜質(zhì)數(shù)據(jù)�、單個雜質(zhì)限度之和吻合,均是可以接受的���。
對于仿制藥( 包括仿制國內(nèi)���、外上市藥品),研制產(chǎn)品與已上市原研產(chǎn)品的雜質(zhì)對比研究是論證雜質(zhì)安全性和限度的較為簡便的方法�����。另外�����,對于特定雜質(zhì)的限度也可引用藥典標(biāo)準(zhǔn)���、文獻(xiàn)進(jìn)行論證。
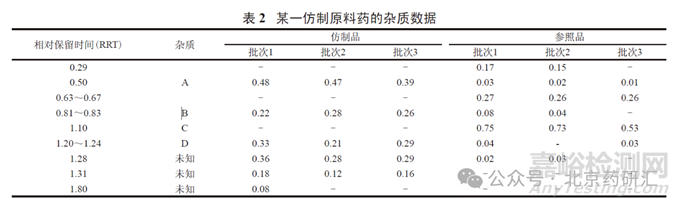
但是�,通過上述途徑無法論證時,例如研制產(chǎn)品中含有已上市參照品中未含有的新雜質(zhì)�,且含量超過了相關(guān)技術(shù)指導(dǎo)原則規(guī)定的質(zhì)控限度,則需要進(jìn)行安全性研究以獲取雜質(zhì)的直接安全性數(shù)據(jù)���。例如�,某一仿制原料藥( 最大日劑量為300 mg) 的雜質(zhì)數(shù)據(jù)見表2。
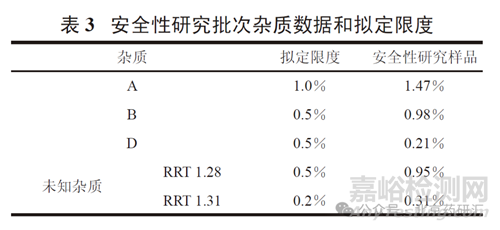
表2 數(shù)據(jù)顯示�,仿制品和上市參照品的雜質(zhì)譜不完全相同,包括雜質(zhì)種類和主要雜質(zhì)含量均有較大差別���。仿制品中三個已知雜質(zhì)(A�、B���、D) 的含量均高于上市品���,且高于ICH 指導(dǎo)原則規(guī)定的界定閾值(qualifi cation threshold)0.15% [2]。其中���,雜質(zhì)B 本身為一上市藥物�����,有長期人用歷史�,雜質(zhì)D為主藥在人體內(nèi)產(chǎn)生的主要代謝產(chǎn)物�,在制定限度時可以不考慮安全性問題。此外,仿制品中的兩個未知雜質(zhì)(RRT 1.28 和1.31) 也高于 0.15%�。且缺乏試驗和文獻(xiàn)資料支持其安全性,需要進(jìn)行必要的安全性研究�。安全性研究(遺傳毒性試驗、重復(fù)給藥毒性試驗) 所用仿制品批次的雜質(zhì)數(shù)據(jù)見表3�。安全性研究結(jié)果支持所擬定的各雜質(zhì)限度。
3�、提交申報資料需要關(guān)注的問題
為幫助審評人員準(zhǔn)確了解有關(guān)物質(zhì)的研究和控制情況,國內(nèi)注冊的申報資料中應(yīng)按照指導(dǎo)原則及其它相關(guān)規(guī)定的要求提供全面���、詳細(xì)的有關(guān)物質(zhì)研究信息���,需要關(guān)注以下問題:
⑴對原料藥在合成���、精制和貯存過程中實際或可能產(chǎn)生的雜質(zhì)進(jìn)行綜述;對制劑生產(chǎn)和穩(wěn)定性考察中觀察到的降解產(chǎn)物進(jìn)行綜述�,包括原料藥與輔料或內(nèi)包裝材料�����、封閉物之間的反應(yīng)產(chǎn)物���。綜述中應(yīng)包括雜質(zhì)的化學(xué)名稱、結(jié)構(gòu)式和來源分析( 例如合成起始原料�、反應(yīng)中間體�����、反應(yīng)副產(chǎn)物和降解產(chǎn)物等)�。
?����、茖τ谛陆ǖ挠嘘P(guān)物質(zhì)檢查方法���,應(yīng)提供方法的研究報告���,包括試驗資料和支持性圖譜,以清晰展示檢查方法的建立和優(yōu)化過程;采用藥典�����、文獻(xiàn)方法�,如對試驗參數(shù)進(jìn)行了調(diào)整和優(yōu)化,亦應(yīng)提供調(diào)整前后的對比研究資料�。同時,應(yīng)根據(jù)分析方法的目的�,提供完整的驗證資料,注意根據(jù)耐用性試驗結(jié)果建立合適的系統(tǒng)適用性要求。
?����、菍τ趧?chuàng)新藥���,需要提供藥品研制過程中所有批次樣品( 包括用于安全性�、臨床研究的樣品) 的雜質(zhì)檢測數(shù)據(jù)�,并對整個研發(fā)過程中的不同規(guī)模樣品的雜質(zhì)情況進(jìn)行比較,對差異進(jìn)行討論�����。對于仿制藥以及已上市產(chǎn)品的改劑型產(chǎn)品�,一般還要提供和已上市產(chǎn)品的有關(guān)物質(zhì)對比檢測數(shù)據(jù)?��;谏鲜鰯?shù)據(jù)以及穩(wěn)定性研究中雜質(zhì)檢查數(shù)據(jù)�,詳細(xì)論述各雜質(zhì)限度確定的依據(jù)���。
?����、葘τ谒幤分袑嶋H存在的���、含量大于鑒定限度的雜質(zhì)應(yīng)說明結(jié)構(gòu)研究情況,已鑒定結(jié)構(gòu)的應(yīng)提供結(jié)構(gòu)研究資料�����,未能鑒定結(jié)構(gòu)的亦應(yīng)說明所開展的研究���。如研究或質(zhì)量標(biāo)準(zhǔn)中使用了雜質(zhì)對照品���,要提供雜質(zhì)對照品的來源或制備工藝、結(jié)構(gòu)確證���、純度標(biāo)定和質(zhì)量標(biāo)準(zhǔn)等資料�����。
?����、砂凑账幤穼徳u中心發(fā)布的《藥品研究色譜數(shù)據(jù)工作站及色譜數(shù)據(jù)管理要求( 一)》附件1 的要求提供規(guī)范的支持性圖譜���,包括方法研究和驗證的全部圖譜�、穩(wěn)定性研究中的全部圖譜及代表性批次的圖譜���。
4�����、結(jié)語
有關(guān)物質(zhì)是影響藥品安全性的因素之一�����,而有關(guān)物質(zhì)檢查研究是目前我國藥品研發(fā)中的薄弱點之一���。要全面提升我國藥品研發(fā)的水平、切實保證公眾用藥的安全性�,必須重視并加強(qiáng)有關(guān)物質(zhì)的研究。