一��、申報資料發(fā)補率統(tǒng)計
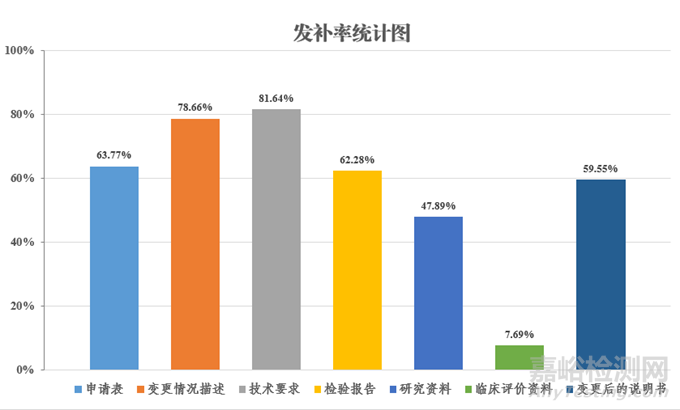
2023年度�����,江蘇省藥監(jiān)局審評中心共接收醫(yī)療器械變更注冊申報427件�����,發(fā)補403件�����,變更注冊發(fā)補率94.38%�����。審評發(fā)補意見主要集中在申請表���、變更情況描述��、產(chǎn)品技術(shù)要求(僅需上傳變更情況對比表)�����、檢驗報告��、研究資料���、臨床評價資料和變更后的說明書七部分(發(fā)補率統(tǒng)計詳見圖1)���。其中,
◆申請表發(fā)補率63.77%
◆變更情況描述發(fā)補率78.66%
◆產(chǎn)品技術(shù)要求發(fā)補率81.64%
◆檢驗報告發(fā)補率62.28%
◆研究資料發(fā)補率47.89%
◆臨床評價資料發(fā)補率7.69%
◆變更后的說明書發(fā)補率59.55%
圖1 變更注冊技術(shù)審評常見資料發(fā)補率統(tǒng)計圖
二��、變更注冊申報常見問題分析
1��、申請表
注冊申請表是注冊流程中最先審查的文件���,記錄著醫(yī)療器械產(chǎn)品的基本信息。在企業(yè)申報過程中���,發(fā)現(xiàn)主要存在以下幾點問題:
(1)產(chǎn)品新增型號�����,新增的型號與老型號技術(shù)原理���、結(jié)構(gòu)組成、性能指標��、適用范圍不同時�����,未根據(jù)《醫(yī)療器械注冊單元劃分指導(dǎo)原則》及相應(yīng)產(chǎn)品的指導(dǎo)原則劃分為不同注冊單元。
(2)申請表中“許可事項變更注冊”的勾選存在漏選錯選問題�����。如:產(chǎn)品技術(shù)要求中有產(chǎn)品型號信息�����,申報產(chǎn)品型號發(fā)生變化��,“許可事項變更注冊”未勾選“產(chǎn)品技術(shù)要求變化”項��。
2��、變更情況描述
(1)未使用制式表格《江蘇省第二類醫(yī)療器械(含體外診斷試劑)變更情況對比表》��。
(2)變更情況描述不全面���,變更原因未明確���。
(3)變更情況描述與其他申報資料內(nèi)容不一致。
3、產(chǎn)品技術(shù)要求(僅需上傳變更情況對比表):
(1)未使用制式表格《江蘇省第二類醫(yī)療器械(含體外診斷試劑)變更情況對比表》��。
(2)未按要求僅上傳變更情況對比表���;
技術(shù)要求中發(fā)生變化的條款及內(nèi)容未在對比表中體現(xiàn)���。
(3)性能指標變更不合理;
新增型號性能指標不全面��,檢驗方法不合理��;
引用作廢標準��,未標明引用標準的年號或標準號有誤�����。
(4)檢驗方法與檢驗檢測機構(gòu)蓋章版技術(shù)要求中的檢驗方法不一致���。
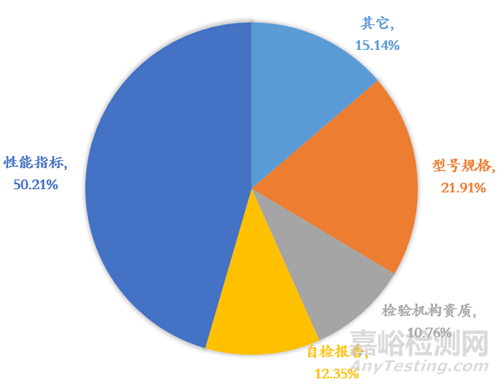
4、檢驗報告
(1)注冊檢驗樣品的生產(chǎn)地址未包含注冊申請表中的“生產(chǎn)地址”��,檢測報告無效�����。
(2)新增的型號不能被老型號覆蓋,未對新增的型號進行型式檢驗�����;
檢驗報告樣品描述未包含所有新增型號��;
若新增型號能被老型號覆蓋���,未出具關(guān)于型號覆蓋的說明���。
(3)檢驗報告未能完全涵蓋產(chǎn)品變更部分性能指標;
技術(shù)要求中檢驗方法發(fā)生實質(zhì)性變化�����,未提供相應(yīng)的檢驗報告���。
(4)產(chǎn)品結(jié)構(gòu)組成發(fā)生的變化影響產(chǎn)品性能指標��,性能指標未進行檢測��。
(5)檢驗報告未加蓋檢驗檢測機構(gòu)的檢驗檢測專用章或者公章���,授權(quán)簽字人未簽字���。
(6)對產(chǎn)品技術(shù)要求完全采用國家標準、行業(yè)標準的�����,檢驗報告未加蓋資質(zhì)認定標志CMA章���;
產(chǎn)品技術(shù)要求不涉及或部分涉及國家標準�����、行業(yè)標準的�����,檢驗報告未加蓋CMA章時�����,未在報告書備注中對承檢能力予以自我聲明,承擔相應(yīng)的法律責任�����。
(7)提供的檢驗報告未包含樣品照片和說明���,或樣品的照片和說明未體現(xiàn)產(chǎn)品的包裝�����、標簽���、樣品實物圖、內(nèi)部結(jié)構(gòu)圖(如適用)等���。
(8)提供自檢報告的���,未按照按《醫(yī)療器械注冊自檢管理規(guī)定》提交相關(guān)資料。
圖2 檢驗報告發(fā)補原因統(tǒng)計圖