一����、標(biāo)準(zhǔn)編號(hào)及標(biāo)準(zhǔn)名稱
GB/T 44672—2024《體外診斷醫(yī)療器械 建立校準(zhǔn)品和人體樣品賦值計(jì)量溯源性的國際一致化方案的要求》國家標(biāo)準(zhǔn)于2024年9月29日發(fā)布,2025年4月1日實(shí)施��。本標(biāo)準(zhǔn)等同采用國際標(biāo)準(zhǔn)ISO 21151:2020��,由國家藥品監(jiān)督管理局提出�,全國醫(yī)用臨床檢驗(yàn)實(shí)驗(yàn)室和體外診斷系統(tǒng)標(biāo)準(zhǔn)化技術(shù)委員會(huì)(SAC/TC136)歸口����。
二����、標(biāo)準(zhǔn)制定背景
在不同實(shí)驗(yàn)室使用不同的體外診斷醫(yī)療器械(IVD MD)測定同一人體樣品的同一被測量應(yīng)具有等效的數(shù)值結(jié)果。只有當(dāng)無論使用何種IVD MD��,其檢測結(jié)果都等效,并能基于統(tǒng)一決定限解釋實(shí)驗(yàn)室結(jié)果以指導(dǎo)臨床診斷和治療決策時(shí)��,實(shí)踐指南才可能有效實(shí)施��。檢驗(yàn)醫(yī)學(xué)已采納IVD MD校準(zhǔn)向高等級參考標(biāo)準(zhǔn)計(jì)量學(xué)溯源的原理�,作為實(shí)現(xiàn)同一被測量不同IVD MD、不同測量時(shí)間或不同測量地點(diǎn)結(jié)果等效的基礎(chǔ)�。ISO17511:2020描述了參考測量系統(tǒng)的6種校準(zhǔn)層級結(jié)構(gòu)(參見ISO17511:20205.2至5.7中的情形),它們滿足校準(zhǔn)向高等級參考標(biāo)準(zhǔn)計(jì)量學(xué)溯源的要求�。對情形5.6中(適用于人體樣品中的被測量由國際一致化方案定義的情況;此種情況下�,沒有國際認(rèn)可的參考測量程序,沒有一級參考物質(zhì)��,沒有約定參考測量程序或參考物質(zhì)�,也不能溯源到SI單位)的被測量,在技術(shù)上很難研制高等級參考標(biāo)準(zhǔn)��,因此需要一種基于約定方案的標(biāo)準(zhǔn)化路徑����,以實(shí)現(xiàn)兩種或以上IVD MD結(jié)果等效。為此����,制定本標(biāo)準(zhǔn)以規(guī)范此類一致化方案的建立和實(shí)施��,填補(bǔ)現(xiàn)有溯源體系的空白����。
三�、標(biāo)準(zhǔn)適用范圍及主要內(nèi)容
(一)適用范圍
適用于無參考測量程序、無適用有證參考物質(zhì)或國際約定校準(zhǔn)品的被測量����;適用于存在有證參考物質(zhì)或國際約定校準(zhǔn)品,但因與人體樣品缺乏互換性等原因不適用的情況��。其核心是為 ISO 17511:2020中情形5.6的被測量提供一致化方案框架����,定義該類被測量的最高水平計(jì)量溯源性無參考測量程序、有證參考物質(zhì)或國際約定校準(zhǔn)品的被測量(對應(yīng)ISO 17511:2020中的情形5.6)����,通過一致化方案實(shí)現(xiàn)兩種或以上IVD MD間結(jié)果等效。
(二)主要內(nèi)容
GB/T44672—2024/ISO 21151:2020《體外診斷醫(yī)療器械 建立校準(zhǔn)品和人體樣品賦值計(jì)量溯源性的國際一致化方案的要求》共有6個(gè)章節(jié)����,1個(gè)附錄�,分別從范圍����、規(guī)范性引用文件��、術(shù)語和定義��、縮略語和符號(hào)�、一致化方案的要求、使用說明中提供的計(jì)量溯源性信息6方面對建立校準(zhǔn)品和人體樣品賦值計(jì)量溯源性的國際一致化方案進(jìn)行了規(guī)定�。
1.術(shù)語與定義
明確 “一致化”“一致化參考物質(zhì)”“國際一致化方案”等核心術(shù)語。如“一致化”指通過國際共識(shí)方案實(shí)現(xiàn)不同IVD MD結(jié)果等效����,且溯源至該方案而非SI單位。
2.一致化方案的核心要求
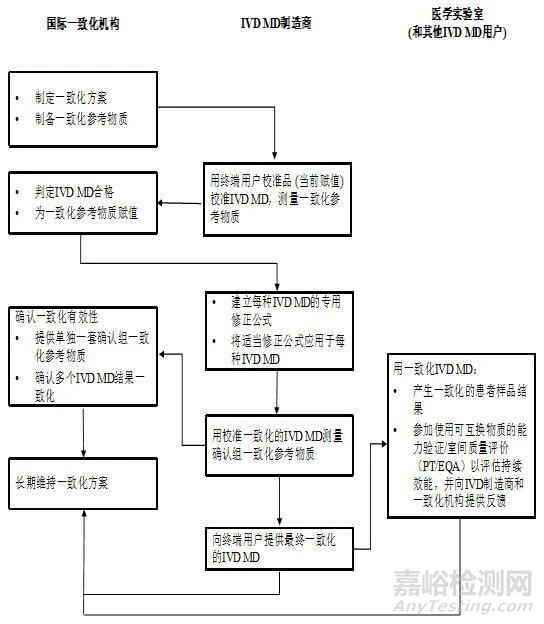
(1)被測量:需按ISO 17511:2020定義被測量����,確保檢測目標(biāo)清晰;
(2)IVD MD的納入/排除標(biāo)準(zhǔn):基于精密度��、回收率�、選擇性等性能特性,結(jié)合臨床決策影響評估��,明確哪些IVD MD可參與方案����;
(3)一致化參考物質(zhì):規(guī)定參考物質(zhì)的制備(如人體樣品盤����、混合樣品)����、均勻性、穩(wěn)定性����、互換性(與人體樣品的一致性)要求,確保其適用性�;
(4)量值賦值與校準(zhǔn)改進(jìn):描述參考物質(zhì)的賦值程序(如統(tǒng)計(jì)方法、算法)����,要求制造商通過校準(zhǔn)層級調(diào)整(如修正終端用戶校準(zhǔn)品賦值)實(shí)現(xiàn)結(jié)果一致化;
(5)有效性與可持續(xù)性:需通過獨(dú)立樣品驗(yàn)證方案有效性����,并制定長期維持策略(如替換參考物質(zhì)批次、監(jiān)測結(jié)果穩(wěn)定性)����;
(6)新IVD MD的納入:需明確未參與初始方案的IVD MD(如性能改進(jìn)后或新上市產(chǎn)品)的一致化流程��。
3.計(jì)量溯源性信息
要求制造商在使用說明中明確校準(zhǔn)層級采用的一致化方案及負(fù)責(zé)機(jī)構(gòu),保障終端用戶的知情權(quán)��。
4.資料性附錄
提供一致化方案的工作示例(以“R 肽”檢測為例)����,演示從參考物質(zhì)制備、賦值到結(jié)果驗(yàn)證的全流程����,有助于對標(biāo)準(zhǔn)的理解和后續(xù)執(zhí)行。
5.一致化方案流程圖
四��、標(biāo)準(zhǔn)實(shí)施意義
1.提升臨床檢驗(yàn)質(zhì)量:通過統(tǒng)一校準(zhǔn)品賦值和結(jié)果溯源路徑�,降低不同IVD MD間的系統(tǒng)誤差,確保不同檢測系統(tǒng)對同一患者樣品的測定結(jié)果可比�,減少因結(jié)果差異導(dǎo)致的誤診、漏診����,提升醫(yī)療質(zhì)量。
2.支持公共衛(wèi)生決策:確?���?鐚?shí)驗(yàn)室�、跨地區(qū)的檢驗(yàn)結(jié)果等效�,為疾病篩查、療效監(jiān)測等公共衛(wèi)生行動(dòng)提供數(shù)據(jù)支撐����。
3.促進(jìn)產(chǎn)業(yè)升級:規(guī)范體外診斷產(chǎn)品的研發(fā)與生產(chǎn),推動(dòng)制造商采用統(tǒng)一的溯源邏輯��,促進(jìn)行業(yè)技術(shù)升級����;推動(dòng)IVD MD制造商優(yōu)化校準(zhǔn)體系,提升產(chǎn)品國際競爭力����,助力我國體外診斷產(chǎn)業(yè)與國際標(biāo)準(zhǔn)接軌。
4.保障患者安全:減少因結(jié)果不一致導(dǎo)致的誤診或治療不當(dāng)�,為臨床精準(zhǔn)診療提供技術(shù)保障。
5.行業(yè)和國際影響力:通過等同采用ISO標(biāo)準(zhǔn)��,實(shí)現(xiàn)與國際接軌��,助力我國體外診斷產(chǎn)品的國際化及檢驗(yàn)結(jié)果的跨境互認(rèn)����;為監(jiān)管機(jī)構(gòu)提供評估IVD MD性能的統(tǒng)一標(biāo)準(zhǔn)��,強(qiáng)化對體外診斷產(chǎn)品的質(zhì)量管控��,保障患者安全��。